
Лекции Термодинамика
.pdf
Термодинамика 121
Реальные процессы
Обратимый процесс – это идеальный процесс. Совершаемые в природе процессы изменения состояния являются необратимыми процессами. Реальные тепловые процессы всегда необратимы, т.к. они сопровождаются теплообменом (тепловыми потерями) и трением.
Термодинамика 122
Работа при необратимом процессе
Если тело необратимо переходит из одного состояния в другое, то работа, производимая при этом, будет меньше той работы, которая была бы совершена при обратимом процессе:
Lнеобр < Lобр
Если в системе происходит необратимый процесс, то для ее возвращения в первоначальное (исходное) состояние должна быть затрачена работа извне.

Термодинамика 123
КПД при необратимых циклах
Для необратимых циклов вследствие тепловых и механических потерь:
ηнеобр <ηобр
Термодинамика 124
Интеграл Клаузиса
С учетом знаков (подвод тепла «+», отвод «–») уравнение для цикла Карно можно записать так:
Q1 |
+ |
Q2 |
= 0 |
|
T |
T |
|||
|
|
|||
1 |
2 |
|
||
Любой обратимый цикл можно разбить на бесконечно малые участки, каждый из которых является циклом Карно. Тогда:
∑ Qi = 0 → v∫ dQ = 0
цикл Ti T

Термодинамика 125
Неравенство Клаузиса
Для необратимого цикла Карно
Q1 |
+ |
Q2 |
< 0 |
|
T |
T |
|||
|
|
|||
1 |
2 |
|
||
Для произвольного цикла справедливо:
v∫ dQT ≤ 0
знак «=» – для обратимых; знак «<» – для необратимых.
Термодинамика 126
Энтропия
Величина S, дифференциал которой равен отношению бесконечно малого подвода тепла при обратимом процессе к температуре тела, называется энтропией.
dS = δQ
T обр
Энтропия – функция состояния. Она зависит только от термодинамических параметров в каждом состоянии и не зависит от пути перехода между состояниями тела.

Термодинамика 127
Законы термодинамики
Из второго закона термодинамики для обратимых процессов:
δQ =TdS
Первый закон термодинамики тогда запишется:
TdS = dU +δL
Для идеального газа:
TdS = cvdT + pdV
Термодинамика 128
Энтропия для необратимых процессов
Для необратимых процессов:
dS > δQ
T необр
Для произвольных процессов:
dS ≥ δTQ

Термодинамика 129
Изменение энтропии замкнутых систем
Система называется адиабатно замкнутой
(изолированной), если она не обменивается теплом и веществом с окружающими ее телами.
В этом случае:
δQ = 0
Тогда:
dS ≥ 0
Энтропия замкнутых систем не уменьшается!
Термодинамика 130
Философский смысл
Из статистической физики следует, что энтропия – это мера термодинамического беспорядка в системе.
Таким образом, изолированная термодинамическая система самопроизвольно стремится к термодинамическому беспорядку (хаосу).
Термодинамика |
131 |
|
|
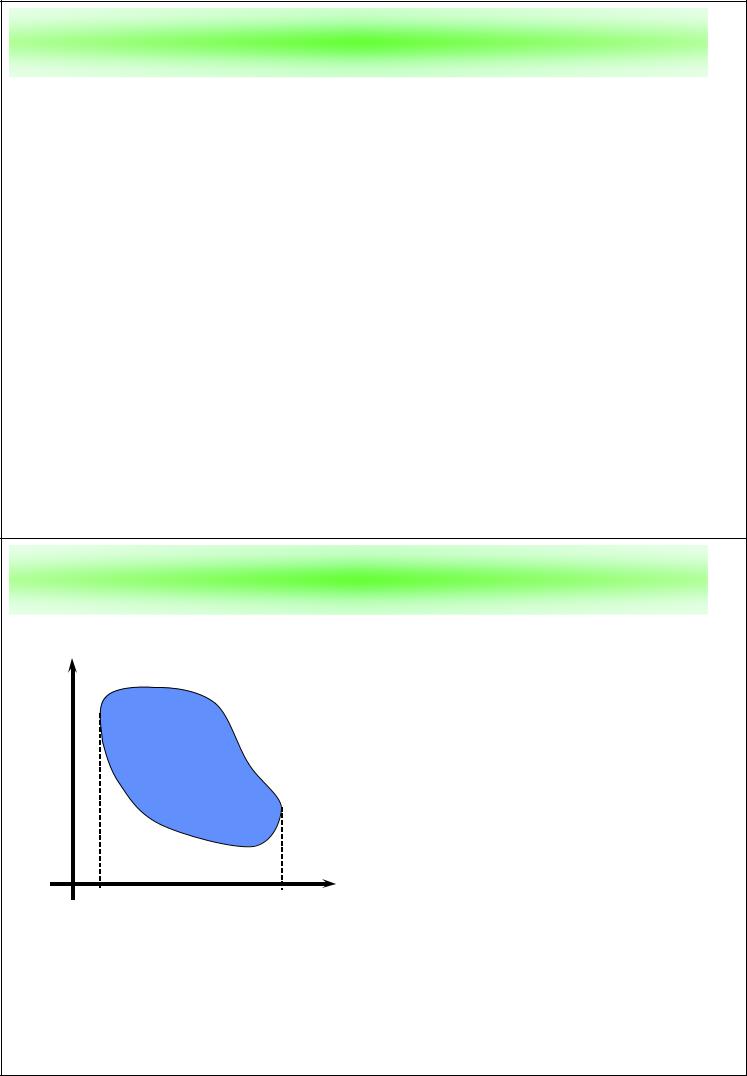
T–s диаграмма |
|
Большое значение при изучении термодинамических процессов имеет их изображение на T–s диаграмме. (Это возможно, так как энтропия также является
параметром состояния). Т.к. |
s2 |
δq =Tds |
q = ∫Tds |
s1
то на ней площадь, под кривой процесса, равна теплоте, подводимой (отводимой) в процессе. Поэтому T–s диаграмму называют тепловой диаграммой.
В свою очередь, p–v диаграмма – рабочая диаграмма.
|
|
Термодинамика |
132 |
|
|
|
|
T b |
КПД на T–s диаграмме |
|
|
c |
КПД цикла, изображен- |
||
S |
|
ного на T-s диаграмме, |
|
|
равен отношению |
|
|
dплощади внутри цикла к площади под самой
a |
e s |
верхней кривой цикла: |
|
|
|
||
|
η = |
S |
|
|
|
||
|
S(abcde) |
|
|
Термодинамика 133
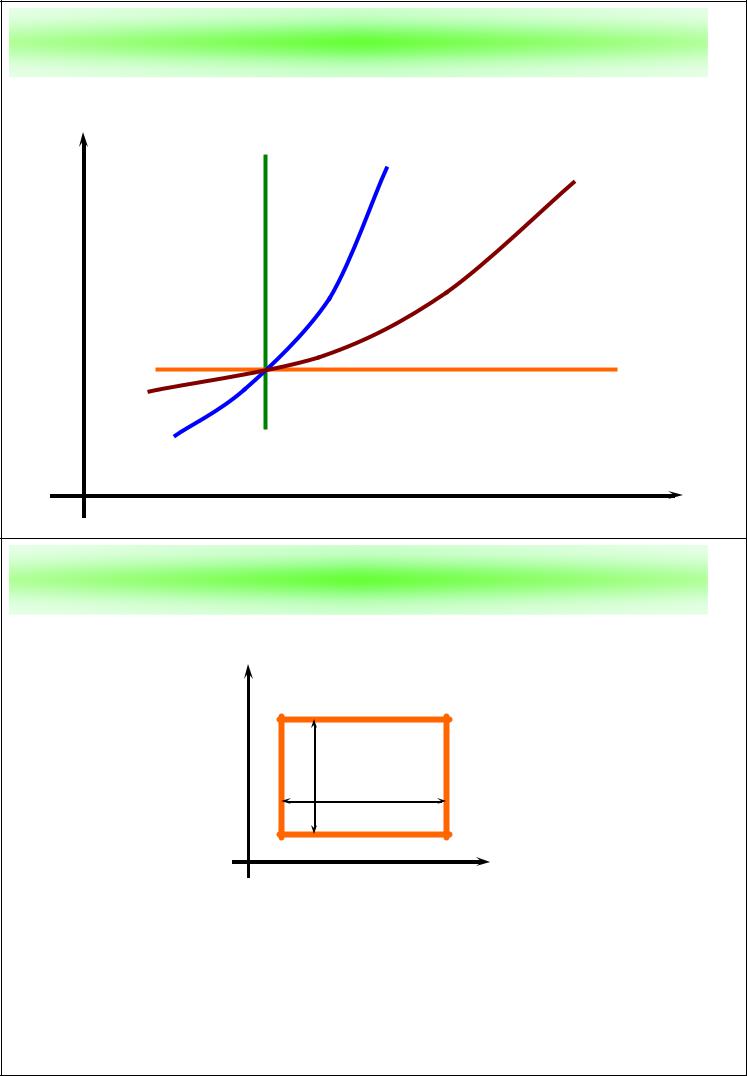
Процессы в газе на T–s диаграмме
T |
адиабата |
изохора |
|
изобара
изотерма
s
Термодинамика 134
Цикл Карно на T–s диаграмме
T
T
s
s
Можно показать, что максимальный КПД цикла при заданной разности температур T нагревателя и холодильника и заданной разности энтропий s достигается при Цикле Карно.
Термодинамика 135
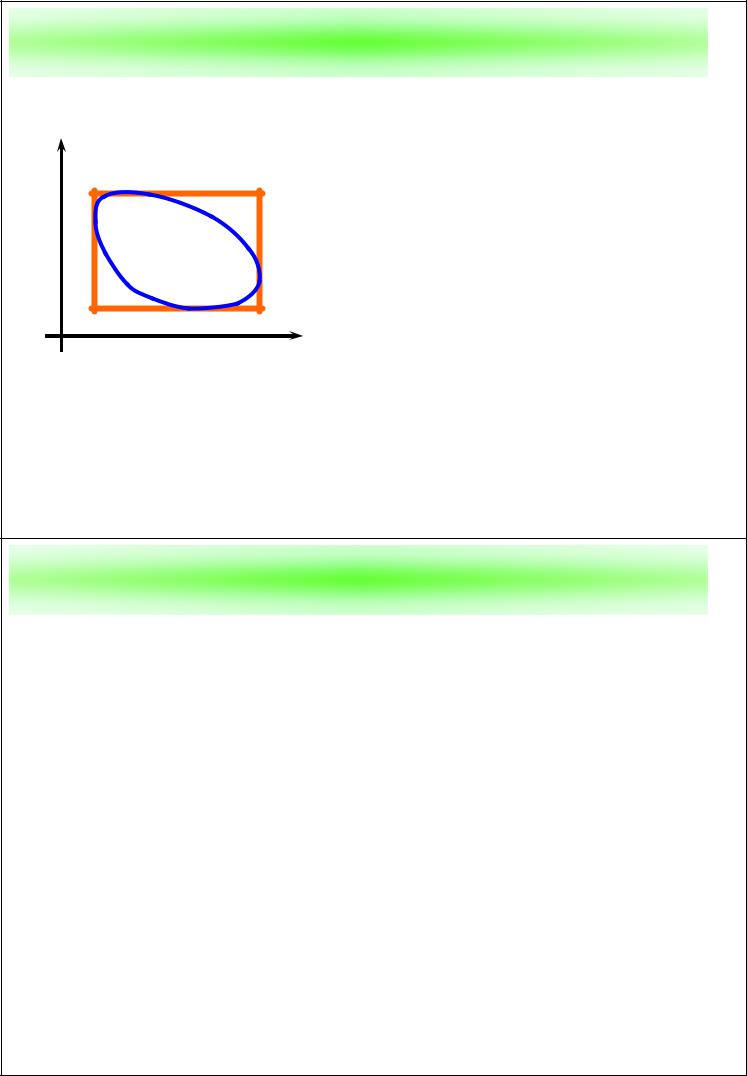
Цикл Карно на T–s диаграмме
При исследовании обрати- T мых циклов степень
совершенства произвольного обратимого цикла определяется тем, насколько термический
s КПД этого цикла близок к
термическому КПД обратимого цикла Карно, осуществляемого
между крайними температурами и крайними значениями энтропии.
Термодинамика 136
Цикл Карно на T–s диаграмме
Отношение площадей произвольного цикла и цикла Карно, в который «вписан» выбранный цикл, называется коэффициентом заполнения цикла μ < 1.
Чем больше коэффициент заполнения μ, тем ближе цикл к наиболее эффективному преобразованию тепла в работу.
Совершенствование циклов с целью приближения к циклу Карно (увеличение коэффициента заполнения цикла) называется карнотизацией цикла.

Термодинамика 137
Основные соотношения термодинамики для переходов тепла
Термодинамика 138
Количество тепла при нагреве тела
Количество теплоты, необходимое для нагрева массы m вещества теплоемкости c от температуры tн до температуры tк , определяется выражением:
Q = mc(tк −tн)
Тепло, необходимое для нагрева жидкости от температуры tн до температуры tк , при движении её в канале с расходом G в течение времени τ, равно:
Q = Gc(tк −tн) τ
G – масса жидкости, проходящая через какое-либо поперечное сечение (канал) в единицу времени [кг/с].

Термодинамика 139
Количество тепла при испарении
Количество теплоты, необходимое для испарения массы m какого-либо вещества равно:
Q = mr
r – удельная теплота парообразования Для воды r = 2, 26 106 Дж/кг
Процесс испарения обратим – конденсация. При конденсации выделяется тепло, равное mr.
Термодинамика 140
Количество тепла при плавлении
Количество теплоты, необходимое для плавления массы m какого-либо вещества равно:
Q = mλ
λ – удельная теплота плавления
Для льда λ = 0,334 106 Дж/кг
Процесс плавления обратим – затвердевание, кристаллизация.
При затвердевании выделяется тепло, равное mλ.
