
Лекции Термодинамика
.pdf
Термодинамика 21
Идеальный газ (ИГ)
Идеальный газ – это газ, у которого нет притяжения между молекулами, и молекулы не имеют размера и объема.
Идеальный газ – модель, достаточно хорошо описывающая реальные газы в «комнатных» условиях.
Термодинамика 22
Термическое уравнение состояния ИГ
p = ρ R T |
Закон |
|||
p = |
m |
R T |
||
Менделеева- |
||||
|
||||
|
V |
Клайперона |
||
p V μ = m R0 T |
||||
|
||||
R − газовая постоянная (свойство газа).
R = |
R0 |
|
|
R =8,314 |
Дж |
|
|
|
|
||||
|
μ |
|
0 |
моль К |
|
|
|
|
|
|
|||
R0 − универсальная газовая постоянная;
μ – молярная масса (по таблице Менделеева).
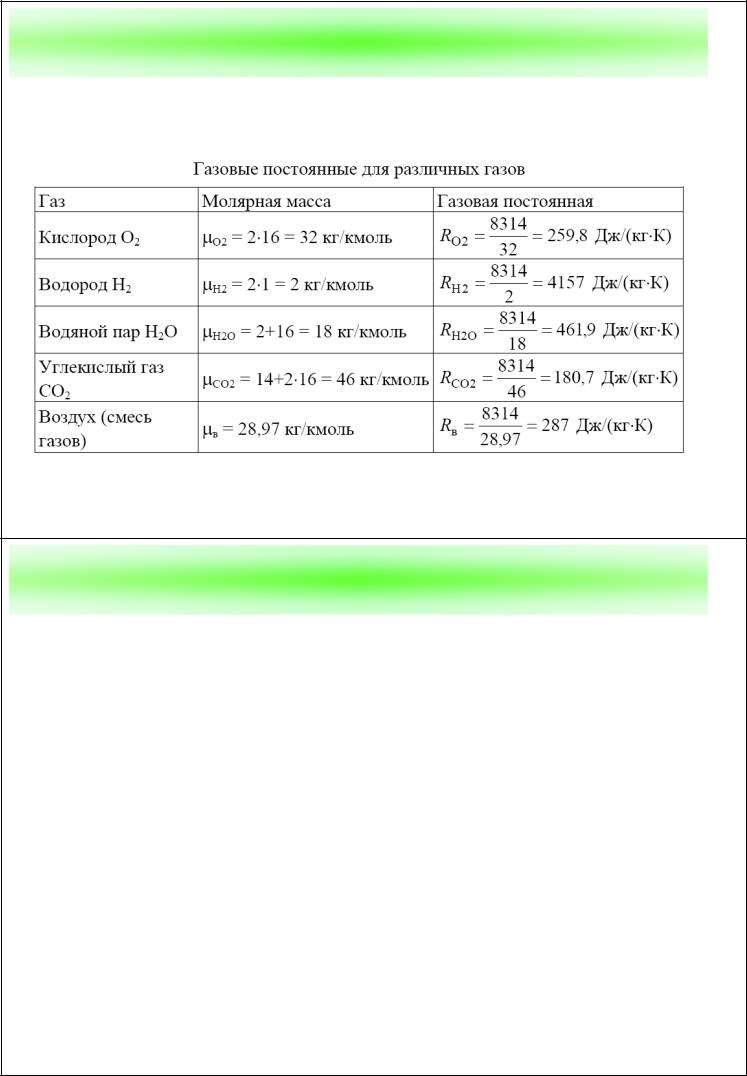
Термодинамика 23
Примеры данных
Термодинамика 24
Объем ИГ при нормальных условиях
При нормальных условиях 1 кмоль любого газа занимает объем 22,41 м3.

Термодинамика 25
Реальные газы
В реальных газах за счет необходимости учета сил притяжения и отталкивания молекул и их размеров уравнение становится гораздо сложнее, но суть зависимости остается: удельный объем или плотность зависят от температуры и давления:
v= v(T , p)
ρ= ρ(T , p)
Термодинамика 26
Конец лекции 1

Термодинамика 27
Домашние задачи
Термодинамика 28
Задача 1
Барометр, установленный на баке объема 10м3, показывает давление 3МПа. Внутри бака испарена вода массой 130 кг. Какова температура внутри бака? Воздухом в баке пренебречь.

Термодинамика 29
Задача 2
Цилиндр длины 1 м поделен подвижным поршнем. В одну половину цилиндра помещен кислород, в другую водород равных масс. Каково равновесное положение поршня?
Термодинамика 30
Задача 3
Камера автомобиля имеет объем 30000 см3. Летом при температуре 20°С ее накачали до 2 атм., зимой при – 20°С замерили давление и оно оказалось равным 1,5 атм. Какова утечка воздуха?

Термодинамика 31
Лекция 2
Термодинамика 32
Газовые смеси
Рассмотрим однородную смесь нескольких газов. Все параметры, относящиеся к смеси будем сопровождать индексом «см», а параметры отдельной составляющей – индексом «i».

Термодинамика |
33 |
|
|
Газовые смеси |
|
Если смесь находится в равновесии, то темпера- |
|
тура всех составляющих газов одинакова и равна |
|
температуре смеси Tсм. |
|
В таком состоянии молекулы каждого газа |
|
рассеяны равномерно по всему объему смеси, они |
|
имеют свою концентрацию ni и свое давление pi, |
|
называемое парциальным. |
|
Термодинамика |
34 |
|
|
Парциальные давления |
|
Парциальное давление – это давление, которое |
|
бы оказывал каждый газ в отдельности, находясь |
|
в том же объеме при той же температуре, если бы |
|
все остальные газы отсутствовали. |
|
pсм |
p1 |
p2 |
p3 |

|
Термодинамика |
|
35 |
|
|
|
|
|
Закон Дальтона |
|
|
Давление смеси равно сумме парциальных |
|
||
давлений ее компонент: |
|
|
|
|
pсм = ∑pi |
|
|
|
Термодинамика |
|
36 |
|
|
|
|
Парциальные объемы |
|
|
|
Парциальный объем – это объем, который |
|
||
занимал бы каждый газ в отдельности, находясь |
|||
при том же давлении и при той же температуре, |
|||
если бы все остальные газы отсутствовали. |
|
||
Vсм |
V1 |
V2 |
V3 |

Термодинамика 37
Связь общего и парциальных объемов
Общий объем смеси равен сумме парциальных объемов ее составляющих:
Vсм = ∑Vi
Термодинамика 38
Связь парциальных давлений и объемов
Для каждого газа в смеси из закона МенделееваКлайперона и определения парциальных давлений и объемов следует:
pсмVi = mi RiTсм piVсм = mi RiTсм
Т.к. масса и газовая постоянная неизменны, то:
pi Vсм = pсм Vi

Термодинамика 39
Массы и количества вещества
Масса каждого газа в смеси равна mi.
Количество вещества каждого газа равно νi. Из аддитивности массы и количества вещества:
mсм = ∑mi
νсм = ∑νi
Термодинамика 40
Состав смеси
Состав смеси (количество каждого из составляющих смесь компонент) можно определить разными способами.
Например, можно задать долю от общей массы или долю от общего количества вещества. Каждый из способов удобен для своей цели.
