
Лекции Термодинамика
.pdf
Термодинамика 61
Домашняя работа 2
Термодинамика 62
Задача 1
Посмотреть в Интернете состав воздуха (азот, кислород, углекислый газ). Уточнить, в каких долях указан этот состав. Определить парциальное давление каждого газа. До какой величины необходимо повысить температуру в изолированной комнате, чтобы обеспечить обычное давление, если из комнаты убрать весь углекислый газ? азот?

Термодинамика 63
Задача 2
Во сколько раз увеличится давление смеси газов в замкнутом металлическом сосуде, если его переложить из комнаты с температурой 17°С в горячую ванну с температурой 47°С?
Задача 3
Очень мягкий воздушный шарик, содержащий 3 г азота, 6 г кислорода и 4 г аргона вносят с улицы с температурой –23°С в комнату с температурой 27°С. Как изменится его объем?
Термодинамика 64
Лекция 3

Термодинамика 65
Первый закон термодинамики для ИГ
С учетом калорического уравнения и формулы для работы идеального газа:
δq = cv dT + p dv
Термодинамика 66
Энтальпия
В общем случае энтальпия – это сумма внутренней энергии тела и работы, которую надо затратить, чтобы тело объемом V ввести в
окружающую среду с давлением p, находящуюся с телом в равновесном состоянии.
I=U + pV
i= u + pv

Термодинамика 67
Энтальпия
Из первого закона ТД:
δq = di −vdp
Следствия:
u= cv (T2 −T1 ) i = cp (T2 −T1 )
Термодинамика 68
Термодинамический процесс
Термодинамический процесс – процесс перехода системы из одного состояния в другое. Термодинамический процесс определяется не только начальными и конечными параметрами, но и зависит от пути, по которому происходит изменение параметров при переходе системы.

Термодинамика 69
ТД процессы для идеального газа
Состояние ИГ характеризуется давлением, объе- |
|||||
мом и температурой. Но, согласно уравнению |
|||||
Менделеева-Клайперона |
pV = m |
μ |
R |
T |
, для |
|
0 |
|
|||
системы с постоянным составом один из параметров может быть выражен через два других. Таким образом, для идеального газа имеется лишь два независимых термодинамических параметра:
p и V, или p и T, или V и T, или v и T и т.п.
Термодинамика
ТД процессы для идеального газа
Процесс перехода из одного состояния в другое p тогда удобно изображать в виде линии (кривой) на диаграмме, где оси координат соответствуют независимым параметрам.
Чаще всего используют параметры p и v
(pv диаграммы).
70
v
Термодинамика 71
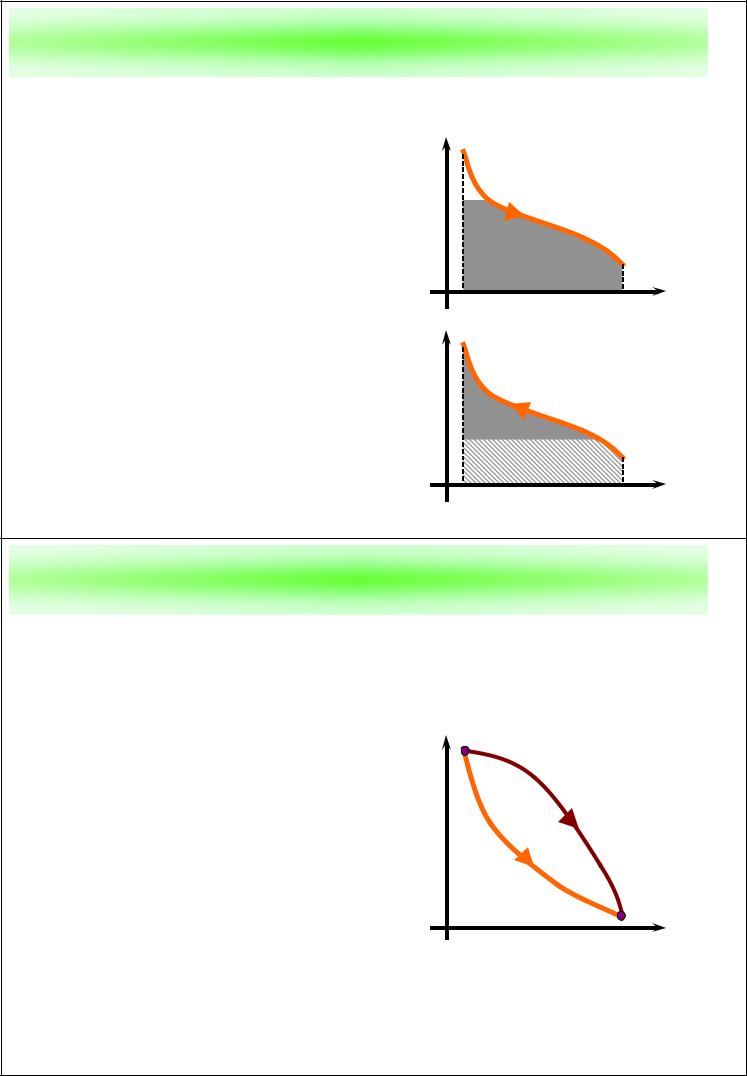
Определение работы ИГ по pv диаграмме
Удельная работа, совершаемая газом, равна площади под кривой процесса.
Работа положительна, если объем увеличивается (кривая идет слева направо), и отрицательна в противном случае.
p
l > 0
v
p
l < 0
v
Термодинамика
ТД процессы для идеального газа
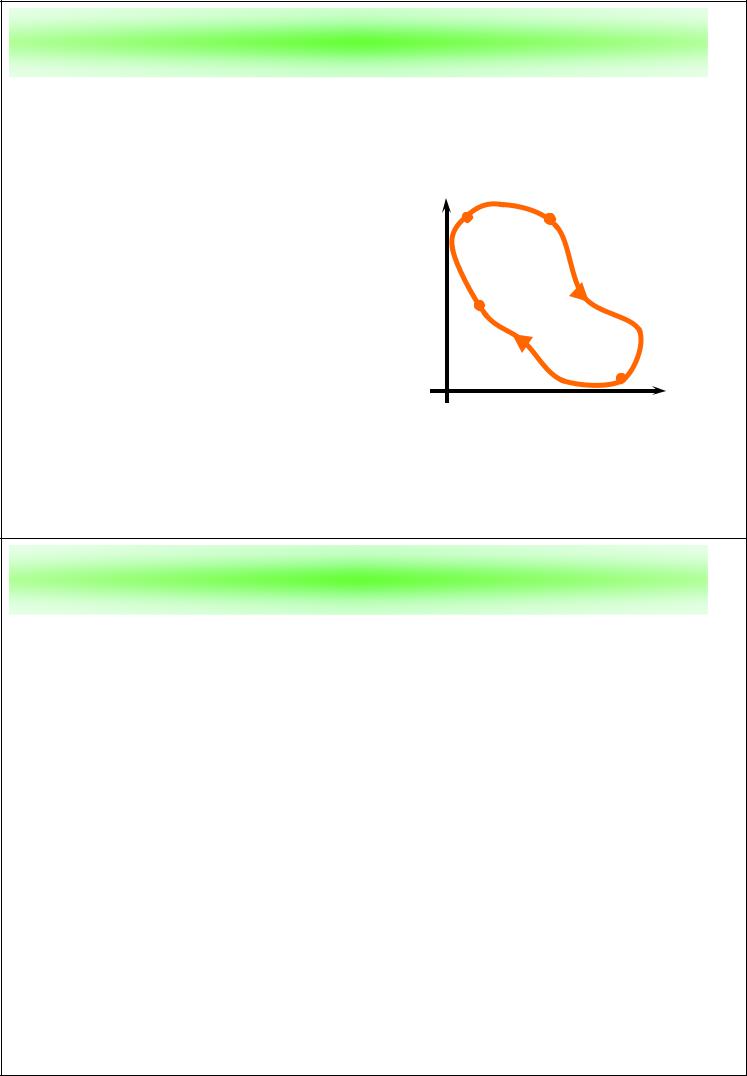
Так как процесс зависит |
|
|
не только от конечных |
p |
|
точек, но и от пути, то |
||
б |
||
процессы а и б – разные |
||
|
||
процессы. |
а |
|
В частности, работа, |
||
|
||
совершенная газом будет |
|
|
больше при процессе б. |
|
72
v
Термодинамика 73
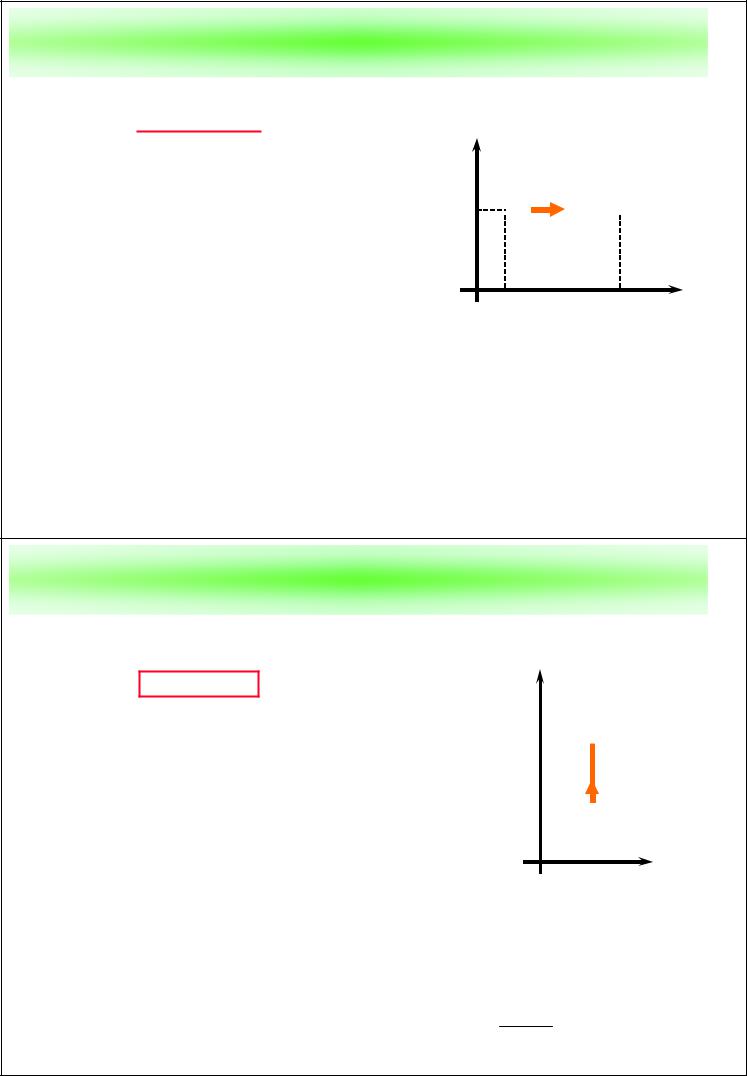
Циклы
Цикл (круговой процесс) – |
|
|
замкнутый термодинами- |
p |
|
ческий процесс, в ходе |
|
|
1 |
2 |
|
которого рабочее тело, |
|
5 |
пройдя ряд состояний, |
|
|
возвращается в |
|
|
первоначальное. |
|
|
3
4
v
Термодинамика 74
Классические процессы в ИГ
К классическим термодинамическим процессам в ИГ относят:
•изобарный (постоянное давление);
•изохорный (постоянный объем);
•изотермический (постоянная температура);
•адиабатический (нет обмена теплом со средой);
•политропный.
Все процессы задаются уравнением вида:
ϕ(T, p, v)= const
|
Термодинамика |
75 |
|||||||||||||
|
|
|
|||||||||||||
|
Изобарный процесс |
|
|
||||||||||||
|
p = const |
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Процесс, при котором давле- |
|
p |
|
|
|
|
|
||||||||
ние газа все время остается |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||||
постоянным, называется |
|
|
|
|
|
|
|
|
|
|
|||||
изобарным (изобарическим). |
|
|
|
vн |
vк v |
||||||||||
1 закон Гей-Люссака: |
Tн |
= |
Tк |
|
|
|
|
|
|
|
|
||||
|
vк |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
vн |
|
|
|
|
|
|
|
|
|||
Работа: l = p (vк −vн )= R (Tк −Tн ) |
|
|
|||||||||||||
Подвод тепла: q = cp (Tк −Tн )= |
|
|
k |
|
p(vк −vн )=iк −iн |
||||||||||
|
k −1 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Термодинамика
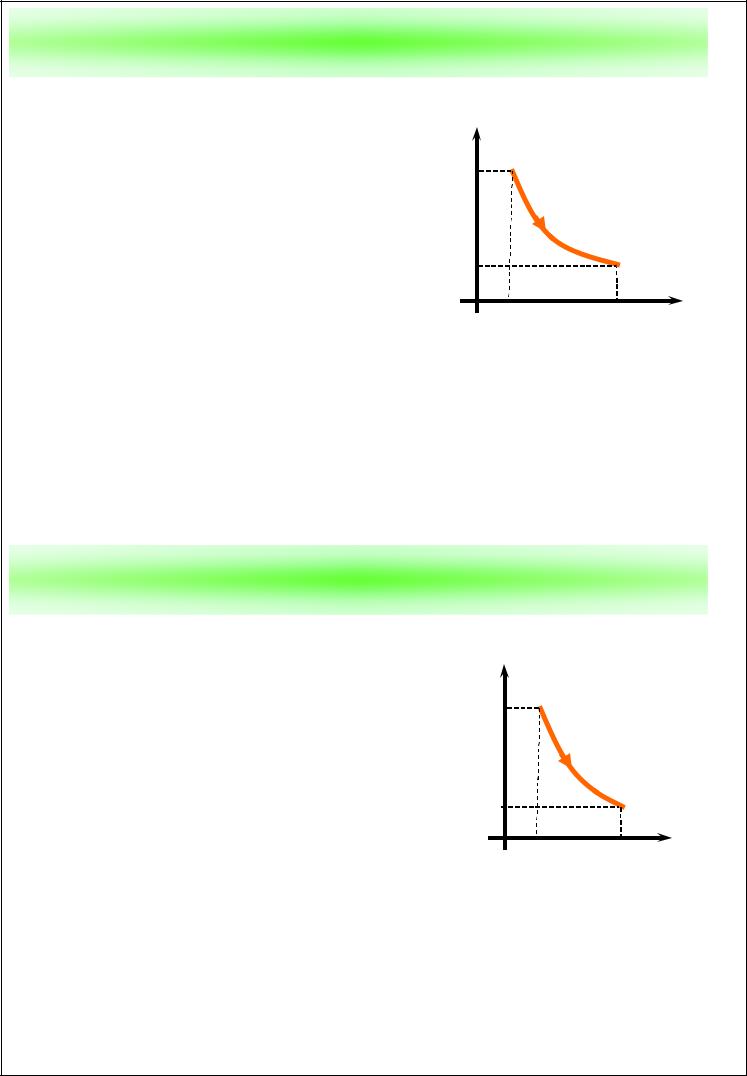
Изохорный процесс v = const
Процесс, при котором объем газа все время остается постоянным, называется
изохорным.
76
p
pк
pн
2 закон Гей-Люссака: |
Tк |
= |
Tн |
v v |
p |
p |
|
||
Работа: l = 0 |
к |
|
н |
|
|
|
|
|
Подвод тепла: q = u = cv (Tк −Tн )= k 1−1 v(pк − pн )
|
Термодинамика |
|||
|
Изотермический процесс |
|||
|
|
|
p |
|
|
T = const |
|
||
|
|
pн |
||
Процесс, при котором |
||||
|
||||
температура газа все время |
pк |
|||
остается постоянной, |
||||
называется изотермическим. |
vн |
|||
|
|
|
||
Закон Бойля-Мариотта: pнvн = pкvк
77
vк v
Работа: l = RT ln |
|
pн |
|
= RT ln |
|
vк |
|
|
= p |
v |
|
ln |
|
|
pн |
|
|||||||||||||
|
p |
|
|
|
|
|
p |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
v |
|
|
н |
|
н |
|
|||||||||||||
Подвод тепла: |
|
к |
|
|
|
|
н |
|
|
|
|
|
|
к |
|
||||||||||||||
q = l |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Термодинамика |
|
|
|
|
|
|
|
|
78 |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
Адиабатический процесс |
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
q = 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pн |
|
|
|
|
|
|
|
|
||
Процесс, при котором систе- |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
ма не обменивается теплом с |
|
|
|
|
pк |
|
|
|
|
|
|
|
|
|
|||||||||||||||
окружающей средой, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
называется адиабатическим. |
|
|
|
|
|
|
|
vн |
|
|
|
vк |
v |
||||||||||||||||
|
pk −1 |
pk −1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
k |
|
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
н |
= |
к |
|
p v |
н |
= p v |
к T v |
k −1 |
=T v |
k −1 |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
T k |
T k |
|
|
н |
|
|
|
к |
н |
|
|
к |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
н |
|
|
|
к |
|
|
|
|
|
|
|
|||||||
|
н |
к |
l = −cv (Tк −Tн ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
Работа: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
k = cp  cv – показатель адиабаты (свойство газа)
cv – показатель адиабаты (свойство газа)

Термодинамика 79
Политропный процесс
pvn = const n – показатель политропы
Этот процесс является более общим и объединяет все рассмотренные:
• для изобарического: |
n = 0 ; |
• для изохорного: |
n = ∞; |
•для изотермического: n = 1 ;
•для адиабатического: n = k .
Термодинамика 80
Политропный процесс
Соотношения между параметрами для двух состояний:
n |
n |
pn−1 |
|
pn−1 |
n−1 |
n−1 |
1 |
= |
2 |
||||
p1v1 |
= p2v2 |
|
|
T1v1 |
=T2v2 |
|
T n |
T n |
|||||
|
|
1 |
|
2 |
|
|
Подвод тепла:
q = cv k1−−nn (T2 −T1 )= cn (T2 −T1 )
cn = cv k1−−nn – теплоемкость политропного процесса
