
- •Процессы при кристаллизации из раствора металлов и сплавов
- •Несамопроизвольная кристаллизация
- •Аморфное состояние металлов
- •Форма кристаллов и строение слитков
- •1, 2 И 3 - оси соответственно первого, второго и
- •Методы построения диаграмм состояния
- •Основные равновесные диаграммы состояния двойных сплавов
Методы построения диаграмм состояния
Экспериментальное построение диаграмм состояния возможно благодаря тому, что любое фазовое превращение сплава отмечается изменением физико-механических свойств (электросопротивления, удельных объемов и др.) либо тепловым эффектом. Переход сплава из жидкого состояния в твердое сопровождается значительным выделением теплоты, поэтому, измеряя температуру при нагреве или охлаждении в функции времени, можно по перегибам или остановкам на кривых охлаждения, определить критические температуры, при которых происходят фазовые превращения.
Для того чтобы зафиксировать превращения в твердом состоянии, сопровождаемые малыми тепловыми эффектами, обычно наблюдают за какой-либо физической величиной, значительно изменяющейся при фазовых превращениях (электрические, магнитные и другие свойства).
На рис. 3.1 приведена зависимость длины железного образца от температуры. При температуре 911 °С наблюдается уменьщение длины образца, что указывает на переход железа из одного фазового состояния в другое, а при температуре 1392 °С отмечается новое превращение. Эти физические эффекты свидетельствуют о фазовых превращениях, не раскрывая атомного строения этих фаз.
Диаграммы состояния строят в координатах температура-химический состав сплава.
Для
экспериментального построения диаграммы
состояния сплавов, образованных
компонентами А и В, необходимо изготовить
серию сплавов с различным содержанием
компонентов А и В. Для каждого сплава
экспериментально определяют критические
точки, т. е. температуры фазовых
превращений.

Рис. 3.1. Схема изменения длины железного образца в зависимости от температуры нагрева
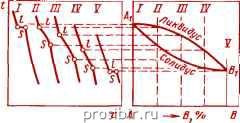
Рис. 3.2. Схема построения диаграммы состояния
Полученные значения температуры откладывают на вертикальных линиях в соответствии с химическим составом сплавов. Соединяя критические точки, получают линии диаграммы состояния.
Одна из простейших диаграмм состояния приведена на рис. 3.2, где линия ликвидус-геометрическое место всех точек, которые определяют температуру начала кристаллизации сплавов («ликва» по латыни означает жидкий). Линия солидус соответствует точкам, определяющим температуру конца кристаллизации сплавов («солид»-твердый). Эти линии разделяют диаграммы состояния на области с различным фазовым составом.
Положение линий на диаграмме зависит от скорости охлаждения сплавов, поэтому температуры критических точек при построении диаграмм состояния определяют при медленных охлаждениях или нагревах. Такие диаграммы называют равновесными.
Таким образом, диаграмма состояния представляет собой графическое изображение фазового состава сплавов данной системы в функции температуры и химического состава сплавов. Левая крайняя точка на горизонтальной оси соответствует 100%-ному содержанию одного компонента. Процентное содержание второго компонента откладывается по этой оси слева направо. Правая крайняя точка соответствует 100% второго компонента. Экспериментально построенные диаграммы состояния проверяют по правилу фаз, дающему возможность теоретически обосновать направление протекания процессов превращения для установления равновесного состояния системы.
Общие закономерности существования устойчивых фаз, отвечающих условиям равновесия, могут быть выражены в математической форме, называемой правилом фаз (Гиббса). Правило фаз дает возможность предсказать и проверить процессы, происходящие в сплавах при нагреве и охлаждении; оно показывает, происходит ли процесс кристаллизации при постоянной температуре или в интервале температур, и указывает, какое число фаз может одновременно существовать в системе.
Так как диаграммы состояния обычно строят при постоянном (атмосферном) давлении, то правило фаз выражается следующим уравнением:
С = К + 1-Ф,
где fC-число компонентов в системе; Ф-число фаз; С-число степеней свободы (или вариантность системы). Число степеней свободы - это число независимых переменных внутренних (состав фаз) и внешних (температура, давление) факторов, которые можно изменять без изменения числа фаз, находящихся в равновесии.
Из правила фаз следует, что в двойной системе при постоянном давлении не может одновременно существовать более трех фаз. Это возможно при С = = О (Ф = 2 4- 1). Три фазы могут существовать только при определенных составе фаз и температуре. Если в двойной системе насчитываем число фаз больше трех, это значит, что сплав не находится в равновесном состоянии или неправильно определено число фаз или компонентов. Для однофазного состояния правило фаз не применяют.
