
- •2. Эквивалент. Закон эквивалентов уровень в
- •1. Трехвалентный элемент образует оксид, содержащий 68,90 % мас. Кислорода. Вычислить молярную массу эквивалента элемента и назвать элемент.
- •2. На восстановление 7,2 г оксида потребовалось 2,24 л водорода, измеренного при н.У. Рассчитать молярные массы эквивалентов оксида и металла.
- •1Моль а – 2 моль в
- •0,1 Моль а – х моль в
- •7. Растворы сильных и слабых электролитов. Произведение растворимости.
- •Уровень в
- •1. Вычислить рН следующих водных растворов:
- •2. Вычислить рН 0,05 м водного раствора хлорноватистой кислоты (hoCl).
- •9. Окислительно-восстановительные реакции уровень в
- •Решение
- •Решение
- •Решение
- •11. Электролиз растворов уровень в
- •1. Составить схемы электролиза и написать уравнения электродных процессов водных растворов солей (анод инертный): а) хлорида меди (II); б) гидроксида натрия.
- •3. Способы выражения состава растворов уровень а
- •4. Энергетика химических реакций уровень а
- •1. Указать, какие из приведенных реакций являются эндотермическими:
- •Решение
- •2. Без использования табличных данных определить, для каких из перечисленных реакций изменение энтропии имеет положительное значение:
- •3. Написать полное молекулярное уравнение по данному сокращенному ионно-молекулярному уравнению:
Решение
So + HN+5O3(конц) = Н2S+6O4 + N+4O2 + H2O
восст. окисл.
НОК ДМ
восст-ль Sº – 6ē = S+6 1
6
окисл-ль N+5 + ē = N+4 6
Sº + 6N+5 = S+6 + 6N+4
S + 6HNO3(конц) = Н2SO4 + 6NO2 + 2H2O.
в) Неметалл + H2SO4(конц) → кислота, в которой неметалл проявляет высшую степень окисления + SO2 +(Н2O); см. пример б).
Решение
P0 + H2S+6O4(конц) = Н3Р+5О4 + S+4O2 + H2O
восст. окисл.
НОК ДМ
восст-ль P0 – 5ē = P+5 2
10
окисл-ль S+6 + 2ē = S+4 5
2Р0 + 5S+6 = 2P+5 + 5S+4
2P + 5H2SO4(конц) = 2Н3РО4 + 5SO2 + 2H2O.
г) Металл + H2SO4(конц) → соль + (H2S, S, SO2) (в зависимости от активности металла) + Н2О.
H2S выделится, если в реакцию вступает активный металл (Li–Al),
S выделится, если в реакцию вступает металл средней активности (Mn–Рb),
SO2 выделится, если в реакцию вступает малоактивный металл (стоящий в ряду стандартных электродных потенциалов после водорода).
Решение
Mg0 + H2S+6O4(конц) = Mg+2SO4 + H2S-2 + H2O.
восст. oкисл.
НОК ДМ
осст-ль Mg0 – 2ē = Mg+2 4
8
окисл-ль S+6 + 8ē = S-2 1
4Mg0 + S+6 = 4Mg+2 + S-2
Аналогично примеру (а) уравниваем реакцию:
4H2SO4(конц) + 4Mg + H2SO4(конц) = 4MgSО4 + H2S + 4H2O
4Mg + 5H2SO4(конц) = 4MgSО4 + H2S + 4H2O.
11. Электролиз растворов уровень в
1. Составить схемы электролиза и написать уравнения электродных процессов водных растворов солей (анод инертный): а) хлорида меди (II); б) гидроксида натрия.
Какие продукты выделяются на катоде и аноде?
|
Дано: а) CuCl2, б) NaОН. Анод инертный |
Решение
а) CuCl2 = Cu2+ + 2Cl-. Схему электролиза составляем в соответствии с табл. 11.1 и 11.2:
K(-) A(+) инертный Cu2+ + 2ē = Cu 2Cl- – 2ē = Cl2 H2O H2O |
|
1. Схема электролиза – ? 2. Продукты электролиза – ? |
На катоде выделяется Cu, на аноде – Cl2.
б) NaОН = Na+ + ОН-.
K(-) A(+) инертный
Na+
4ОН![]() –
4ē = О2
+ 2H2О
–
4ē = О2
+ 2H2О
2H2O + 2ē = H2 + 2OH-
На катоде выделяется Н2, на аноде – О2.
2. Составить схемы электролиза и написать уравнения электродных процессов водного раствора сульфата никеля (II) , если: а) анод инертный; б) анод никелевый. Какие продукты выделяются на катоде и аноде?
|
Дано: NiSO4 а) анод инертный б) анод никелевый |
Решение а) анод – инертный NiSO4
= Ni2+
+
Схему электролиза составляем в соответствии с табл. 11.1. и 11.2: |
|
1. Схема электролиза – ? 2. Продукты электролиза – ? |
K(-) A(+) инертный
Ni2+
+ 2ē = Ni
![]()
2H2O + 2ē = H2 + 2OH- 2H2O – 4ē = О2 + 4H+.
На катоде выделяется Ni и H2 , на аноде выделяется О2.
б) анод – никелевый:
NiSO4
= Ni2+
+
![]()
K(-) A(+) (Ni)
Ni2+
+ 2ē = Ni
![]() ,Н2О
,Н2О
2H2O + 2ē = H2 + 2OH- Ni – 2ē = Ni2+.
На катоде выделяется Ni и H2, на аноде растворяется Ni.
3. При электролизе растворов а) нитрата кальция, б) нитрата серебра на аноде выделяется 560 мл газа (н.у.). Составить схему электролиза и написать уравнения электродных процессов. Определить, какое вещество и в каком количестве выделилось на катоде. Анод инертный.
|
Дано: Электролиты: а) Ca(NO3)2 б) AgNO3
Анод инертный |
Решение а)
Ca(NO3)2
= Ca2+
+ 2 Схема электролиза: K(-) A(+) инертный Ca2+
2H2O + 2ē = H2O – 4ē = = H2 + 2OH- =О2 + 4H+ На катоде выделяется Н2, на аноде выделяется О2. По закону эквивалентов: nэк (В1)(анод) = nэк (В2)(катод) |
|
1. Схема электролиза 2. 3. 4. |
В соответствии со схемой электролиза
nэк
(О2)(анод)
= nэк
(Н2)(катод)
или
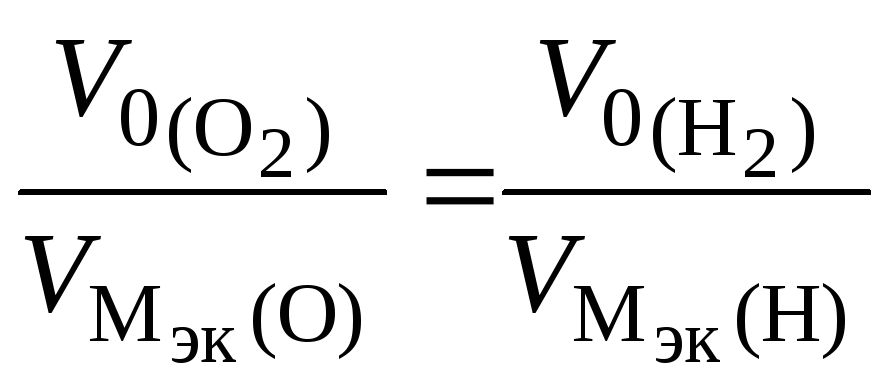 ,
,
откуда
![]() =
=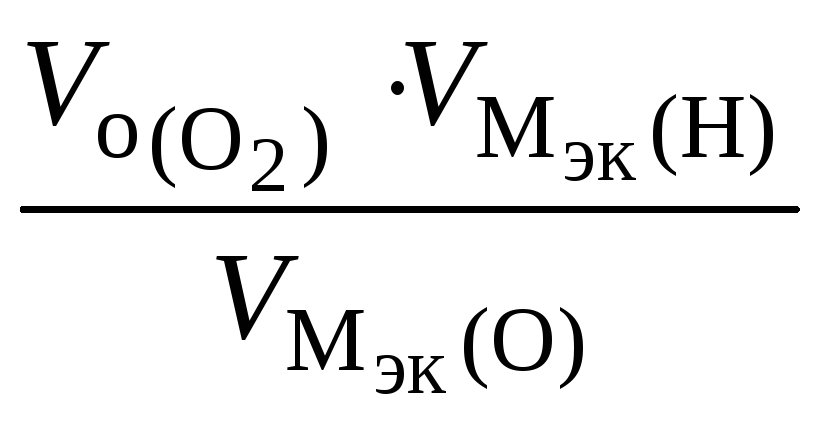 =
=![]() =
1120 см3,
=
1120 см3,
![]() = 11200 см3/моль.
= 11200 см3/моль.
![]() = 5600 см3/моль.
= 5600 см3/моль.
На катоде выделилось 1120 см3 водорода.
Ответ: 1120 см3 водорода.
б) AgNO3
= Ag+
+
![]() .
.
Схема электролиза:
K(-) A(+) инертный
Ag+
+ ē = Ag
![]()
H2O 2H2O – 4ē = О2 + 4H+
На катоде выделяется Ag, на аноде выделяется О2.
По закону эквивалентов: nэк(О2)(анод) = nэк(Ag)(катод) или
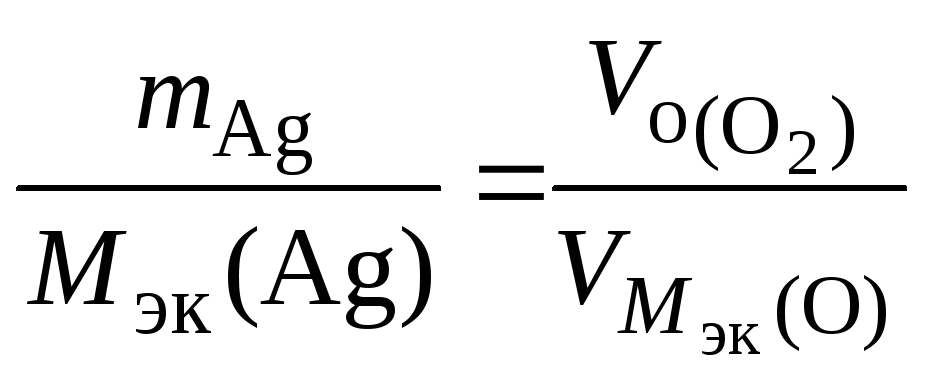 ,
,
Откуда
![]()
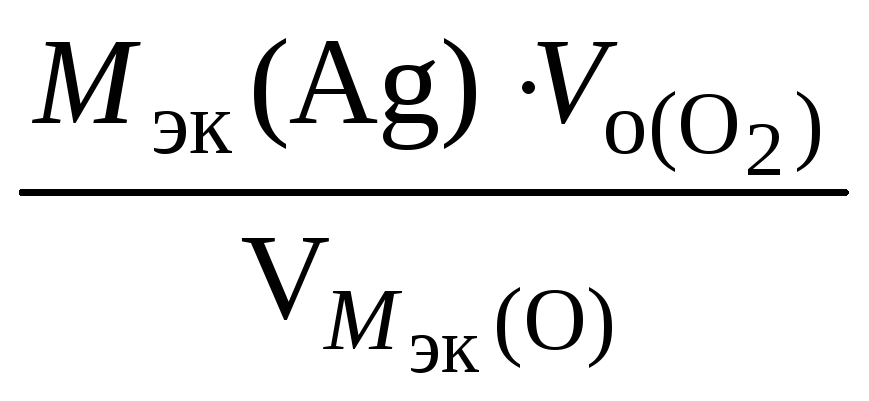 =
=![]() = 10,8 г.
= 10,8 г.
где
![]() .
.
На катоде выделилось 10,8 г серебра.
Ответ: 10,8 г серебра.
