
- •Введение
- •Раздел первый
- •1.2. Определение химии
- •1.3. Атомно-молекулярное учение
- •1.4. Основные стехиометрические законы химии
- •1.5. Значение химии в развитии техники
- •Глава 2. Строение атомов. Периодический закон и периодическая система химических элементов д.И. Менделеева
- •2.1. Первые модели строения атома
- •2.2. Квантово-механическая модель атома водорода
- •2.3. Квантовые числа
- •2.4. Атомные орбитали
- •2.5. Многоэлектронные атомы
- •2.6. Распределение электронов по энергетическим уровням и подуровням у элементов малых периодов
- •2.7. Распределение электронов по энергетическим уровням и подуровням у элементов больших периодов
- •2.8. Периодический закон д. И. Менделеева
- •2.9. Структура периодической системы химических элементов д. И. Менделеева
- •2.10. Свойства атомов элементов в периодической системе
- •2.11. Закономерности изменения свойств элементов и их соединений в периодической системе
- •Глава 3. Химическая связь и строение молекул
- •3.1. Развитие теории химической связи
- •3.2. Ковалентная связь. Кривая потенциальной энергии
- •3.3. Основные количественные характеристики ковалентной связи
- •3.4. Квантово – механическая теория валентности
- •3.5. Донорно – акцепторный механизм образования ковалентной связи
- •3.6. Свойства ковалентной связи
- •3.7. Метод молекулярных орбиталей
- •3.8. Ионная связь
- •3.9. Водородная связь
- •3.10. Межмолекулярное взаимодействие
- •Глава 4. Кристаллическое состояние вещества
- •4.1. Макроскопические свойства кристаллов
- •4.2. Внутреннее строение кристаллов
- •4.3. Виды элементарных ячеек
- •4.4. Металлическая связь
- •4.5. Реальные кристаллы и нарушения кристаллической структуры
- •Раздел второй
- •5.2. Первый закон термодинамики
- •5.3. Энтальпия образования химических соединений
- •5.4. Энтропия. Второй закон термодинамики
- •5.5. Третий закон термодинамики
- •5.6. Энергия Гиббса. Направленность химических реакций
- •164,9 КДж; 172,41 Дж/моль∙к;
- •Глава 6. Скорость химических реакций. Химическое равновесие
- •6.1. Влияние внешних факторов на скорость химических реакций
- •6.2. Химическое равновесие
- •6.3. Цепные реакции
- •6.4. Фазовые равновесия
- •6.5. Катализаторы и каталитические системы
- •Раздел третий растворы
- •Глава 7. Общие свойства растворов
- •7.1. Механизм процессов растворения
- •7.2. Способы выражения количественного состава растворов
- •100 ∙ 10,91 Моль % h2so4
- •7.3. Энергетика растворения
- •7.4. Свойства растворов неэлектролитов
- •7.5. Свойства растворов электролитов
- •7.6. Электролитическая диссоциация воды. Водородный показатель
- •7.7. Произведение растворимости. Гидролиз солей
- •Глава 8. Окислительно-восстановительные реакции
- •8.1.Общие понятия об окислительно- восстановительных реакциях
- •8.2. Классификация окислителей и восстановителей
- •8.3. Количественная характеристика окислительно-восстановительных реакций
- •8.4. Методы составления уравнения окислительно-восстановительных реакций
- •8.5. Влияние факторов на характер и направление реакций
- •8.6. Типы окислительно-восстановительных реакций
- •Глава 9. Электрохимические процессы
- •9.1. Строение двойного электрического слоя
- •9.2. Гальванические элементы
- •9.3. Стандартный водородный электрод
- •9.4. Поляризационные явления в гальванических элементах
- •9.5. Химические источники тока
- •9.6. Аккумуляторы
- •9.7. Топливные элементы
- •9.8. Теоретические основы электролиза
- •9.9. Последовательность электродных процессов
- •9.10. Техническое применение электролиза
- •Глава 10. Коррозия и защита металлов
- •10.1. Общие сведения о коррозии
- •10.2. Классификация коррозионных процессов
- •10.3. Количественная и качественная оценка коррозии и коррозионной стойкости
- •10.4. Химическая коррозия
- •10.5. Электрохимическая коррозия
- •10.6. Методы защиты от электрохимической коррозии
- •Раздел четвертый
- •11.2. Электропроводность металлов, полупроводников и диэлектриков
- •11.3. Химические свойства металлов высокой проводимости
- •11.4. Электропроводимость металлов подгруппы меди
- •11.5. Химические свойства магнитных материалов
- •11.6. Магнитные свойства металлов семейства железа
- •Глава 12. Химическая идентификация и анализ вещества
- •12.1. Химическая идентификация вещества
- •12.2. Количественный анализ
- •12.3. Инструментальные методы анализа
- •Заключение
- •Библиографический список
- •Глава 1. Основные понятия химии. Предмет и задачи
- •Глава 2. Строение атомов. Периодический закон и
- •Глава 3. Химическая связь и строение молекул………..54
- •Глава 4. Кристаллическое состояние вещества………..103
- •Глава 12. Химическая идентификация и анализ
7.6. Электролитическая диссоциация воды. Водородный показатель
Тщательно очищенная химически чистая вода имеет весьма незначительную электропроводность, которая объясняется наличием ионов, способных переносить электричество. Вода характеризуется ионной проводимостью. Процесс диссоциации воды протекает в две стадии:
1) Образование водородных и гидроксид - ионов:
H2O
![]() H+ + OH-
H+ + OH-
2) Гидратация водородного иона с образованием гидроксоний - иона:
H+
+ H2O![]() OH3+
OH3+
Первая стадия этого процесса эндотермична, а вторая сильно экзотермична, поэтому практически все ионы водорода гидратированы и электролитическую диссоциацию воды сле-
дует изображать следующим уравнением:
2
H2O![]() OH3++
OH-
OH3++
OH-
Возможно присоединение и большего числа молекул воды к H+, поэтому пользуются упрощенной формулой.
При 220 Сстепень электролитической диссоциации воды равна1,8 ∙ 10-9, т.е. из555 000 000молекул воды диссоциирует только одна. Следовательно, вода является очень слабым электролитом и для описания процесса её электролитической диссоциации применим закон действия масс.
 или
или
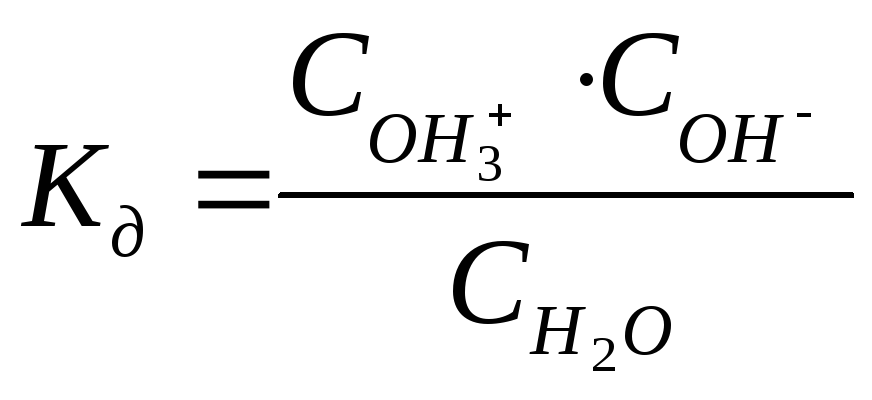 или
или ,
,
где
![]() - константа диссоциации воды. Активности
могут быть заменены их концентрациями
- константа диссоциации воды. Активности
могут быть заменены их концентрациями
[OH3+]
[OH-] =
![]() [H2O]2
[H2O]2
Т.к. практически
[H2O]
= const, то окончательно
имеем[OH3+]
[OH-] = K![]()
Постоянная K![]() называетсяионным произведением воды.Можно рассчитать эту величину для22
0С. В1 лводы, массой
которого можно принять равной1000 г,
находится
называетсяионным произведением воды.Можно рассчитать эту величину для22
0С. В1 лводы, массой
которого можно принять равной1000 г,
находится![]() молей воды.
молей воды.
Следовательно, концентрация гидроксоний - ионов и гидроксид - ионов в воде равна
[OH3+] = [OH-] = 55,5∙ 1,8∙ 10-9 = 1∙ 10-7 г-ион/л
Отсюда значение ионного произведения воды будет
[OH3+] [OH-]=10-7∙10-7=10-14 при 22 0С.
Эта величина возрастает с повышением температуры.
Водородный показатель. В зависимости от содержания в водных растворах электролитов ионовOH3+иOH-различают кислую, нейтральную и щелочную среды.
В соответствии с
теорией электролитической диссоциации
ионы OH3+или упрощенноH+являются носителями кислотных свойств,
а ионыOH--
носителями основных свойств. Поэтому
раствор будет нейтральным, когда[H+]=[OH-]=![]() ;
кислым, когда[OH-]
< [H+];и щелочным, когда[OH-]
> [H+].
;
кислым, когда[OH-]
< [H+];и щелочным, когда[OH-]
> [H+].
Для характеристики
кислотности (щелочности) среды введен
специальный параметр - водородный
показатель или рН. Водородным
показателем, илирН, называется
взятый с обратным знаком десятичный
логарифм активности (концентрации)
водородных ионов в растворе:рН = -lg
aн![]() илирН = - lg
[H+]
илирН = - lg
[H+]
Водородный показатель определяет характер реакции раствора:
Нейтральная среда [H+] = [OH-] = 10-7 г-ион/л рН = 7
Кислая среда [H+] > [OH-] > 10-7 г-ион/л рН < 7
Щелочная среда [H+] < [OH-] < 10-7 г-ион/л рН > 7
Величина рНимеет важное значение для понимания большинства процессов, протекающих в жидкой фазе, так как ионыH+иOH-непосредственно участвуют во многих из этих процессов. Кроме того, эти ионы являются гомогенными катализаторами многих реакций. ВеличинарНможет служить критерием силы кислоты или основания. В ряду кислот более сильной будет та, у которой при одинаковой молярной концентрации активность ионовH+будет выше (величинарНниже). Так,рН0,1 мрастворов уксусной и соляной кислот будут2,87и1,088соответственно. Для оснований подобная зависимость носит обратный характер.
В виду большого практического применения рНрастворов в настоящее время разработаны различные способы опре-
деления водородного показателя. С помощью растворов индикаторов, индикаторной бумаги и более точные - инструментальные с помощью рН- литров.
Индикатораминазываются вещества, изменяющие свою окраску в зависимости от концентрации водородных ионов или гидроксид - ионов.
По химической природе индикаторы являются или слабыми кислотами или слабыми основаниями. В качестве индикаторов применяют такие соединении, у которых молекулы или ионы имеют различную окраску.
Например, кислотный индикатор. Диссоциация кислотного индикатора HIndможет быть представлена следующей схемой:
HInd![]() H++Ind-
H++Ind-
окраска 1 окраска 2
КHInd=![]()
С увеличением кислотности раствора (повышением [H+]) равновесие смещается влево, т.е. наблюдается переход окраски2в сторону образования окраски1. Очевидно, чем резче отличаются эти окраски между собой и чем чувствительнее отзывается равновесие на изменение концентрации[H+], тем выше и чувствительность индикатора. Для каждого индикатора существует определенная область (интервалрН) перехода окраски (табл.1), которой может быть замечен визуально или с помощью приборов (колориметрический анализ).
Таблица 8
Индикаторы и интервалы рНперехода окраски.
|
Индикатор |
Характер индикатора |
Значение рНобласти перехода окраски |
Окраска | |
|
Метиловый оранжевый (метилоранж) Лакмус фенолфталеин |
при малых рН |
при больших рН | ||
|
основной кислотный щелочной |
3,1 - 4,4 6 - 8 8,3 - 9,8 |
красная красная бесцветная |
желтая синяя малиновая | |
