
- •Введение
- •Раздел первый
- •1.2. Определение химии
- •1.3. Атомно-молекулярное учение
- •1.4. Основные стехиометрические законы химии
- •1.5. Значение химии в развитии техники
- •Глава 2. Строение атомов. Периодический закон и периодическая система химических элементов д.И. Менделеева
- •2.1. Первые модели строения атома
- •2.2. Квантово-механическая модель атома водорода
- •2.3. Квантовые числа
- •2.4. Атомные орбитали
- •2.5. Многоэлектронные атомы
- •2.6. Распределение электронов по энергетическим уровням и подуровням у элементов малых периодов
- •2.7. Распределение электронов по энергетическим уровням и подуровням у элементов больших периодов
- •2.8. Периодический закон д. И. Менделеева
- •2.9. Структура периодической системы химических элементов д. И. Менделеева
- •2.10. Свойства атомов элементов в периодической системе
- •2.11. Закономерности изменения свойств элементов и их соединений в периодической системе
- •Глава 3. Химическая связь и строение молекул
- •3.1. Развитие теории химической связи
- •3.2. Ковалентная связь. Кривая потенциальной энергии
- •3.3. Основные количественные характеристики ковалентной связи
- •3.4. Квантово – механическая теория валентности
- •3.5. Донорно – акцепторный механизм образования ковалентной связи
- •3.6. Свойства ковалентной связи
- •3.7. Метод молекулярных орбиталей
- •3.8. Ионная связь
- •3.9. Водородная связь
- •3.10. Межмолекулярное взаимодействие
- •Глава 4. Кристаллическое состояние вещества
- •4.1. Макроскопические свойства кристаллов
- •4.2. Внутреннее строение кристаллов
- •4.3. Виды элементарных ячеек
- •4.4. Металлическая связь
- •4.5. Реальные кристаллы и нарушения кристаллической структуры
- •Раздел второй
- •5.2. Первый закон термодинамики
- •5.3. Энтальпия образования химических соединений
- •5.4. Энтропия. Второй закон термодинамики
- •5.5. Третий закон термодинамики
- •5.6. Энергия Гиббса. Направленность химических реакций
- •164,9 КДж; 172,41 Дж/моль∙к;
- •Глава 6. Скорость химических реакций. Химическое равновесие
- •6.1. Влияние внешних факторов на скорость химических реакций
- •6.2. Химическое равновесие
- •6.3. Цепные реакции
- •6.4. Фазовые равновесия
- •6.5. Катализаторы и каталитические системы
- •Раздел третий растворы
- •Глава 7. Общие свойства растворов
- •7.1. Механизм процессов растворения
- •7.2. Способы выражения количественного состава растворов
- •100 ∙ 10,91 Моль % h2so4
- •7.3. Энергетика растворения
- •7.4. Свойства растворов неэлектролитов
- •7.5. Свойства растворов электролитов
- •7.6. Электролитическая диссоциация воды. Водородный показатель
- •7.7. Произведение растворимости. Гидролиз солей
- •Глава 8. Окислительно-восстановительные реакции
- •8.1.Общие понятия об окислительно- восстановительных реакциях
- •8.2. Классификация окислителей и восстановителей
- •8.3. Количественная характеристика окислительно-восстановительных реакций
- •8.4. Методы составления уравнения окислительно-восстановительных реакций
- •8.5. Влияние факторов на характер и направление реакций
- •8.6. Типы окислительно-восстановительных реакций
- •Глава 9. Электрохимические процессы
- •9.1. Строение двойного электрического слоя
- •9.2. Гальванические элементы
- •9.3. Стандартный водородный электрод
- •9.4. Поляризационные явления в гальванических элементах
- •9.5. Химические источники тока
- •9.6. Аккумуляторы
- •9.7. Топливные элементы
- •9.8. Теоретические основы электролиза
- •9.9. Последовательность электродных процессов
- •9.10. Техническое применение электролиза
- •Глава 10. Коррозия и защита металлов
- •10.1. Общие сведения о коррозии
- •10.2. Классификация коррозионных процессов
- •10.3. Количественная и качественная оценка коррозии и коррозионной стойкости
- •10.4. Химическая коррозия
- •10.5. Электрохимическая коррозия
- •10.6. Методы защиты от электрохимической коррозии
- •Раздел четвертый
- •11.2. Электропроводность металлов, полупроводников и диэлектриков
- •11.3. Химические свойства металлов высокой проводимости
- •11.4. Электропроводимость металлов подгруппы меди
- •11.5. Химические свойства магнитных материалов
- •11.6. Магнитные свойства металлов семейства железа
- •Глава 12. Химическая идентификация и анализ вещества
- •12.1. Химическая идентификация вещества
- •12.2. Количественный анализ
- •12.3. Инструментальные методы анализа
- •Заключение
- •Библиографический список
- •Глава 1. Основные понятия химии. Предмет и задачи
- •Глава 2. Строение атомов. Периодический закон и
- •Глава 3. Химическая связь и строение молекул………..54
- •Глава 4. Кристаллическое состояние вещества………..103
- •Глава 12. Химическая идентификация и анализ
3.7. Метод молекулярных орбиталей
Метод валентных
связей дает теоретическое обоснование
широко применяемым химиками структурным
формулам и позволяет правильно определить
структуру практически всех соединений
s –иp
–элементов. Большое достоинство
метода в его наглядности. Однако
представление о локализованных
(двухцентровых, двухэлектронных)
химических связях оказывается слишком
узким для объяснения многих экспериментальных
фактов. В частности, метод валентных
связей несостоятелен для описания
молекул с нечетным числом электронов,
например,H![]() ,H
,H![]() ,
бораны, некоторые соединения с сопряженными
связями, ряд ароматических соединений,
карбонилы металлов, т.е. молекулы с
дефицитом электронов или их избытком
(H
,
бораны, некоторые соединения с сопряженными
связями, ряд ароматических соединений,
карбонилы металлов, т.е. молекулы с
дефицитом электронов или их избытком
(H![]() ).
Обнаружились непреодолимые трудности
использования метода валентных связей
для объяснения валентности элементов
восьмой группы с фтором и кислородом
(XeF6, XeOF4,
XeO3и др.),
металлов в ”сэндвичевых” металлоорганических
соединениях, например, железа в ферроцене
).
Обнаружились непреодолимые трудности
использования метода валентных связей
для объяснения валентности элементов
восьмой группы с фтором и кислородом
(XeF6, XeOF4,
XeO3и др.),
металлов в ”сэндвичевых” металлоорганических
соединениях, например, железа в ферроцене
Fe(C5H5)2, где он должен был бы образовать связи с десятью атомами углерода, не имея такого количества электронов на внешней оболочке.
На основе метода
ВСтрудно объяснить и то, что отрыв
электронов от некоторых молекул приводит
к упрочнению химической связи. Так,
энергия разрыва связи в молекулеF2составляет 38 ккал/моль, а в молекулярном
ионеF![]() - 76 ккал/моль. Этот метод не
объясняет и парамагнетизм молекулярного
кислородаO2иB2.
- 76 ккал/моль. Этот метод не
объясняет и парамагнетизм молекулярного
кислородаO2иB2.
Более общим и универсальным оказался метод молекулярных орбиталей (МО), при помощи которого удается объяснить факты, непонятные с позиции методаВС. Значительный вклад в разработку методаМОвнес американский ученый Р. Малликен (1927 – 1929 гг).
Основные понятия.В своей основе методМОраспространяет квантово - механические закономерности, установленные для атома, на более сложную систему - молекулу. В основе метода молекулярных орбиталей лежит представление об ''орбитальном'' строении молекулы, т.е. предположение о том, что все электроны данной молекулы (как и в атоме) распределяются по соответствующим орбиталям. Каждая орбиталь характеризуется набором квантовых чисел, отражающих свойства электрона в данном энергетическом состоянии. Особенность методаМОзаключается в том, что в молекуле имеется нескольких атомных ядер, т.е. в отличие от одноцентровых атомных орбиталей молекулярные орбитали несколькоцентровые (общие для двух и большего числа атомных ядер). По аналогии с атомнымиs -, p -, d -, f -орбиталями молекулярные орбитали обозначаются греческими буквамиσ -, π, δ -, φ.
Основная проблема метода МО- нахождение волновых функций, описывающих состояние электронов на молекулярных орбиталях. Согласно одному из вариантов метода молекулярных орбиталей, названным линейной комбинацией атомных орбиталей(МОЛКАО), молекулярные орбитали образуются из атомных путем их линейной комбинации. Пусть электронные орбитали взаимодействующих атомов характеризуются волновыми функциямиΨ1, Ψ2, Ψ3и т.д. Тогда предполагается, что волновая функцияΨмол, отвечающая молекулярной орбитали, может быть представлена в виде суммы:
Ψмол.= С1Ψ1 + С2Ψ2 + С3Ψ3 + …. .,
где С1, С2, С3 ...некоторые численные коэффициенты. Это уравнение равносильно предположению, что амплитуда молекулярной электронной волны (т.е. молекулярная волновая функция) образуется сложением амплитуд взаимодействующих атомных электронных волн (т. е. сложением атомных волновых функций). При этом, однако, под влиянием силовых полей ядер и электронов соседних атомов волновая функция каждого электрона изменяется по сравнению с исходной волновой функцией этого электрона в изолированном атоме. В методеМОЛКАОэти изменения учитываются введением коэффициентовС1, С2, С3 и т.д.
При построении молекулярных орбиталей по методу МОЛКАОдолжны соблюдаться определенные условия:
1. Комбинируемые атомные орбитали должны быть близкими по энергии, иначе электрону будет энергетически невыгодно находиться на подуровне с более высокой энергией. (1 sи5 pне взаимодействуют).
2. Необходимо максимальное перекрывание атомных орбиталей, образующих молекулярную орбиталь.
3. Атомные орбитали, образующие молекулярные орбитали, должны обладать одинаковыми свойствами симметрии относительно межъядерной оси молекулы. (px- электронное облако может комбинироваться только сpxоблаком, но неpyиpz).
Следует также учитывать, что совокупность молекулярных орбиталей молекулы, занятых электронами, представляет ее электронную конфигурацию. Она строится так же как и для атома, на основе принципа наименьшей энергии и принципа Паули.
Для описания электронной конфигурации основного состояния молекулы с 2nили(2n - 1)электронами требуетсяn молекулярных орбиталей.
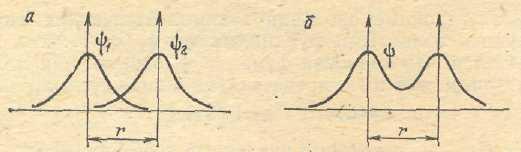
Связывающие и разрыхляющие орбитали. Рассмотрим, какой вид будет иметь молекулярная волновая функцияΨм, образованная в результате взаимодействия волновых функций (Ψ1иΨ2)1 sорбиталей двух одинаковых атомов. Для этого найдем суммуС1Ψ1 + С2Ψ2. Поскольку в данном случае атомы одинаковыеС1 = С2; они не будут влиять и на характер волновых функций, поэтому ограничимся нахождением суммыΨ1 + Ψ2.
Для этого расположим ядра взаимодействующих атомов на том расстоянии друг от друга (r), на котором они находятся в молекуле. ВидΨ функций1 sорбиталей будет следующим:
![]() Ψмол
Ψмол
Рис. 22. Схема образования связывающей МО
из атомных 1 s -орбиталей
Чтобы найти молекулярную волновую функцию Ψ, сложим величиныΨ1иΨ2. В результате получим следующий вид кривой (рис. 22)
Как видно, в пространстве между ядрами значения молекулярной волновой функции Ψмол.больше, чем значения исходных атомных волновых функций. НоΨмол.характеризует вероятность нахождения электрона в соответствующей области пространства, т.е. плотность электронного облака.
Возрастание Ψмол.– функции в сравнении сΨ1 иΨ2означает, что при образовании молекулярной орбитали плотность электронного облака в межъядерном пространстве увеличивается, в результате возникают силы притяжения положительно заряженных ядер к этой области – образуется химическая связь. Поэтому молекулярная орбиталь рассматриваемого типа называетсясвязывающей.
В данном случае область повышенной электронной плотности находится вблизи оси связи, так что образовавшаяся МОотносится кσ – типу. В соответствии с этим, связывающаяМО, полученная в результате взаимодействия двух атомных1s –орбиталей обозначаетсяσсв.1s. Электроны, находящиеся на связывающейМО, называютсясвязывающими электронами.
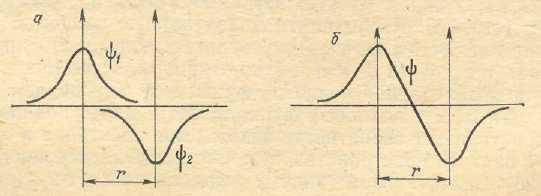
При взаимодействии двух атомов знаки волновых функций их 1s –орбиталей могут оказаться различными. Такой случай графически можно представить следующим образом:
 Ψмол
Ψмол
Рис. 23. Схема образования разрыхляющей МО
из атомных 1 S –орбиталей
Молекулярная орбиталь (рис. 23), образующаяся при таком взаимодействии, характеризуется уменьшением абсолютной величины волновой функции в межъядерном пространстве по сравнению с ее значением в исходных атомах: на оси связи
появляется даже точка, в которой значение волновой функции, а, следовательно, и ее квадрата, обращается в нуль. Это означает, что в рассматриваемом случае уменьшится и плотность электронного облака в пространстве между атомами. В результате притяжения каждого атомного ядра в направлении к межъядерной области пространства окажется более слабым, чем в противоположном направлении, т.е. возникнут силы, приводящие к взаимному отталкиванию ядер. Здесь, следовательно, химическая связь не возникает; образовавшаяся в этом случае МОназываетсяразрыхляющей(σразр.1s), а находящиеся на ней электроны –разрыхляющимиэлектронами.
 Молекулярные
орбитали, полученные при сложении и
вычитании 1s –атомных орбиталей имеют следующие формы
(рис. 24). Взаимодействие, приводящее к
образованию связывающей орбитали,
сопровождается выделением энергии,
поэтому электрон, находящийся на
связывающей орбитали, обладает меньшей
энергией, чем в исходном атоме.
Молекулярные
орбитали, полученные при сложении и
вычитании 1s –атомных орбиталей имеют следующие формы
(рис. 24). Взаимодействие, приводящее к
образованию связывающей орбитали,
сопровождается выделением энергии,
поэтому электрон, находящийся на
связывающей орбитали, обладает меньшей
энергией, чем в исходном атоме.
Рис. 24. Схема образования связывающей и разрыхляющей
молекулярных σ -орбиталей
Образование разрыхляющей орбитали требует затраты энергии. Следовательно, на разрыхляющей орбитали электрон обладает более высокой энергией, чем в исходном атоме.
 Двухатомные
гомоядерные молекулы элементов первого
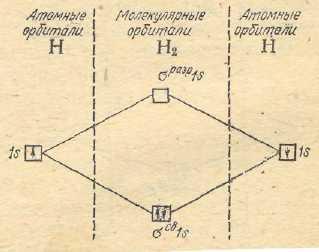
периода.Образование молекулы
водородаH2по методуМОпредставляется следующим
образом (рис. 25):
Двухатомные
гомоядерные молекулы элементов первого
периода.Образование молекулы
водородаH2по методуМОпредставляется следующим
образом (рис. 25):
Рис. 25. Энергетическая диаграмма образования
молекулярных орбиталей H2
Следовательно, вместо двух энергетически равноценных 1 s –орбиталей (исходные атомы водорода) при образовании молекулыH2возникают две энергетически неравноценные молекулярные орбитали – связывающая и разрыхляющая.
В этом случае 2 элемента занимают молекулярную орбиталь с более низкой энергией, т.е. σсв 1 sорбиталь.
Реакция образования молекулы H2в терминахМОможет быть записана:
2 H [1 s1] = H2 [ (σ св1 s)2] или
H [1 s1] + H [1 s1] = H2 [(σ св1 s)2]
В молекуле H2 два электрона. Согласно принципу наименьшей энергии и принципу Паули эти два электрона с противоположными спинами также заселяютσ сворбиталь.
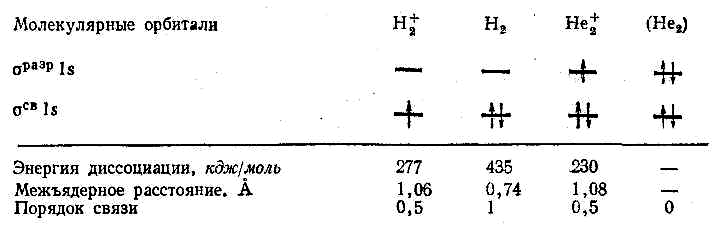
Приведенная энергетическая диаграмма молекулярных орбиталей справедлива для двухъядерных образований (элементами первого периода): H2+, He2+иHe2
В молекулярном дигелии – ионе He2+три электрона, два из которых заселяют связывающую, третий – разрыхляющую орбитальHe2+ [(σсв 1 s)2 (σразр 1 s)](рис. 26):

Рис. 26. Энергетическая диаграмма образования
молекулярных
орбиталей He![]()
 Ион
H2+состоит из двух протонов и одного
электрона. Естественно, что единственный
электрон этого иона должен занимать
энергетически наиболее выгодную
орбиталь, т.е.σ св1s.
Таким образом, электронная формула ионаH2+
H2
+[( σсв
1s)'](рис. 27):
Ион
H2+состоит из двух протонов и одного
электрона. Естественно, что единственный
электрон этого иона должен занимать
энергетически наиболее выгодную
орбиталь, т.е.σ св1s.
Таким образом, электронная формула ионаH2+
H2
+[( σсв
1s)'](рис. 27):
Рис. 27. Энергетическая диаграмма образования
молекулярных
орбиталей H![]()
В системе из двух атомов гелия He2четыре электрона; два на связывающей и два на разрыхляющей орбитали.
Энергия, длина и порядок связи. По характеру распределения электронов по молекулярным орбиталям можно оценить энергию и порядок связи. Как уже было показано, нахождение электрона на связывающей орбитали означает, что электронная плотность концентрируется между ядрами, что обуславливает сокращение межъядерного расстояния и упрочения молекулы. Наоборот электрон на разрыхляющей орбитали означает, что электронная плотность концентрируется за ядрами. В этом случае, следовательно, энергия связывания снижается, а межъядерное расстояние увеличивается, как это показано ниже.
 В
ряду H2+
- H2 - He2+по мере заполнения связывающей орбитали,
энергия диссоциации молекул возрастает,
с появлением же электрона на разрыхляющейМО, наоборот, уменьшается, а затем
увеличивается.
В
ряду H2+
- H2 - He2+по мере заполнения связывающей орбитали,
энергия диссоциации молекул возрастает,
с появлением же электрона на разрыхляющейМО, наоборот, уменьшается, а затем
увеличивается.
Молекула гелия существовать не может в невозбужденном состоянии, так как число связывающих и разрыхляющих электронов у нее одинаково.
Согласно методу МОпорядок связи (кратность)(n)оценивается полуразностью числа связывающих и разрыхляющих электронов:
![]() ,
где
,
где
a –число электронов на связывающих орбиталях;
b- число электронов на разрыхляющих орбиталях.
или
![]() ,
гдеА –число атомов в молекуле.
,
гдеА –число атомов в молекуле.
Нетрудно подсчитать, что в молекулярном ионе водорода и дигелии – ионе порядок связи равен 0,5, в молекуле водорода 1, а в системе из двух атомов гелия – нулю.
Двухатомные гомоядерные молекулы элементов второго периода.У элементов 2 – го периода кроме1 s –орбиталей в образованииМОпринимают участие2s -; 2px - , 2pyи2pz– орбитали.
Комбинация из 2s –орбиталей, как и в случае атомных1s – орбиталей, соответствует образованию двух молекулярныхσ – орбиталей:σсв2s иσразр2s.
Иная картина наблюдается при комбинации орбиталей p – типа. При комбинации атомных2px– орбиталей, которые вытянуты вдоль осих, возникают молекулярныеσ –орбитали:σсв2px иσразр2px.
При комбинации 2pyи2pz атомных орбиталей образуютсяπсв2pyиπсв2pz,πразр2pyиπразр2pz.
Поскольку энергия 2pyи2pz - орбиталей одинакова и перекрываются они одинаковым способом, возникающиеπсв2pyиπсв2pz– орбитали имеют одинаковую энергию и форму; то же самое относится кπразр2pyиπразр2pz – орбиталям. Таким образом, молекулярныеπ –орбитали составляютπсвиπразрдважды вырожденные энергетические уровни.
Согласно спектроскопическим данным МОдвухатомных молекул элементов конца периода по уровню энергии располагаются в следующем порядке:
σсв1s < σразр1s < σсв2s < σразр2s < σсв2px < πсв2py = πсв2pz < πразр2py = πразр2pz < σразр2px
При энергетической близости 2sи2p– орбиталей электроны наσ 2sиσ 2p– орбиталях взаимно отталкиваются и потомуπсв2pyиπсв2pz - орбитали оказываются энергетически более выгодными, чемσсв2pxорбиталь. В этом случае порядок заполнения молекулярных орбиталей несколько изменяется и соответствует следующей последовательности:
σсв1s < σразр1s < σсв2s < σразр2s < πсв2py = πсв2pz < σсв2px < πразр2py = πразр2pz < σразр2px
Энергетическое различие 2sи2p –орбиталей в периоде увеличивается отIгруппы кVIII. Поэтому приведенная последовательность молекулярных орбиталей характерна для двухатомных молекул элементов началаII– го периода вплоть доN2. Так, электронная конфигурацияN2. в основном (невозбужденном) состоянии имеет вид:
2N [1s2 2s2 2p3] = N 2 [(σсв1s) 2 (σразр1s) 2 (σсв2s) 2 (σразр2s) 2 * (πсв2py) 2 (πсв2pz) 2 (σсв.2px) 2]
или графически (рис. 28):
АО МО АО
N 1s2 2s2 2p3 N 2 1s2 2s2 2p3

Рис. 28. Энергетическая диаграмма образования
молекулярных орбиталей N2
Характер распределения электронов по молекулярным орбиталям позволяет объяснить также магнитные свойства молекул. По магнитным свойствам различают парамагнитные идиамагнитныевещества. Парамагнитными являются вещества, у которых имеются непарные электроны, у диамагнитных веществ – все электроны парные.
В таблице приведены сведения об энергии, длине и порядке связи гомоядерных молекул элементов начала и конца 2 – ого периода:
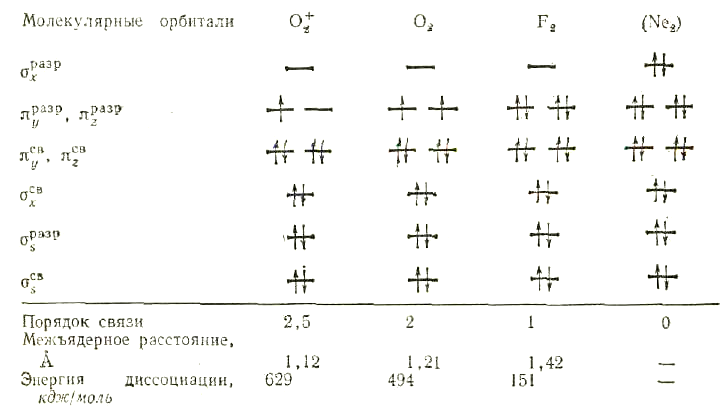 В
молекуле кислорода имеется два непарных
электрона, поэтому она парамагнитна;
молекула фтора непарных электронов не
имеет, следовательно, она диамагнитна.
Парамагнитны также молекула B2и молекулярные ионыH2+иHe2+,
а молекулыС2, N2
иH2–
диамагнитны.
В
молекуле кислорода имеется два непарных
электрона, поэтому она парамагнитна;
молекула фтора непарных электронов не
имеет, следовательно, она диамагнитна.
Парамагнитны также молекула B2и молекулярные ионыH2+иHe2+,
а молекулыС2, N2
иH2–
диамагнитны.
Двухатомные гетероядерные молекулы.Гетероядерные (разноэлементные) двухатомные молекулы описывают методомМОЛКАО, так же как гомоядерные двухатомные молекулы. Однако поскольку речь идет о разных атомах, то энергия атомных орбиталей и их относительный вклад в молекулярные орбитали тоже различны:
Ψ+ = С1 ΨА + С2 ΨB
Ψ- = С3 ΨА + С4 ΨB

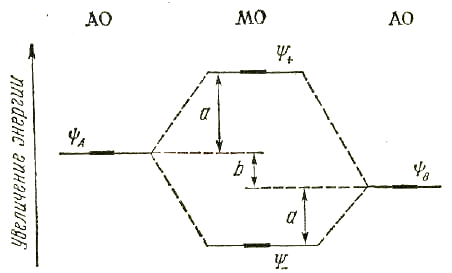
Рис. 29. Энергетическая диаграмма молекулярных орбиталей гетероядерной молекулы АВ
В связывающую орбиталь больший вклад вносит атомная орбиталь более электроотрицательного атома, а в разрыхляющую – орбиталь менее электроотрицательного элемента (рис. 29). Допустим, атом Bэлектроотрицательнее атомаA. ТогдаС2> С1, аС3 > С4.
Различие в энергии исходных атомных орбиталей определяет полярность связи. Величина вявляется мерой ионности,
а величина a – ковалентности связи.
Диаграмма энергетических уровней гетероядерных двухатомных молекул 2 – го периода аналогична диаграмме гомоядерных молекул 2 – го периода. Например, рассмотрим рас-пределение электронов по орбиталям молекулы COи ионовCN-иNO+.
Молекула COи ионыCN-, NO+изоэлектронны молекулеN2 (содержит по 10 валентных электронов), что соответствует следующей электронной конфигурации в невозбужденном состоянии:

Энергетическая
диаграмма уровней молекулы BeH2
имеет вид: Четыре валентных электрона
невозбужденной молекулыBeH2располагаются наσ
![]() иσ
иσ
![]() - орбиталях, что описывается формулой(σ
- орбиталях, что описывается формулой(σ
![]() )
2 (σ
)
2 (σ
![]() )2.
)2.
