
- •Введение
- •Раздел первый
- •1.2. Определение химии
- •1.3. Атомно-молекулярное учение
- •1.4. Основные стехиометрические законы химии
- •1.5. Значение химии в развитии техники
- •Глава 2. Строение атомов. Периодический закон и периодическая система химических элементов д.И. Менделеева
- •2.1. Первые модели строения атома
- •2.2. Квантово-механическая модель атома водорода
- •2.3. Квантовые числа
- •2.4. Атомные орбитали
- •2.5. Многоэлектронные атомы
- •2.6. Распределение электронов по энергетическим уровням и подуровням у элементов малых периодов
- •2.7. Распределение электронов по энергетическим уровням и подуровням у элементов больших периодов
- •2.8. Периодический закон д. И. Менделеева
- •2.9. Структура периодической системы химических элементов д. И. Менделеева
- •2.10. Свойства атомов элементов в периодической системе
- •2.11. Закономерности изменения свойств элементов и их соединений в периодической системе
- •Глава 3. Химическая связь и строение молекул
- •3.1. Развитие теории химической связи
- •3.2. Ковалентная связь. Кривая потенциальной энергии
- •3.3. Основные количественные характеристики ковалентной связи
- •3.4. Квантово – механическая теория валентности
- •3.5. Донорно – акцепторный механизм образования ковалентной связи
- •3.6. Свойства ковалентной связи
- •3.7. Метод молекулярных орбиталей
- •3.8. Ионная связь
- •3.9. Водородная связь
- •3.10. Межмолекулярное взаимодействие
- •Глава 4. Кристаллическое состояние вещества
- •4.1. Макроскопические свойства кристаллов
- •4.2. Внутреннее строение кристаллов
- •4.3. Виды элементарных ячеек
- •4.4. Металлическая связь
- •4.5. Реальные кристаллы и нарушения кристаллической структуры
- •Раздел второй
- •5.2. Первый закон термодинамики
- •5.3. Энтальпия образования химических соединений
- •5.4. Энтропия. Второй закон термодинамики
- •5.5. Третий закон термодинамики
- •5.6. Энергия Гиббса. Направленность химических реакций
- •164,9 КДж; 172,41 Дж/моль∙к;
- •Глава 6. Скорость химических реакций. Химическое равновесие
- •6.1. Влияние внешних факторов на скорость химических реакций
- •6.2. Химическое равновесие
- •6.3. Цепные реакции
- •6.4. Фазовые равновесия
- •6.5. Катализаторы и каталитические системы
- •Раздел третий растворы
- •Глава 7. Общие свойства растворов
- •7.1. Механизм процессов растворения
- •7.2. Способы выражения количественного состава растворов
- •100 ∙ 10,91 Моль % h2so4
- •7.3. Энергетика растворения
- •7.4. Свойства растворов неэлектролитов
- •7.5. Свойства растворов электролитов
- •7.6. Электролитическая диссоциация воды. Водородный показатель
- •7.7. Произведение растворимости. Гидролиз солей
- •Глава 8. Окислительно-восстановительные реакции
- •8.1.Общие понятия об окислительно- восстановительных реакциях
- •8.2. Классификация окислителей и восстановителей
- •8.3. Количественная характеристика окислительно-восстановительных реакций
- •8.4. Методы составления уравнения окислительно-восстановительных реакций
- •8.5. Влияние факторов на характер и направление реакций
- •8.6. Типы окислительно-восстановительных реакций
- •Глава 9. Электрохимические процессы
- •9.1. Строение двойного электрического слоя
- •9.2. Гальванические элементы
- •9.3. Стандартный водородный электрод
- •9.4. Поляризационные явления в гальванических элементах
- •9.5. Химические источники тока
- •9.6. Аккумуляторы
- •9.7. Топливные элементы
- •9.8. Теоретические основы электролиза
- •9.9. Последовательность электродных процессов
- •9.10. Техническое применение электролиза
- •Глава 10. Коррозия и защита металлов
- •10.1. Общие сведения о коррозии
- •10.2. Классификация коррозионных процессов
- •10.3. Количественная и качественная оценка коррозии и коррозионной стойкости
- •10.4. Химическая коррозия
- •10.5. Электрохимическая коррозия
- •10.6. Методы защиты от электрохимической коррозии
- •Раздел четвертый
- •11.2. Электропроводность металлов, полупроводников и диэлектриков
- •11.3. Химические свойства металлов высокой проводимости
- •11.4. Электропроводимость металлов подгруппы меди
- •11.5. Химические свойства магнитных материалов
- •11.6. Магнитные свойства металлов семейства железа
- •Глава 12. Химическая идентификация и анализ вещества
- •12.1. Химическая идентификация вещества
- •12.2. Количественный анализ
- •12.3. Инструментальные методы анализа
- •Заключение
- •Библиографический список
- •Глава 1. Основные понятия химии. Предмет и задачи
- •Глава 2. Строение атомов. Периодический закон и
- •Глава 3. Химическая связь и строение молекул………..54
- •Глава 4. Кристаллическое состояние вещества………..103
- •Глава 12. Химическая идентификация и анализ
6.2. Химическое равновесие
Многие химические
реакции протекают обратимо. Их особенность
состоит в том, что они не идут до конца,
в системе всегда остается (в большем
или меньшем количестве) каждое из
исходных веществ. В ходе обратимой
химической реакции концентрации
исходных веществ уменьшаются, а продуктов
- возрастают. Это сопровождается
увеличением скорости обратной реакции![]() ←и уменьшением скорости прямой реакции
←и уменьшением скорости прямой реакции![]() →.
Если в системе наступает состояние, при
котором
→.
Если в системе наступает состояние, при
котором![]() →
=
→
=![]() ←,
то его называютхимическим равновесием.
←,
то его называютхимическим равновесием.
Истинное химическое равновесие характеризуется тремя признаками: в системе не происходит видимых во времени изменений при отсутствии внешнего воздействия; равновесие достигается как при прямой, так и при обратной реакции (рис. 51), самое малое внешнее воздействие легко и незначительно смещает равновесие в ту или в другую сторону.
Примером обратимой реакции является образование иодоводорода:
H2
+ I2
![]() 2HI
2HI
которая при 4440 Си давлением в0,1 МПапрекращается после образования78 % НI. Эта концентрация отвечает состоянию химического равновесия. Не изменяя температуры и давления, нельзя получить больше, чем78 %НI.
В случае обратимой химической реакции
aA
+ bB
![]() cC + dD
cC + dD
Зависимость
скоростей прямой (![]() →)
и обратной (
→)
и обратной (![]() ←)
реакции от концентраций реагирующих
веществ выражается соотношениями
←)
реакции от концентраций реагирующих
веществ выражается соотношениями
![]() →
= K→
∙ [A] a
∙ [B] b
→
= K→
∙ [A] a
∙ [B] b
![]() ←
= K
← ∙ [C] c
∙ [D] d
←
= K
← ∙ [C] c
∙ [D] d
В состоянии
химического равновесия
![]() →
=
→
=
![]() ←,
т.е.
←,
т.е.
K→ ∙ [A] a ∙ [B] b = K ← ∙ [C] c ∙ [D] d
Отсюда
![]()
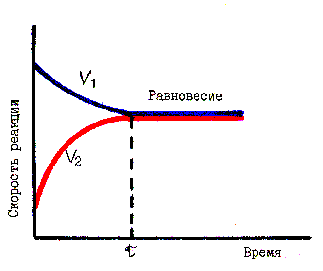
Рис. 51. Установление химического равновесия
где Kp- константа равновесия реакции. Kp- основная количественная характеристика химического равновесия.
Концентрации, входящие в выражение константы равновесия, называются равновесными концентрациями. Kp- постоянная при данной температуре величина, выражающая соотношение между равновесными концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель). Чем большеKp, тем более глубоко протекает реакция, т.е. тем больше выход ее продуктов.Kpзависит от природы реагентов, температуры и не зависит от исходных концентраций веществ в системе.
Например, для реакции:
4HCl
+ O2
![]() 2Cl2
+ 2H2O
Kp
= 1,2 ∙ 1016
2Cl2
+ 2H2O
Kp
= 1,2 ∙ 1016
Для реакции диссоциации угольной кислоты
H2CO3
![]() H+ + HCO
H+ + HCO![]() Kp
= 4,4 ∙ 10-7
Kp
= 4,4 ∙ 10-7
Если обратимая реакция протекает в гетерогенной системе, например
FeO
(к) + CO
(г)
![]() Fe
(к) + CO2
(г),
Fe
(к) + CO2
(г),
то константа равновесия Kpравна отношению равновесных парциальных давлений газообразных веществ(CО2 и СО)и не зависит от абсолютных и относительных количеств веществ, находящихся в конденсированной фазе(Fe и FeO):
Kp
=
![]()
Зависимость Kpот температуры приp = constвыражаетсяуравнением изобарыхимической реакции:
ln
Kp
=
![]()
Если
![]() <
0,то константа равновесия при повышении
температуры уменьшается. Если
<
0,то константа равновесия при повышении
температуры уменьшается. Если
![]() >
0(эндотермическая реакция), то величинаKpпри повышении температуры увеличивается.
>
0(эндотермическая реакция), то величинаKpпри повышении температуры увеличивается.
Зависимость константы равновесия от температуры при V = constвыражаетсяуравнением изохорыхимической реакции:
ln
Kp
=
![]()
Принцип Ле Шателье.При изменении условий протекания реакции (T,P,Cкакого либо из веществ) скорости прямого и обратимого процессов изменяются неодинаково и химическое равновесие нарушается. В результате преимущественного протекания реакции в одном из возможных направлений устанавливается состояние нового химического равновесия, отличающееся от исходного. Процесс перехода от одного равновесного состояния к новому равновесию называетсясмещением химического равновесия.Направление этого смещения подчиняетсяпринципуЛе Шателье:если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Так повышение температурыприводит к смещению равновесия в направлении реакции, сопровождающейся поглощением теплоты, т.е. охлаждением системы.
Например, для обратимой экзотермической реакции
N2(г)+ 3H2(г)![]() 2NH3(г),
2NH3(г),
![]() = - 91 кДж
= - 91 кДж
Повышение температуры будет смещать равновесие влево, в сторону разложения аммиака на N2иН2. Например, выход аммиака для этой реакции при300 0Си20 МПасоставляет64%, а при600 0Си том же давлении - всего8 %.
Повышение давлениявызывает смещение равновесия в направлении уменьшения общего числа молей газообразных веществ, т.е. в направлении, приводящем к понижению давления. При увеличении давления, например, в реакции синтеза аммиака (рассмотренной выше), выход продукта возрастает. В частности при300 0Си при давлении100 МПавыход аммиака достигает92 %.
При увеличении концентрации, например, исходных веществ сдвиг равновесия произойдет в сторону образования продуктов реакции. Например, при увеличении концентрации азота или водорода равновесие реакции сместится в сторону образования аммиака.
Константа равновесия
Kpхимической реакции связана со стандартным
изменением энергии Гиббса этой реакции
![]() уравнением:
уравнением:
![]()
При 298 Кэто уравнение имеет вид:
![]()
Видно, что Δ G
< 0в том случае, если
![]() >
0, т.к.K > 1, а
положительный (Δ G0
> 0), если
>
0, т.к.K > 1, а
положительный (Δ G0
> 0), если
![]() <
0, т.е.K < 1. Это
значит, что при отрицательных значенияхΔ G0равновесие смещено в направлении прямой
реакции и выход продуктов реакции
сравнительно велик; приΔ G0
> 0равновесие смещено в сторону
обратной реакции и выход продуктов
прямой реакции сравнительно мал.
<
0, т.е.K < 1. Это
значит, что при отрицательных значенияхΔ G0равновесие смещено в направлении прямой
реакции и выход продуктов реакции
сравнительно велик; приΔ G0
> 0равновесие смещено в сторону
обратной реакции и выход продуктов
прямой реакции сравнительно мал.
