
- •Введение
- •Раздел первый
- •1.2. Определение химии
- •1.3. Атомно-молекулярное учение
- •1.4. Основные стехиометрические законы химии
- •1.5. Значение химии в развитии техники
- •Глава 2. Строение атомов. Периодический закон и периодическая система химических элементов д.И. Менделеева
- •2.1. Первые модели строения атома
- •2.2. Квантово-механическая модель атома водорода
- •2.3. Квантовые числа
- •2.4. Атомные орбитали
- •2.5. Многоэлектронные атомы
- •2.6. Распределение электронов по энергетическим уровням и подуровням у элементов малых периодов
- •2.7. Распределение электронов по энергетическим уровням и подуровням у элементов больших периодов
- •2.8. Периодический закон д. И. Менделеева
- •2.9. Структура периодической системы химических элементов д. И. Менделеева
- •2.10. Свойства атомов элементов в периодической системе
- •2.11. Закономерности изменения свойств элементов и их соединений в периодической системе
- •Глава 3. Химическая связь и строение молекул
- •3.1. Развитие теории химической связи
- •3.2. Ковалентная связь. Кривая потенциальной энергии
- •3.3. Основные количественные характеристики ковалентной связи
- •3.4. Квантово – механическая теория валентности
- •3.5. Донорно – акцепторный механизм образования ковалентной связи
- •3.6. Свойства ковалентной связи
- •3.7. Метод молекулярных орбиталей
- •3.8. Ионная связь
- •3.9. Водородная связь
- •3.10. Межмолекулярное взаимодействие
- •Глава 4. Кристаллическое состояние вещества
- •4.1. Макроскопические свойства кристаллов
- •4.2. Внутреннее строение кристаллов
- •4.3. Виды элементарных ячеек
- •4.4. Металлическая связь
- •4.5. Реальные кристаллы и нарушения кристаллической структуры
- •Раздел второй
- •5.2. Первый закон термодинамики
- •5.3. Энтальпия образования химических соединений
- •5.4. Энтропия. Второй закон термодинамики
- •5.5. Третий закон термодинамики
- •5.6. Энергия Гиббса. Направленность химических реакций
- •164,9 КДж; 172,41 Дж/моль∙к;
- •Глава 6. Скорость химических реакций. Химическое равновесие
- •6.1. Влияние внешних факторов на скорость химических реакций
- •6.2. Химическое равновесие
- •6.3. Цепные реакции
- •6.4. Фазовые равновесия
- •6.5. Катализаторы и каталитические системы
- •Раздел третий растворы
- •Глава 7. Общие свойства растворов
- •7.1. Механизм процессов растворения
- •7.2. Способы выражения количественного состава растворов
- •100 ∙ 10,91 Моль % h2so4
- •7.3. Энергетика растворения
- •7.4. Свойства растворов неэлектролитов
- •7.5. Свойства растворов электролитов
- •7.6. Электролитическая диссоциация воды. Водородный показатель
- •7.7. Произведение растворимости. Гидролиз солей
- •Глава 8. Окислительно-восстановительные реакции
- •8.1.Общие понятия об окислительно- восстановительных реакциях
- •8.2. Классификация окислителей и восстановителей
- •8.3. Количественная характеристика окислительно-восстановительных реакций
- •8.4. Методы составления уравнения окислительно-восстановительных реакций
- •8.5. Влияние факторов на характер и направление реакций
- •8.6. Типы окислительно-восстановительных реакций
- •Глава 9. Электрохимические процессы
- •9.1. Строение двойного электрического слоя
- •9.2. Гальванические элементы
- •9.3. Стандартный водородный электрод
- •9.4. Поляризационные явления в гальванических элементах
- •9.5. Химические источники тока
- •9.6. Аккумуляторы
- •9.7. Топливные элементы
- •9.8. Теоретические основы электролиза
- •9.9. Последовательность электродных процессов
- •9.10. Техническое применение электролиза
- •Глава 10. Коррозия и защита металлов
- •10.1. Общие сведения о коррозии
- •10.2. Классификация коррозионных процессов
- •10.3. Количественная и качественная оценка коррозии и коррозионной стойкости
- •10.4. Химическая коррозия
- •10.5. Электрохимическая коррозия
- •10.6. Методы защиты от электрохимической коррозии
- •Раздел четвертый
- •11.2. Электропроводность металлов, полупроводников и диэлектриков
- •11.3. Химические свойства металлов высокой проводимости
- •11.4. Электропроводимость металлов подгруппы меди
- •11.5. Химические свойства магнитных материалов
- •11.6. Магнитные свойства металлов семейства железа
- •Глава 12. Химическая идентификация и анализ вещества
- •12.1. Химическая идентификация вещества
- •12.2. Количественный анализ
- •12.3. Инструментальные методы анализа
- •Заключение
- •Библиографический список
- •Глава 1. Основные понятия химии. Предмет и задачи
- •Глава 2. Строение атомов. Периодический закон и
- •Глава 3. Химическая связь и строение молекул………..54
- •Глава 4. Кристаллическое состояние вещества………..103
- •Глава 12. Химическая идентификация и анализ
4.4. Металлическая связь
Металлические кристаллыотличаются от всех остальных кристаллов высокой пластичностью, электропроводностью и теплопроводностью. Эти свойства, а также и многие другие, обусловлены особым видом связи между атомами металла – металлической связью. Она возникает между атомами металлов в результате их сближения за счет перекрывания внешних орбиталей. Эта связь не является ковалентной неполярной связью, так как электроны не фиксируются между двумя атомами, а переходят в состояние проводимости и могут принадлежать всем атомам данного кристалла и даже куска металла, содержащего громадное количество кристаллических зерен. Эти мигрирующие электроны, или обобщенные электроны, -электроны проводимости (свободные электроны или электронный газ) – и осуществляют ненаправленную связь между остовами атомов в кристаллической решетке металлов.
Металлическая связь представляет собой результат перекрытия делокализованных орбиталей атомов, сближающихся между собой в кристаллической решетке металлических кристаллов.
Особенностью кристаллической структуры металлов являются высокие координационные числа (8-12), свидетельствующие о большой плотности упаковки в кристаллических ячейках. Высокая плотность упаковки объясняется тем, что остовы атомов, лишенные внешних электронных уровней, укладываются в пространстве как шары одинакового радиуса. Типичные для металлов кристаллические решетки показаны на рис. 43.
ОЦК -
Объемноцентрированная кубическая
решетка(К 8)(рис. 43,а)
характеризуется следующими данными:
а) координационное числоК = 8; б)
кратчайшее расстояние между
центрами атомов равно половине диагонали
куба
![]() ;в)
число атомов, необходимое для построения,
п
= 2, так
как 8 вершин
содержат 1/8 атома, приходящегося на
данный куб, и в центре куба
находится еще один атом;
;в)
число атомов, необходимое для построения,
п
= 2, так
как 8 вершин
содержат 1/8 атома, приходящегося на
данный куб, и в центре куба
находится еще один атом;
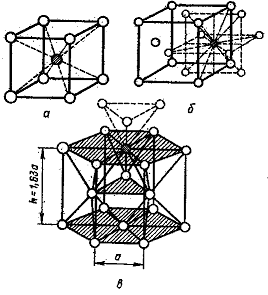
Рис. 43. Металлические решетки
г) плотность упаковки или часть пространства, занятая атомами в данном кубе, составляет ~68 %. В таких решетках кристаллизуются К, Na, W, α- Fe, β- Ti и др.
ГЦК -
Гранецентрированная
кубическая
решетка
(К
12)
(рис.
43, б)
определяется
следующими
данными: а) координационное
число К
= 12;
б) кратчайшее расстояние
между центрами атомов
равно половине диагонали
грани
![]() ;
в) число атомов, необходимое
для построения, равно 4, так как на все
вершины нужен только один атом, а атом,
находящийся в центре грани, наполовину
принадлежит данному кубу, а таких граней
6. Следовательно,n = 8(1/8) + 6(1/2) = 4; г)
плотность упаковки в данной решетке
составляет~74 %.В
таких решетках кристаллизуются
Сu;
Ni;
γ- Fe;
Pb
и др.
;
в) число атомов, необходимое
для построения, равно 4, так как на все
вершины нужен только один атом, а атом,
находящийся в центре грани, наполовину
принадлежит данному кубу, а таких граней
6. Следовательно,n = 8(1/8) + 6(1/2) = 4; г)
плотность упаковки в данной решетке
составляет~74 %.В
таких решетках кристаллизуются
Сu;
Ni;
γ- Fe;
Pb
и др.
ГПУ - Гексагональная решетка плотной упаковки (Г 12) (рис. 43, в) более сложная, но по степени упаковки совпадает с гранецентрированной кубической. Ее данные: а) координационное число К = 12; б) кратчайшее расстояние между центрами атомов а равно стороне правильного шестиугольника основания призмы. Все атомы, если их представить шарами радиусом а/2, будут в этой решетке касаться друг друга. Поэтому высота призмы h в идеальном случае (Mg, Be) должна быть рав
на 1,63 а или двум высотам тетраэдров, построенных из этих шаров; в) число атомов, необходимых для построения, равно 6. На каждой вершине призмы расположен атом, одновременно принадлежащий шести сходящимся в одной точке решеткам. Вершин 12 x 1/6 = 2. В центре верхнего и нижнего основания лежат атомы, половина которых относится к данной решетке: 2 x 1/2 = l. Внутри призмы находятся еще три атома и всего получается n = 12 х 1/6 + 2 х 1/2 +3 = 6; г) плотность упаковки 74 %.В таких решетках кристаллизуется Be, Mg, Zn, α- Ti и др.
