
- •Введение
- •Раздел первый
- •1.2. Определение химии
- •1.3. Атомно-молекулярное учение
- •1.4. Основные стехиометрические законы химии
- •1.5. Значение химии в развитии техники
- •Глава 2. Строение атомов. Периодический закон и периодическая система химических элементов д.И. Менделеева
- •2.1. Первые модели строения атома
- •2.2. Квантово-механическая модель атома водорода
- •2.3. Квантовые числа
- •2.4. Атомные орбитали
- •2.5. Многоэлектронные атомы
- •2.6. Распределение электронов по энергетическим уровням и подуровням у элементов малых периодов
- •2.7. Распределение электронов по энергетическим уровням и подуровням у элементов больших периодов
- •2.8. Периодический закон д. И. Менделеева
- •2.9. Структура периодической системы химических элементов д. И. Менделеева
- •2.10. Свойства атомов элементов в периодической системе
- •2.11. Закономерности изменения свойств элементов и их соединений в периодической системе
- •Глава 3. Химическая связь и строение молекул
- •3.1. Развитие теории химической связи
- •3.2. Ковалентная связь. Кривая потенциальной энергии
- •3.3. Основные количественные характеристики ковалентной связи
- •3.4. Квантово – механическая теория валентности
- •3.5. Донорно – акцепторный механизм образования ковалентной связи
- •3.6. Свойства ковалентной связи
- •3.7. Метод молекулярных орбиталей
- •3.8. Ионная связь
- •3.9. Водородная связь
- •3.10. Межмолекулярное взаимодействие
- •Глава 4. Кристаллическое состояние вещества
- •4.1. Макроскопические свойства кристаллов
- •4.2. Внутреннее строение кристаллов
- •4.3. Виды элементарных ячеек
- •4.4. Металлическая связь
- •4.5. Реальные кристаллы и нарушения кристаллической структуры
- •Раздел второй
- •5.2. Первый закон термодинамики
- •5.3. Энтальпия образования химических соединений
- •5.4. Энтропия. Второй закон термодинамики
- •5.5. Третий закон термодинамики
- •5.6. Энергия Гиббса. Направленность химических реакций
- •164,9 КДж; 172,41 Дж/моль∙к;
- •Глава 6. Скорость химических реакций. Химическое равновесие
- •6.1. Влияние внешних факторов на скорость химических реакций
- •6.2. Химическое равновесие
- •6.3. Цепные реакции
- •6.4. Фазовые равновесия
- •6.5. Катализаторы и каталитические системы
- •Раздел третий растворы
- •Глава 7. Общие свойства растворов
- •7.1. Механизм процессов растворения
- •7.2. Способы выражения количественного состава растворов
- •100 ∙ 10,91 Моль % h2so4
- •7.3. Энергетика растворения
- •7.4. Свойства растворов неэлектролитов
- •7.5. Свойства растворов электролитов
- •7.6. Электролитическая диссоциация воды. Водородный показатель
- •7.7. Произведение растворимости. Гидролиз солей
- •Глава 8. Окислительно-восстановительные реакции
- •8.1.Общие понятия об окислительно- восстановительных реакциях
- •8.2. Классификация окислителей и восстановителей
- •8.3. Количественная характеристика окислительно-восстановительных реакций
- •8.4. Методы составления уравнения окислительно-восстановительных реакций
- •8.5. Влияние факторов на характер и направление реакций
- •8.6. Типы окислительно-восстановительных реакций
- •Глава 9. Электрохимические процессы
- •9.1. Строение двойного электрического слоя
- •9.2. Гальванические элементы
- •9.3. Стандартный водородный электрод
- •9.4. Поляризационные явления в гальванических элементах
- •9.5. Химические источники тока
- •9.6. Аккумуляторы
- •9.7. Топливные элементы
- •9.8. Теоретические основы электролиза
- •9.9. Последовательность электродных процессов
- •9.10. Техническое применение электролиза
- •Глава 10. Коррозия и защита металлов
- •10.1. Общие сведения о коррозии
- •10.2. Классификация коррозионных процессов
- •10.3. Количественная и качественная оценка коррозии и коррозионной стойкости
- •10.4. Химическая коррозия
- •10.5. Электрохимическая коррозия
- •10.6. Методы защиты от электрохимической коррозии
- •Раздел четвертый
- •11.2. Электропроводность металлов, полупроводников и диэлектриков
- •11.3. Химические свойства металлов высокой проводимости
- •11.4. Электропроводимость металлов подгруппы меди
- •11.5. Химические свойства магнитных материалов
- •11.6. Магнитные свойства металлов семейства железа
- •Глава 12. Химическая идентификация и анализ вещества
- •12.1. Химическая идентификация вещества
- •12.2. Количественный анализ
- •12.3. Инструментальные методы анализа
- •Заключение
- •Библиографический список
- •Глава 1. Основные понятия химии. Предмет и задачи
- •Глава 2. Строение атомов. Периодический закон и
- •Глава 3. Химическая связь и строение молекул………..54
- •Глава 4. Кристаллическое состояние вещества………..103
- •Глава 12. Химическая идентификация и анализ
3.2. Ковалентная связь. Кривая потенциальной энергии
Химическая связь образуется только в том случае, если при сближении атомов (двух или большего числа) полная энергия системы (сумма кинетической и потенциальной энергии) понижается.
Важнейшие сведения о строении молекул дает изучение зависимости потенциальной энергии системы от расстояния между составляющими ее атомами. Впервые эту зависимость изучили в 1927 году немецкие ученые У. Гейтлер и Ф. Лондон, исследуя причины возникновения химической связи в молекуле водорода. Используя уравнение Шредингера, они пришли к выводу, что энергия системы, состоящей в молекуле водорода из двух ядер и двух электронов, может быть выражена следующим образом:
Е = ~ К О,
где К– кулоновский интеграл, включающий все электростатические взаимодействия, т.е. отталкивание между электронами, отталкивания между ядрами, а так же притяжение электронов к ядрам атомов.О– обменный интеграл, он характеризует возникновение электронной пары и обусловлен движением электронов вокруг обоих ядер водорода. Этот интеграл имеет очень большое отрицательное значение. Таким образом, по расчетам, энергия данной системы может принимать два значения:
Е = ~К + ОиЕ = ~К - О
Следовательно, существуют такие состояния электронов, при взаимодействии которых энергия системы может изменяться в пределах 0 < E < 0.
Первое уравнение соответствует уменьшению энергии системы Е < 0.
Второе уравнение соответствует увеличению энергии системы Е > 0.
Условию уменьшения энергии системы удовлетворяет “”- функция, определяющая состояние взаимодействующих электронов с противоположно направленными (антипараллельными) спинами. Эта“”- функция называется симметричной“”- функцией.
Отсюда следует вывод - химическая связь между атомами должна возникать только в том случае, если электроны, принадлежащие различным атомам, имеют противоположно направленные спины. Лишь при этом условии энергия молекулярной системы будет меньше энергии атомных систем, т.е. образуется устойчивая молекула. Следовательно, антипараллельность спинов электронов взаимодействующих атомов является необходимым условием образования ковалентной связи.

Рис. 8. Изменение потенциальной энергии в системе из двух атомов водорода в зависимости от расстояния между ядрами
При сближении двух атомов, если спины электронов параллельны, то суммарная их энергия увеличивается, между атомами возникает и возрастает сила отталкивания (рис.8).
При противоположно направленных спинах сближение атомов до некоторого расстояния r0сопровождается уменьшением энергии системы.
При r = r0система обладает наименьшей энергией, т.е. находится в наиболее устойчивом состоянии, характеризующимся образованием молекул водородаН2. При дальнейшем сближении атомов энергия резко возрастает.
Возникновение молекулы Н2из атомов можно объяснить перекрыванием атомных электронных облаков с образованием молекулярного облака, которое окружает два положительно заряженных ядра.
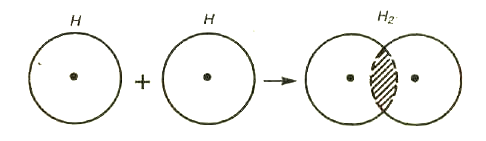
Рис. 9. Перекрывание электронных облаков
при образовании молекулы водорода
В месте перекрывания электронных облаков (т.е. в пространстве между ядрами) электронная плотность связующего облака максимальна (рис.9). Иначе говоря, вероятность пребывания электронов в пространстве между ядрами больше, чем в других местах. Благодаря этому возникают силы притяжения между положительным зарядом ядра и отрицательными зарядами электронов и ядра сближаются – расстояние между ядрами водорода в молекуле Н2заметно меньше(0,74 Å)суммы радиусов двух свободных атомов водорода(1,06 Å)
Связь, образующаяся в результате обобщения электронных плотностей взаимодействующих атомов получила название ковалентной.
С

 огласно
квантово - механическим представлениям
взаимодействие атомов может привести
к образованию молекулы только при
условии, что спины электронов сближающихся
атомов с противоположно направленными
спинами. При сближении электронов с
параллельными спинами действуют только
силы отталкивания.
огласно
квантово - механическим представлениям
взаимодействие атомов может привести
к образованию молекулы только при
условии, что спины электронов сближающихся
атомов с противоположно направленными
спинами. При сближении электронов с
параллельными спинами действуют только
силы отталкивания.
Н+Н→НН → Н2
+1/2 -1/2
Поскольку точное решение уравнения Шредингера для атомно-молекулярных систем невозможно, возникли различные приближенные методы расчета волновой функции, а следовательно распределения электронной плотности в молекуле. Наиболее широкое распространение получили два метода: метод валентных связей (ВС)и метод молекулярных орбиталей(МО). В развитии первого метода особая заслуга принадлежит Гейтлеру и Лондону, Слетеру и Полингу. Развитие второго метода связано в основном с именами Малликена и Хунда.
Основные положения метода ВС. 1) Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, при чем эта электронная пара принадлежит двум атомам.
2) При образовании ковалентной связи происходит перекрывание электронных облаков взаимодействующих атомов, в межъядерном пространстве увеличивается электронная плотность, что приводит к уменьшению энергии системы.
3) Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Поэтому ковалентная связь образуется в таком направлении, при котором это перекрытие максимально.
Этот метод дает обоснование обозначению с помощью черточки химической связи в структурных формулах соединений.

Таким образом, в представлении метода ВСхимическая связь локализована между двумя атомами, т.е. она двухцентровая и двухэлектронная.
