
2013.Термодинамика / T_C
.docT-C - диаграммы состояния бинарных систем. Приближение регулярных растворов.
В модели регулярных растворов термодинамический потенциал Гиббса бинарной системы в однофазном состоянии имеет вид
![]() ,
,
где
![]()
-вклад в потенциал Гиббса стандартного состояния.
![]() -мольные
термодинамические потенциалы Гиббса
чистых компонентов А и В, соответственно,
имеющих структуру раствора .В случае
твердого раствора Кристаллическая
структура чистых компонентов А и В и
параметры решетки должны совпадать со
структурой и параметрами решетки
сплава. С=СВ
- концентрация компонента В в системе
А-В, а (1-С)=СА
- концентрация компонента А. R
- газовая
постоянная.
-мольные
термодинамические потенциалы Гиббса
чистых компонентов А и В, соответственно,
имеющих структуру раствора .В случае
твердого раствора Кристаллическая
структура чистых компонентов А и В и
параметры решетки должны совпадать со
структурой и параметрами решетки
сплава. С=СВ
- концентрация компонента В в системе
А-В, а (1-С)=СА
- концентрация компонента А. R
- газовая
постоянная.
- параметр "химического" взаимодействия не зависящий от температуры, давления м концентрации.
За стандартное состояние принимается механическая смесь двух чистых фаз в А и и В состоянии, которое, как правило, не является равновесным ни для чистой фазы А ни для чистой фазы В. Это связано с тем, что размеры атомов компонентов А и В отличаются даже если кристаллические структуры чистых фаз совпадают. Выражение для энтропии идеального раствора, которое используется в приближении регулярных растворов, имеет место только при равенстве размеров частиц компонентов. В самом деле, пусть атомы В больше по объему, чем атомы А. В этом случае свободные перестановки атомов А и В невозможны. Часть конфигурации будет запрещена, поскольку на место маленького атома нельзя поместить большой атом не изменяя координат других атомов.
Чтобы иметь
возможность свободно обмениваться
местами атомам фаза В должна быть сжата,
а фаза А растянута. Можно мыслить атомы
А и В, как упругие мячики при образовании
раствора атомы А растягиваются , а атомы
В сжимаются. Изменение внутренней
энергии чистых фаз при гидростатическом
сжатии или растяжении определяется
объемными модулями упругости. Если в
качестве стандартного состояния
использовать для чистых фаз значения
соответствующие их равновесному
состоянии, то это не будет логически
согласовываться с использованием в
качестве энтропии раствора идеальной
энтропии. Доля фазы А,В
в стандартном состоянии
![]() при
средней с С
концентрации
равна А=
(1-С),
В=С
. Термодинамический
потенциал стандартного состояния
является функцией
Т,Р,С.
при
средней с С
концентрации
равна А=
(1-С),
В=С
. Термодинамический
потенциал стандартного состояния
является функцией
Т,Р,С.
Абсолютные значения термодинамических потенциалов в рамках термодинамики не могут быть определены могут быть измерено лишь изменение термодинамического потенциала Гиббса от некоторого стандартного состояния.
Таким образом, в
выражении (1) значение потенциала Гиббса
для механической смеси двух фаз
![]() не
известно вместе с тем потенциал смешения,
не
известно вместе с тем потенциал смешения,
![]()
может быть либо вычислен либо измерен непосредственно.
![]() есть разность
термодинамического потенциала раствора
и термодинамического потенциала
двухфазной смеси стандартного состояния,
выбранного указанным выше способом.
Выбор иного стандартного состояния
изменит численное значение потенциала
макроскопически однородного раствора,
но не изменит выражения (2) поскольку
оно является разностью термодинамический
потенциалов двух состояний системы
однородного раствора
и первоначально определенного стандартного
состояния.
есть разность
термодинамического потенциала раствора
и термодинамического потенциала
двухфазной смеси стандартного состояния,
выбранного указанным выше способом.
Выбор иного стандартного состояния
изменит численное значение потенциала
макроскопически однородного раствора,
но не изменит выражения (2) поскольку
оно является разностью термодинамический
потенциалов двух состояний системы
однородного раствора
и первоначально определенного стандартного
состояния.
Если
![]() ,
то однородный раствор является более
стабильной фазой по сравнению с двухфазным
состоянием стандартного состояния.
Если
,
то однородный раствор является более
стабильной фазой по сравнению с двухфазным
состоянием стандартного состояния.
Если
![]() , то двухфазное состояние чистых
компонентов более стабильно чем чистый
раствор и раствор будет неустойчив по
отношению к макро диффузии компонентов
и начнет распадаться на чистые фазы.
Точнее на два раствора один с концентрацией
компонентов меньшей средней концентрации
С компонента
В в системе, а второй с концентрацией
большей С.
Это связано с тем , что потенциал Гиббса
двухфазной механической смеси двух
однородных растворов оказывается меньше
потенциала Гиббса для двухфазного,
стандартного состояния. Самой стабильной
является то состояние системы для,
которого термодинамический потенциал
при данных T,P,C
имеет наименьшее значение. Таким образом
возможные, виртуальные состояния
системы однофазные двухфазные, трехфазные
"конкурируют" друг с другом за
право воплощения в реальности.
Реализоваться могут не только состояния
с наименьшим термодинамическим
потенциалом Гиббса. Реализуются и
состояния с более высоким значением
потенциала Какие из них реализуются,
определяется пред историей состояний
системы. О таких состояниях говорят,
как о метастабильных состояниях. Эти
состояния устойчивы относительно малых
возмущений в системе, но большие
возмущения приведут к переходу в
состояние с наименьшим термодинамическим
потенциалом, которое называют, поэтому
стабильным состоянием. Различные
термодинамические состояния системы
определяются относительно разных
стандартных состояний. При решении
вопроса о стабильности и метастабильности
состояний системы перед сравнением
численных значений термодинамических
потенциалов друг с другом всегда нужно
убедиться, что они отсчитываются от
одного и того же стандартного состояния,
а если это не имеет места необходимо
предварительно оценить разности между
термодинамическими потенциалами разных
стандартных состояний. Выбор состояний
в качестве стандартных диктуется разными
причинами наличием термодинамических
данных, удобством и простотой решения
задачи при определенном выборе
стандартного состояния.
, то двухфазное состояние чистых
компонентов более стабильно чем чистый
раствор и раствор будет неустойчив по
отношению к макро диффузии компонентов
и начнет распадаться на чистые фазы.
Точнее на два раствора один с концентрацией
компонентов меньшей средней концентрации
С компонента
В в системе, а второй с концентрацией
большей С.
Это связано с тем , что потенциал Гиббса
двухфазной механической смеси двух
однородных растворов оказывается меньше
потенциала Гиббса для двухфазного,
стандартного состояния. Самой стабильной
является то состояние системы для,
которого термодинамический потенциал
при данных T,P,C
имеет наименьшее значение. Таким образом
возможные, виртуальные состояния
системы однофазные двухфазные, трехфазные
"конкурируют" друг с другом за
право воплощения в реальности.
Реализоваться могут не только состояния
с наименьшим термодинамическим
потенциалом Гиббса. Реализуются и
состояния с более высоким значением
потенциала Какие из них реализуются,
определяется пред историей состояний
системы. О таких состояниях говорят,
как о метастабильных состояниях. Эти
состояния устойчивы относительно малых
возмущений в системе, но большие
возмущения приведут к переходу в
состояние с наименьшим термодинамическим
потенциалом, которое называют, поэтому
стабильным состоянием. Различные
термодинамические состояния системы
определяются относительно разных
стандартных состояний. При решении
вопроса о стабильности и метастабильности
состояний системы перед сравнением
численных значений термодинамических
потенциалов друг с другом всегда нужно
убедиться, что они отсчитываются от
одного и того же стандартного состояния,
а если это не имеет места необходимо
предварительно оценить разности между
термодинамическими потенциалами разных
стандартных состояний. Выбор состояний
в качестве стандартных диктуется разными
причинами наличием термодинамических
данных, удобством и простотой решения
задачи при определенном выборе
стандартного состояния.
В приближении
регулярных растворов, объем смешения
![]() и энергия смешения Гиббса в этом случае
равна свободной энергии смешения
Гельмгольца.
и энергия смешения Гиббса в этом случае
равна свободной энергии смешения
Гельмгольца.
Пусть бинарная система может находиться в двух агрегатных состояниях жидком и твердом, а в твердом состоянии кристаллическая структура твердого раствора неизменна во всем интервале концентрации. Таким образом, кристаллические структуры компонентов А и В совпадают. В такой системе А-В возможны следующие однофазные и двухфазные состояния:
-
Чистый жидкий компонент А;
-
Чистый твердый компонент А;
-
Чистый жидкий компонент В;
-
Чистый твердый компонент В;
-
Однородный жидкий раствор с концентрацией СВ=
 ;
; -
Однородный твердый раствор с концентрацией СВ=
 ;
; -
Состояние двухфазного равновесия двух однородных жидких растворов отличающихся друг от друга концентрацией компонентов
-
Состояние двухфазного равновесия двух однородных твердых растворов отличающихся друг от друга концентрацией компонентов
-
Состояние двухфазного равновесия однородного жидкого раствора и твердого раствора, отличающихся друг от друга концентрацией компонентов и агрегатным состоянием.
При заданных
значениях температуры T,
давлении
P,
![]() средней концентраций компонента В
система будет находится в одном из
перечисленных выше состояний, а именно
в том для которого термодинамический
потенциал Гиббса будет иметь наименьшее
значение. Однофазные состояния жидкого
и твердого раствора описываются
термодинамическими потенциалами вида
(1). Для состояния, описывающего двухфазное
равновесие системы состоянии
термодинамический потенциал Гиббса
равен
средней концентраций компонента В
система будет находится в одном из
перечисленных выше состояний, а именно
в том для которого термодинамический
потенциал Гиббса будет иметь наименьшее
значение. Однофазные состояния жидкого
и твердого раствора описываются
термодинамическими потенциалами вида
(1). Для состояния, описывающего двухфазное
равновесие системы состоянии
термодинамический потенциал Гиббса
равен
![]() ,
(3)
,
(3)
где
![]() - доли фаз ,
соответственно. =n/n
- доли фаз ,
соответственно. =n/n
Между величинами и существует очевидная связь
+=1 (4)
Величина Сn равна числу молей компонента В в фазе , а
Доли фаз определяются
по правилу рычага
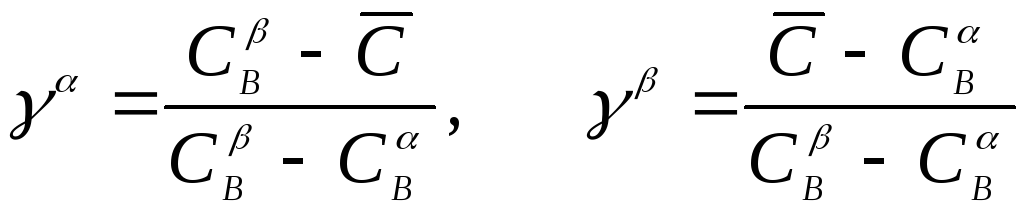 .
(3)
.
(3)
В приближении регулярных твердых растворов потенциалы Гиббса , находящихся в равновесии фаз равны
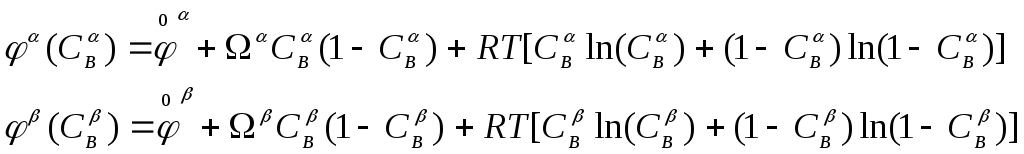 (4)
(4)
Подставляя (4) в выражение (2) для стандартного состоянии системы , состоящей из двух фаз получим
![]() (5)
(5)
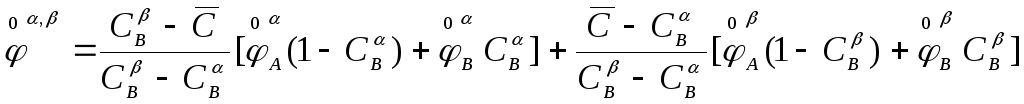 (6)
(6)
где
![]() -мольные потенциалы чистых компонентов
А и В , соответственно , находящихся в
жидком или твердом состоянии , в
соответствии с тем являются фазы
и
жидкими или твердыми.
-мольные потенциалы чистых компонентов
А и В , соответственно , находящихся в
жидком или твердом состоянии , в
соответствии с тем являются фазы
и
жидкими или твердыми.
Пусть фазы
и
обе находятся в одном и том же агрегатном
состоянии либо обе фазы жидкие, либо
обе одновременно твердые. Тогда
![]() ,так
как относятся к одному и тому же состоянию
чистого компонента при заданной
температуре и давлении.
,так
как относятся к одному и тому же состоянию
чистого компонента при заданной
температуре и давлении.
С учетом этого обстоятельство из выражения (6) получим
 или
,с учетом равенства
или
,с учетом равенства
![]() ,которое
следует из сохранения числа частиц в
системе при фазовых превращениях,
окончательно получим
,которое
следует из сохранения числа частиц в
системе при фазовых превращениях,
окончательно получим
![]() (7)
(7)
Сравнивая выражение (7) и с выражением (2) приходим к выводу, что стандартное состояние однородного твердого раствора и стандартное состояния для двух фазного состояния системы совпадают, если обе фазы находятся в одном и том же агрегатном состоянии. Таким образом, для термодинамический потенциал Гиббса для однородного раствора и термодинамического потенциал Гиббса для двухфазного состояния за начало отсчета принято одно и тоже начальное состояние, если все рассматриваемые фазы находятся в одном и том же агрегатном состоянии.
Пусть фаза
находится в жидком состоянии, а фаза
в твердом состоянии. Для определенности
примем так же, что фаза
образуется на основе компонента А, а
фаза
на основе компонента В. Таким образом,
температура плавления компонента А
![]() меньше температуры плавления компонента
В
меньше температуры плавления компонента
В
![]()
Стандартное
состояние для системы , в которой в
равновесии находятся однородный жидкий
раствор (фаза )
и однородный твердый раствор (фаза )
не совпадает со стандартными состояниями
системы рассматриваемыми раньше.
Поскольку
![]() -
это мольный потенциал Гиббса чистого
компонента А, находящегося в жидком
состоянии при температуре
-
это мольный потенциал Гиббса чистого
компонента А, находящегося в жидком
состоянии при температуре
![]() и давлении Р,
а
и давлении Р,
а
![]() - это термодинамический потенциал Гиббса
чистого компонента А в твердом состоянии,
при той же температуре и давлении, то
- это термодинамический потенциал Гиббса
чистого компонента А в твердом состоянии,
при той же температуре и давлении, то
![]() (8)
(8)
Величина
![]() равна изменению энергии Гиббса при
плавлении чистого компонента А при
температуре Т,
которая в общем случае отличается от
температуры
равна изменению энергии Гиббса при
плавлении чистого компонента А при
температуре Т,
которая в общем случае отличается от
температуры
![]() .
.
Для компонента В
![]() это мольный потенциал Гиббса чистого
компонента А, находящегося в жидком
состоянии при температуре
это мольный потенциал Гиббса чистого
компонента А, находящегося в жидком
состоянии при температуре
![]() (
в общем случае отличающейся от температуры
плавления) и давлении Р,
а
(
в общем случае отличающейся от температуры
плавления) и давлении Р,
а
![]() - это термодинамический потенциал Гиббса
чистого компонента В в твердом состоянии,
при той же температуре и давлении, то
- это термодинамический потенциал Гиббса
чистого компонента В в твердом состоянии,
при той же температуре и давлении, то
![]() (8)
(8)
Величина
![]() равна изменению энергии Гиббса при
плавлении чистого компонента А при
температуре Т,
которая в общем случае отличается от
температуры
равна изменению энергии Гиббса при
плавлении чистого компонента А при
температуре Т,
которая в общем случае отличается от
температуры
![]() .
.
Для того чтобы сравнивать значения термодинамических потенциалов состояний системы, перечисленных в пунктах (1-9) стандартное состояние необходимо для всех состояний выбрать единым образом.
Примем за стандартное состояние системы примем величину, определяемую следующим равенством
![]() (9)
(9)
где потенциалы
Гиббса
![]() для
одного моля чистого компонента А и В в
твердом состоянии, взяты при
температуре Т=ТАпл.
и давлении Р
=0
для
одного моля чистого компонента А и В в
твердом состоянии, взяты при
температуре Т=ТАпл.
и давлении Р
=0
Изменение энтальпии чистого компонента A при изменении температуры равно ,(10)
