
2013.Термодинамика / Диаграммы состояния
.docДиаграммы состояния бинарных систем
Мы рассмотрим некоторые особые случаи когда из диашрам состояния мложно получить термодинамические данные.
Теперь мы рассмотрим равновесие фаз с более общей точки зрения. В этом случае мы не получим количественных данных, но получим качественные выводы.
Исследуем общую форму кривой свободной энергии – состав.
Свободная энергия смешения при каком-либо
данном составе будет выражаться
уравнением
![]()
Дифференцируем по XB
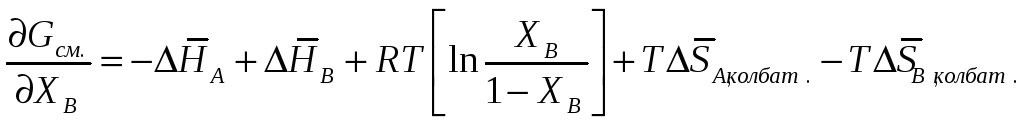
Мы рассмотрим очень разбавленный раствор
компонентов B в A.
Поэтому можно положить, что
![]() и
и
![]() равны нулю.
равны нулю.
![]() .
.
Таким образом,
![]()
В очень разбавленном растворе
![]() и
и
![]() не зависят от состава в области
разбавленного раствора (Каждый атом В
изолирован и помещен в чистый компонент).
не зависят от состава в области
разбавленного раствора (Каждый атом В
изолирован и помещен в чистый компонент).
Значение
![]() зависит от состава только через
зависит от состава только через
![]() и при достаточно малом значении
и при достаточно малом значении
![]() отрицательной величиной независимо от
знака
отрицательной величиной независимо от
знака
![]() и
и
![]() .
.
![]()
Таким образом, растворение в кристалле вещества всегда приводит к уменьшению свободной энергии Гиббса. Следовательно, чистая фаза всегда термодинамически неустойчива.
Этот вывод важен для процесса изготовления сверхчистых материалов. Из него следует, что чистый материал всегда будет стремиться к загрязнению за счет поглощения примесей из окружающей среды. Если чистый материал в тигле , то материал тигля имеет тенденцию растворяться в материале.
Зависимость свободная энергия состав, когда компоненты А и В имеют одинаковую кристаллическую структуру.
В этом случае теоретически возможно образование непрерывного ряда твердых растворов. Если А и В имеют различные кристаллические структуры непрерывный ряд твердых растворов невозможен.
Известно, что ![]() при данной температуре. Но если
при данной температуре. Но если
![]() ,
,
![]() ,
как функция XB,
отрицательна при всех составах. .
Но если
,
как функция XB,
отрицательна при всех составах. .
Но если
![]() ,
положение осложняется. Форма кривой
свободная энергия – состав может сильно
изменяться с температурой. При высоких
температурах вклад
,
положение осложняется. Форма кривой
свободная энергия – состав может сильно
изменяться с температурой. При высоких
температурах вклад
![]() будет иметь большее значение, чем при
низких температурах.
будет иметь большее значение, чем при
низких температурах.
При очень высоких температурах кривая
![]() будет вогнутой при всех составах.
будет вогнутой при всех составах.
Однако, при низких температурах
![]() начнет преобладать в выражении для
начнет преобладать в выражении для
![]() ,
и кривая
,
и кривая
![]() будет иметь тенденцию стать положительной.
В близи концов бинарной системы
будет иметь тенденцию стать положительной.
В близи концов бинарной системы
![]() свободная энергия отрицательна. При
XB=0 и
1
свободная энергия отрицательна. При
XB=0 и
1
![]() Так ч
Так ч то
по кривая будет иметь вид.
то
по кривая будет иметь вид.
Если раствор регулярный, то минимумы симметричны относительно XB=0,5. Для составов а и с раствор более устойчив относительно чистых компонентов. Необходимо рассмотреть еще возможность распада на два однородных твердых раствора.
П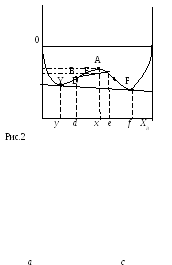 редположим,
что раствор с концентрацией x
распадается на два раствора c
концентрацией d и e.
Свободная энергия этой механической
смеси растворов будет равна сумме
свободных энергий этих растворов.
Свободная энергия раствора состава d
равна
редположим,
что раствор с концентрацией x
распадается на два раствора c
концентрацией d и e.
Свободная энергия этой механической
смеси растворов будет равна сумме
свободных энергий этих растворов.
Свободная энергия раствора состава d
равна
![]() ,
а свободная энергия раствора состава
e равна
,
а свободная энергия раствора состава
e равна
![]()
![]() Положение точки B
ниже точки А (исходного значения
энергии однородного раствора состава
x).
Положение точки B
ниже точки А (исходного значения
энергии однородного раствора состава
x).
![]() - можно еще понизить за счет обогащение
раствора e компонентом
B и раствора состава d
компонентом А. Этот процесс можно
продолжать до точек Y и F
, которые имеют общую касательную к
кривой
- можно еще понизить за счет обогащение
раствора e компонентом
B и раствора состава d
компонентом А. Этот процесс можно
продолжать до точек Y и F
, которые имеют общую касательную к
кривой
![]() .
.
При концентрации растворов y
и f компоненты будут
иметь в растворах одинаковые химические
потенциалы и дальнейшее снижение
свободной энергии Гиббса за счет распада
станет невозможным. Следует отметить,
что растворы состава y,f
не обязательно совпадают с минимумами
кривой
![]() .Свободные
энергии E,F
могут значительно отличаться от
минимальных значений. Поскольку критерием
равновесия фаз является равенство
химических потенциалов, а не минимальные
значения свободных энергий отдельных
фаз.
.Свободные
энергии E,F
могут значительно отличаться от
минимальных значений. Поскольку критерием
равновесия фаз является равенство
химических потенциалов, а не минимальные
значения свободных энергий отдельных
фаз.
Однородные растворы слева и справа от точек y,z устойчивы, а между этими точками не устойчивы относительно распада на два раствора.
Рассмотренная кривая свободной энергии
связана с пределом несмешиваемости на
диаграмме состояния. При более высоких
температурах минимумы сближаются по
составу и полностью исчезают при
критической температуре Tкр..
Тип диаграммы состояния относящийся к
рассмотренной на рисунке зависимости
![]() .
имеет вид.
.
имеет вид.
М ежду
точками y и z
существуют две точки перегиба. Их также
наносят на диаграмму состояния. Полученная
таким способом кривая называется
спинодалью. Она играет важную роль
в кинетике распада фаз.
ежду
точками y и z
существуют две точки перегиба. Их также
наносят на диаграмму состояния. Полученная
таким способом кривая называется
спинодалью. Она играет важную роль
в кинетике распада фаз.
Рассмотрим активность компонентов A
и B, характерную для данного
типа кривой
![]() .
.
Возьмем в качестве примера компонент
B. Находим разность
химических потенциалов для любого
состава. Для этого для заданного состава
XB
проводим касательную к кривой
![]() до пересечения ее с линией XB=1.
Длина отрезка [0,точка пересечения] равна
разности химических потенциалов.
Значение активности aB
получаем из выражения
до пересечения ее с линией XB=1.
Длина отрезка [0,точка пересечения] равна
разности химических потенциалов.
Значение активности aB
получаем из выражения
![]()

При составе y и z
компонент B будет
иметь одинаковую активность в соответствии
с требованиями равновесия . Максимумы
и минимумы aB
соответствуют спинодальным точкам
зависимости
![]() .
Площади заштрихованных двух частей
должна быть равны (рис.4).
.
Площади заштрихованных двух частей
должна быть равны (рис.4).
