
2013.Термодинамика / 9. Лекц
.docРасчет энтропии
Согласно третьего закона термодинамики
при T=0К. Энтропия системы
может быть рассчитана из теплоемкости
![]() Абсолютные энтропии некоторых веществ
приводятся в таблицах
Абсолютные энтропии некоторых веществ
приводятся в таблицах
Для иллюстрации третьего закона рассчитаем энтропию реакции
1) 2Al(тв,298К)+3/2O2(г,298К,1атм)=Al2O3(тв,298К)
![]()
2) 2Al(тв,298К)
=2Al(тв,0К) ![]()
3) 3/2O2(г,298К,1атм) =
3/2O2(г,0К,1атм) 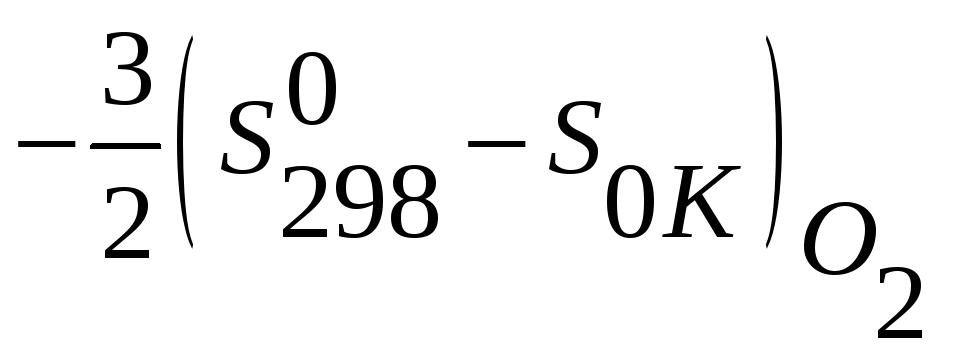
4) Al2O3(тв,0К)
= Al2O3(тв,298К)

Поскольку для всех веществ
![]() ,то
,то

![]()
Если нас интересует та же реакция при 1000К, то повторяются все те де операции, используя данные CP. Однако необходимо будет учесть плавление Al при 933К.
Значение энтропии можно получить из наклона потенциала Гиббса.
![]()
Существует три метода получения значений
энтропии системы:
а) Использование
третьего термодинамики;
б) Прямое
определение
![]() ,
как функции температуры;
,
как функции температуры;
в) Вычисление методами статистической механики.
Эмпирические правила


При отсутствии данных о теплоемкости
можно при высоких температурах
использовать
![]()
![]()
Для оценки теплоемкости соединений и
растворов в твердом и жидком состоянии,
при отсутствии данных, можно применять
приближенное правило Неймана – Копа.
В этом случае рассматривается величина
![]() для реакции соединения
для реакции соединения
xAТВ+yBтв=AxBy,тв – реакция образования.
Правило Неймана-Коппа
![]()
Теплоемкость 1г-атома твердой фазы можно рассматривать, как средне взвешанную сумму теплоемкостей, образующих эту фазу элементов.
Фазовые превращения и их классификация
Для любого фазового превращении
свободная энергия Гиббса является
непрерывной функцией
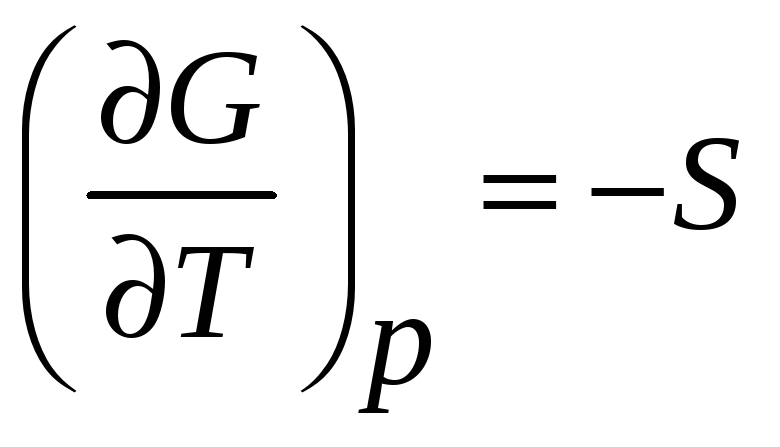 ,
,
![]() ,
,
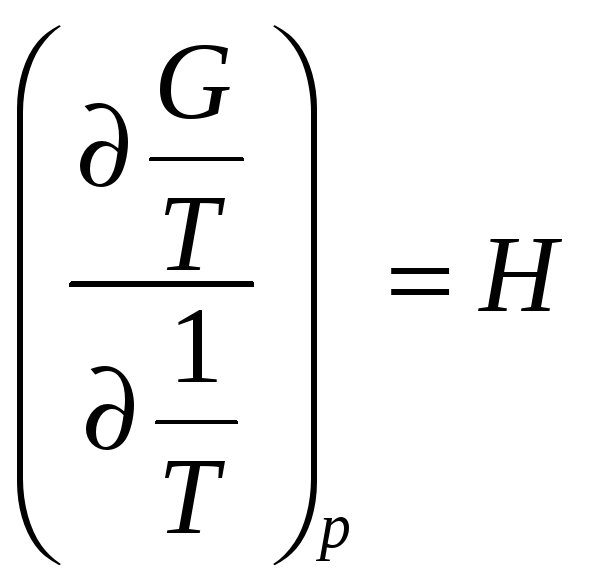
Если переход характеризуется разрывом в первых производных термодинамического потенциала, то, по предложению Эренфеста, его называют переходом первого рода.
Переходами первого рода являются переходы с изменением агрегатного состояния плавление испарения и д.р.
Вторые производные
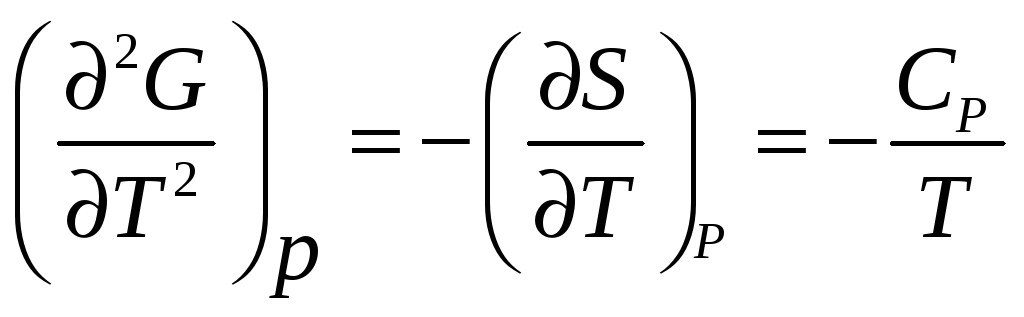 ,
,
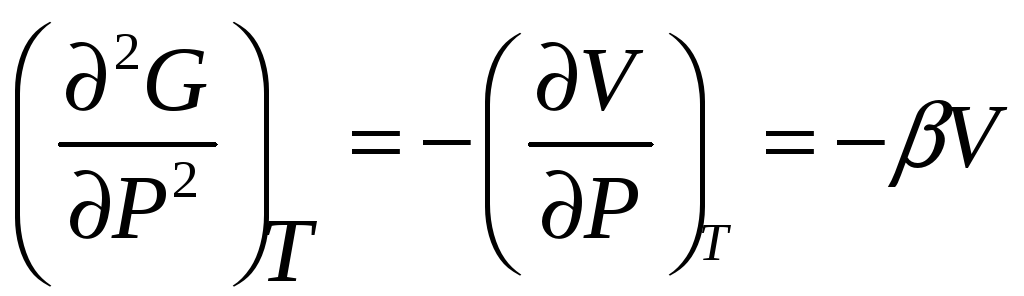 ,
,
![]() Если переход характеризуется разрывом
второй производной, то он называется
переходом второго рода.
Если переход характеризуется разрывом
второй производной, то он называется
переходом второго рода.
Влияние внешнего давления на температуру фазового перехода
Влияние внешнего давления на температуру фазового перехода определяется уравнение Клайперона.
Если фазы две фазы находятся в равновесии,
то термодинамические потенциалы Гиббса
равны друг другу, т.е. химической реакции
![]()
![]() .
.
![]()
Записав изменение потенциала Гиббса
для фаз
![]() и
и
![]() и вычитая одно из другого получим
и вычитая одно из другого получим
![]() ,
,
![]() .
Уравнение Клайперона связывает изменение
температуры с изменением внешнего
давления для равновесного двухфазного
состояния или по другому можно сказать
определяет наклон линии двухфазного
равновесия на фазовой диаграмме.
.
Уравнение Клайперона связывает изменение
температуры с изменением внешнего
давления для равновесного двухфазного
состояния или по другому можно сказать
определяет наклон линии двухфазного
равновесия на фазовой диаграмме.
Давление пара над твердым веществом

Из-за зависимости теплоемкости твердого
вещества от температуры
![]() .
Из за этой зависимости оказалось, что
для расчетов удобно выражать
.
Из за этой зависимости оказалось, что
для расчетов удобно выражать
![]() следующим
образом
следующим
образом
![]() .
Значения этих коэффициентов можно найти
в справочниках.
.
Значения этих коэффициентов можно найти
в справочниках.
Стандартная свободная энергия Гиббса реакций
 Значок
Значок относится
ко всем компонентам реакции при данной
температуре и давлении в 1атмосферу.
Для обычных реакций
относится
ко всем компонентам реакции при данной
температуре и давлении в 1атмосферу.
Для обычных реакций
 выражается,
как функция температуры и представлена
в удобных таблицах. Однако часто
приходится рассчитывать
выражается,
как функция температуры и представлена
в удобных таблицах. Однако часто
приходится рассчитывать
 самому.
самому.
Отметим, что знак
![]() для данной реакции может характеризовать
только направление самопроизвольного
протекания процесса, если все вещества
находятся в стандартном состоянии, а
величина
для данной реакции может характеризовать
только направление самопроизвольного
протекания процесса, если все вещества
находятся в стандартном состоянии, а
величина
![]() необходима для расчета константы
равновесия реакции.
необходима для расчета константы
равновесия реакции.
Величину
![]() аппроксимируют формулой
аппроксимируют формулой
![]() .
Коэффициенты, входящие в это выражение,
приводят в справочниках.
.
Коэффициенты, входящие в это выражение,
приводят в справочниках.
Рассмотрим изотермическую реакцию
между твердыми фазами в их стандартном
состоянии с изменением свободной энергии
Гиббса
![]()
aA(тв)+bB(тв)=
cC(тв)+dD(тв)
![]()
Каждый из этих компонентов находится в равновесии со своими парами при данном парциальном давлении.
Эту реакцию можно записать, как реакцию
газообразных компонентов при равновесном
давлении
![]()
1) aA(тв)+bB(тв)=
cC(тв)+dD(тв)
![]()
2) aA(г,
![]() )=aA(тв)
)=aA(тв)
![]()
3) bB(г,
![]() )=bB(тв)
)=bB(тв)
![]()
4) cC(г,)=cC(тв)
![]()
4) dD(г,
![]() )=dD(тв)
)=dD(тв)
![]()
----------------------------------------------------------
6) aA(г,
![]() )+
bB(г,
)+
bB(г,
![]() )=
cC(г,
)=
cC(г,
![]() )+
dD(г,
)+
dD(г,
![]() )
)
![]()
Изменение энергии Гиббса, связанные с
реакциями (2-5), равны нулю, потому что
давления![]() ,
,![]() ,
,![]() и
и
![]() выбраны
таким образом, чтобы они являлись
равновесными для чистых компонентов.
В результате реакция между газообразными
компонентами, находящимися в равновесии
с твердым веществом равна стандартной
свободной энергии.
выбраны
таким образом, чтобы они являлись
равновесными для чистых компонентов.
В результате реакция между газообразными
компонентами, находящимися в равновесии
с твердым веществом равна стандартной
свободной энергии.
Однако, если бы один из компонентов был
устойчив в газообразном состоянии при
температуре, то тогда, чтобы
![]() была равна
была равна
![]() этот компонент должен находиться при
давлении 1атм.
этот компонент должен находиться при
давлении 1атм.
Теперь изменим
![]() ,
,![]() ,
,![]() ,
,![]() на
новые
на
новые![]() ,
,![]() ,
,![]() ,
,![]() .
Эти величины выбраны так, чтобы реакция
находилась в равновесии.
.
Эти величины выбраны так, чтобы реакция
находилась в равновесии.
7) aA(г,
![]() )+
bB(г,
)+
bB(г,
![]() )=
cC(г,
)=
cC(г,
![]() )+
dD(г,
)+
dD(г,
![]() )
)
![]() .
.
Чтобы рассчитать изменение свободной
энергии за счет изменения давления
воспользуемся
![]()
Пусть T=const,
а газ будем считать идеальным. Термическое
уравнение состояния идеального газа
PV=RT.
dT=0.
![]()
![]() После интегрирования
После интегрирования
![]()
8) aA(г,
![]() )=
aA(г,
)=
aA(г,
![]() )
)
![]()
9) bB(г,
![]() )=
bB(г,
)=
bB(г,
![]() )
)
![]()
10) cC(г,
![]() )=
cC(г,
)=
cC(г,
![]() )
)
![]()
11) dD(г,
![]() )=
dD(г,
)=
dD(г,
![]() )
)
![]()
---------------------------------------------------------------------
aA(г,
![]() )+
bB(г,
)+
bB(г,
![]() )=
cC(г,
)=
cC(г,
![]() )+
dD(г,
)+
dD(г,
![]() )
)
![]()

Константа равновесия для реакции 1).
![]()
Величина
![]() характеризует активность компонента
i. В случае
неидеальных паров
характеризует активность компонента
i. В случае
неидеальных паров

![]() -постоянная величина для заданной
температуры. Это давление пара над
чистым компонентом.
-постоянная величина для заданной
температуры. Это давление пара над
чистым компонентом.
В общем случае изменение энергии Гиббса
![]() и после интегрирования
и после интегрирования
 - это уравнение является основным
термодинамическим уравнением
- это уравнение является основным
термодинамическим уравнением
Для чистого стабильного вещества активность равна единице.
Для растворов иногда удобно менять
стандартное состояние. При этом изменится
и уравнение по которому будет вычисляться
![]() .
.
Рассмотрим изменение свободной энергии Гиббса (не стандартной) для рассмотренной ранее реакции, в которой компоненты имеют некоторую произвольную активность.
1) aA(aA)+bB(aB)=
cC(aC)+dD(aD)
![]() /
/
Чтобы выполнить такой расчет, необходимо начать с реакции, в которой все компоненты находятся в стандартных состояниях, а свободная энергия рассчитывается для каждой ступени из уравнения.

2) aA(aA=1)+bB(aB=1)=
cC(aC=1)+dD(aD=1)
![]()
3) aA(aA)=
aA(aA=1)

4) bB(aB)=
bB(aB=1)

5) cC(aC)=
cC(aC=1)
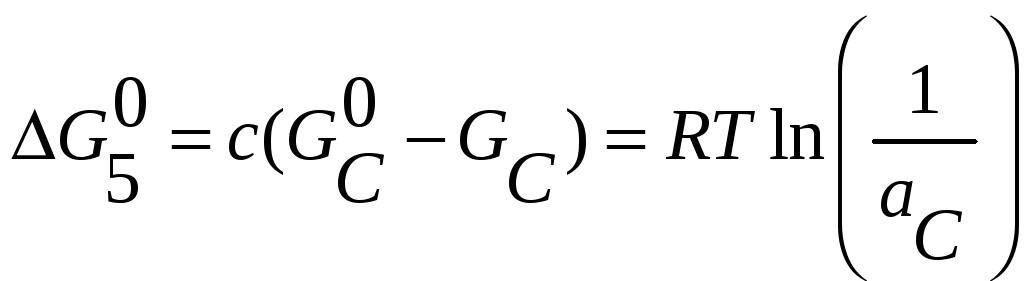
6) dD(aD)=
dD(aD=1)

________________________________
1) aA(aA)+bB(aB)= cC(aC)+dD(aD)
Суммируя (2-6) для реакции (1) получим
![]()
Пример стр90.
