
- •Физическая и коллоидная химия лабораторный Практикум
- •Рецензент:
- •Содержание
- •Введение
- •Лабораторная работа №1 Определение молярной массы неэлектролита криоскопическим методом
- •Вопросы для самоконтроля
- •Лабораторная работа №2 Измерение электропроводности электролитов
- •Вопросы для самоконтроля
- •Лабораторная работа №3 Определение вязкости растворов
- •Типа впж-2
- •Вопросы для самоконтроля
- •Лабораторная работа №4 Определение константы скорости гидролиза сахарозы
- •Вопросы для самоконтроля
- •Лабораторная работа № 5 Изучение микрогетерогенных систем
- •Вопросы для самоконтроля
- •Лабораторная работа № 6 Седиментационный анализ суспензий и порошков
- •Вопросы для самоконтроля
- •Лабораторная работа № 7 Измерение поверхностного натяжения водных растворов пав
- •Вопросы для самоконтроля
- •Лабораторная работа №8 Изучение процесса адсорбции на твердом сорбенте
- •Лабораторная работа № 9 Получение коллоидных растворов
- •Вопросы для самоконтроля
- •Лабораторная работа №10 Изучение электролитной коагуляции
- •Вопросы для самоконтроля
- •Лабораторная работа №11 Электрофорез. Измерение величины дзета-потенциала
- •Вопросы для самоконтроля
- •Лабораторная работа №12 Образование и разрушение растворов высокомолекулярных веществ
- •Вопросы для самоконтроля
- •Лабораторная работа № 13 Измерение стационарных потенциалов металлов. Измерение токов коррозии
- •Вопросы для самоконтроля
- •Лабораторная работа № 14 Потенциометрическое титрование и определение рН
- •Вопросы для самоконтроля
- •Лабораторная работа №15 Фотоколориметрическое определение концентраций растворов
- •Вопросы для самоконтроля
- •Лабораторная работа № 16 Кондуктометрическое титрование
- •Вопросы для самоконтроля
- •Лабораторная работа № 17 Фотонефелометрия
- •Вопросы для самоконтроля
- •Лабораторная работа №18 Определение размеров частиц золя турбидиметрическим методом
- •Вопросы для самоконтроля
- •Лабораторная работа № 19 Определения нитратов в растительной продукции и кислотности пищевых объектов потенциометрическим методом
- •7. Определение нитратов в растительной продукции
- •Вопросы для самоконтроля
- •Лабораторная работа № 20 Фотоколометрическое определение содержания лактозы в молоке и растворимых белков в мясе
- •Рекомендуемая литература для подготовки
- •Рекомендации по оформлению отчетов о лабораторных работах Оценка точности измерения физико-химических величин
- •1. Обработка результатов прямых измерений
- •2. Обработка результатов косвенных измерений
- •3. Вычисления без точного учета погрешностей
- •Правила составления таблиц и построения графиков
- •Словарь
- •Приложения
- •Основные свойства логарифмов
- •Отыскание логарифма по числу
- •Физическая и коллоидная химия лабораторный Практикум Чураков Владимир Григорьевич
- •426069, Г. Ижевск, ул. Студенческая, 11.
Вопросы для самоконтроля
Каково значение потенциометрического титрования? Приведите примеры использования потенциометрического титрования.
Как осуществляется потенциометрическое титрование?
Что называется точкой эквивалентности? Что называют кривой титрования?
Как определить точку эквивалентности при потенциометрическом титровании?
Как рассчитать концентрацию кислоты (соляной, уксусной) в растворе при потенциометрическом титровании?
Какие электроды используются при потенциометрическом титровании?
Пояснить принцип работы электродов.
Почему буферные растворы практически не меняют рН среды?
Могут ли концентрации водородных и гидроксильных ионов в водном растворе быть равными нулю?
Как изменится рН чистой воды, если к 1 литру воды прибавить 0,001 моль КОН, считая диссоциацию последнего полной?
Лабораторная работа №15 Фотоколориметрическое определение концентраций растворов
Цель работы освоить основы фотоколориметрического метода анализа; определить концентрацию меди в растворе при помощи фотоколориметра КФК–2;
Теоретическая часть
Метод фотоколориметрического анализа основан на способности окрашенных веществ поглощать излучение определённой длины волны.
Световой поток с
интенсивностью
![]() ,
проходя через слой раствора, частично
поглощается и выходит из раствора с
меньшей интенсивностью
,
проходя через слой раствора, частично
поглощается и выходит из раствора с
меньшей интенсивностью![]() .
ВеличинаJ
зависит от толщины слоя окрашенного
раствора l
и от числа окрашенных частиц в нём, т.
е. от их концентрации С,
.
ВеличинаJ
зависит от толщины слоя окрашенного
раствора l
и от числа окрашенных частиц в нём, т.
е. от их концентрации С,
![]() .
.
По закону Бугера – Ламберта – Бера интенсивности падающего и прошедшего света связаны следующими соотношениями:
![]() (1)
(1)
где J –
интенсивность потока света, прошедшего
через раствор,
![]() – интенсивность потока света, падающего
на раствор,
– интенсивность потока света, падающего
на раствор,
![]() – коэффициент светопоглощения –
постоянная величина, зависящая от
природы растворённого вещества,C– молярная концентрация окрашенного
вещества,l– толщина
слоя раствора (толщина кюветы).
– коэффициент светопоглощения –
постоянная величина, зависящая от
природы растворённого вещества,C– молярная концентрация окрашенного
вещества,l– толщина
слоя раствора (толщина кюветы).
Закон Бугера – Ламберта – Бера является основным законом светопоглощения и лежит в основе большинства фотометрических методов анализа. После логарифмирования уравнения (1) получим:
![]() (2)
(2)
![]() (3)
(3)
Величина D является важнейшей характеристикой окрашенного раствора, её называют оптической плотностью. На фотоколориметрах чаще всего измеряют непосредственно оптическую плотность, которая прямопропорциональна концентрации раствора. Уравнения (2) и (3) выведены для монохроматического света, т. е. света определённой длины волны, который может быть выделен с помощью специального устройства – монохроматора: в случае фотоколориметра – светофильтра; в случае спектрофотометра – призмы.
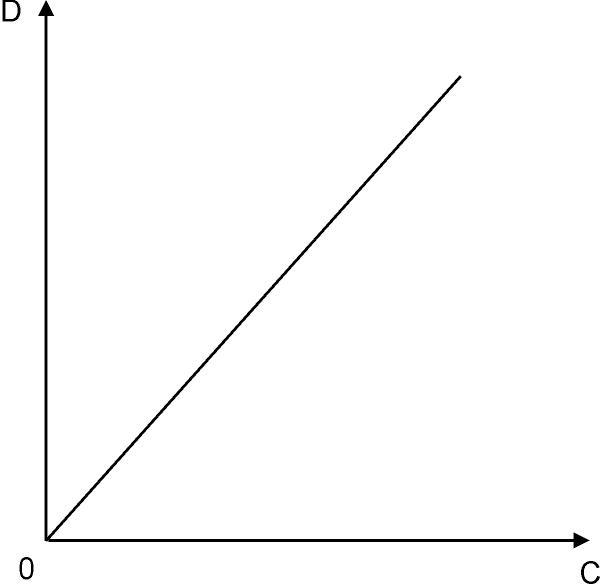
Для определения концентрации (С) окрашенного раствора измеряют его оптическую плотность (D) с помощью фотоколориметра. Кроме оптической плотности испытуемого раствора D в тех же условиях измеряют оптические плотности серии растворов этого же окрашенного вещества с известными концентрациями, по последним строят калибровочный график (рис.15.1), по которому находят концентрацию испытуемого раствора, зная его оптическую плотность.
При работе с
разбавленными окрашенными растворами
измерение их оптической плотности
желательно проводить в той области
спектра, в которой поглощение лучей
света определяемым веществом является
максимальным. Для этого один из
стандартных растворов (лучше средний
по концентрации) исследуют на всех
светофильтрах, т. е. при всех возможных
длинах волн
![]() .
И по полученной зависимости
.
И по полученной зависимости![]() выбирают светофильтр, соответствующий
или близко лежащий к
выбирают светофильтр, соответствующий
или близко лежащий к![]() (рисунок 15.2). На этом фильтре производится
вся о
(рисунок 15.2). На этом фильтре производится
вся о стальная
работа.
стальная
работа.
Рисунок
15.2 Спектр
поглощения. Зависимость
Рисунок 15.1
Зависимость
![]()
![]()
Практическая часть
Фотоколориметрическое определение ионов меди (II) в растворе
Определение
содержания
![]() в растворах представляет большой
практический интерес. Соли
в растворах представляет большой
практический интерес. Соли![]() в растворах широко применяются в сельском
хозяйстве как ядохимикаты. Кроме того,
в растворах широко применяются в сельском
хозяйстве как ядохимикаты. Кроме того,![]() входит в состав медных микроудобрений,
окислительно – восстановительных
ферментов.
входит в состав медных микроудобрений,
окислительно – восстановительных
ферментов.
Аммиачный метод фотоколориметрического определения меди основан на образовании ионом меди с аммиаком комплекса [Cu(NH3)4]2+, окрашенного в интенсивно – синий цвет.
1. Приготовление раствора сравнения для построения калибровочного графика.
20 мл разбавленного (1:3) гидроксида аммония NH4OH перенести в мерную колбу ёмкостью 100 мл, добавить одну каплю концентрированной серной кислоты и довести дистиллированной воды до метки (нулевой раствор или раствор сравнения).
2. Приготовление стандартных растворов для построения калибровочного графика.
3,927 г химически
чистого медного купороса
![]() перенести в мерную колбу ёмкостью 1000
мл, растворить, прилить 5 мл концентрированной
серной кислоты и довести до метки. В 1
мл этого раствора содержится 1 мг ионаCu2+.
перенести в мерную колбу ёмкостью 1000
мл, растворить, прилить 5 мл концентрированной
серной кислоты и довести до метки. В 1
мл этого раствора содержится 1 мг ионаCu2+.
В шесть мерных колб ёмкостью 100 мл отмерьте пипетками соответственно 12,5; 10; 7,5; 5; 3,5 и 1,5 мл исходного стандартного раствора соли меди. В каждую из колб прибавьте по 10 мл разбавленного (1:3) гидроксида аммония NH4OH и доведите объёмы жидкостей в колбах до метки дистиллированной водой.
3. Выбор светофильтра.
Наличие в
фотоколориметре набора светофильтров
позволяет подобрать такой светофильтр,
при котором погрешность в определении
концентрации будет наименьшей. Из
приготовленных стандартных растворов
возьмите раствор средней концентрации,
залейте его в кювету и определите
оптическую плотность его для всех
светофильтров. По полученным данным
постройте кривую D
= f
(![]() )
(рисунок 15.2). Все остальные измерения
проводите на том светофильтре, которому
соответствует максимальная оптическая
плотность (
)
(рисунок 15.2). Все остальные измерения
проводите на том светофильтре, которому
соответствует максимальная оптическая
плотность (![]() ).
).
Измерение оптической плотности на фотоколориметре КФК – 2 производите в следующей последовательности:
в световой поток поместите кювету с раствором сравнения;
закройте крышку кюветного отделения;
ручками «Чувствительность» и «Установка 100 грубо и точно» установите отсчёт 100 по шкале колориметра;
затем кювету с раствором сравнения замените кюветой с исследуемым раствором;
проведите отсчёт по нижней шкале фотоколориметра в единицах оптической плотности;
измерение проведите 3…4 раза и окончательное значение измеренной величины определите как среднее арифметическое из полученных значений.
Результаты измерений оптической плотности при всех длинах волн для раствора средней концентрации занесите в таблицу 15.1.
Таблица
15.1
Данные
зависимости D
от
![]() для стандартного раствора средней
концентрации.
для стандартного раствора средней
концентрации.
|
(нм) |
364 |
400 |
440 |
490 |
540 |
590 |
670 |
750 |
870 |
|
D |
|
|
|
|
|
|
|
|
|
На основании данных
таблицы 15.1 постройте график D
= f
(![]() )
(см. рисунок 15.2), выберите светофильтр.
)
(см. рисунок 15.2), выберите светофильтр.
4. Измерение оптической плотности стандартных растворов. Построение калибровочного графика
Измерьте оптические плотности всех стандартных растворов на выбранном светофильтре, и постройте калибровочную кривую, откладывая по горизонтальной оси известные концентрации, а по вертикальной – соответствующие им значения оптической плотности (см. рисунок 15.1). Измерения оптической плотности начните с раствора, имеющего наибольшую концентрацию меди. Результаты измерений занесите в таблицу 15.2. По полученным данным (таблица 15.2) постройте калибровочную кривую (смотри рисунок 15.1).
5. Определение количества меди в растворе неизвестной концентрации (раствор выдаётся преподавателем)
В мерную колбу на 100 мл прилейте исследуемый раствор (выдаётся преподавателем). Прибавьте в колбу 1 каплю концентрированной серной кислоты, нейтрализуйте разбавленным (1:3) гидроксидом аммония, приливая его по каплям до появления мути. Прилейте ещё 10 мл гидроксида аммония и доведите объём жидкости в колбе до метки. Раствор тщательно перемешайте, наполните им выбранную кювету и измерьте оптическую плотность. Зная величину оптической плотности, найдите по калибровочному графику концентрацию ионов Cu2+ в мг на 100 мл раствора.
Таблица 15.2 Оптические плотности стандартных растворов
|
№ раствора |
1 |
2 |
3 |
4 |
5 |
6 |
|
С, мг/100 мл |
|
|
|
|
|
|
|
С, мг/мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
