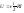- •1,2,3 Законы Ньютона.
- •31. Преобразования Галлилея.
- •32. Постулаты сто. Преобразования Лоренца.
- •33. Одновременность событий в разных системах отсчёта.
- •34. Длина тел в разных системах отсчёта.
- •36. Основной закон релятивистской динамики материальной точки.
- •38. Модель идеального газа. Изозаконы.
- •39. Основное уравнение мкт.
- •40. Явление переноса в термодинамически неравновесных системах. Теплопроводность. Диффузия. Внутреннее трение (вязкость).
- •44. Число степеней свободы молекулы.
44. Число степеней свободы молекулы.
Внутренняя энергия U – энергия (хаотического) теплового движения микрочастиц системы (молекул, атомов, электронов, ядер, и тд) и энергия взаимодействия этих частиц. Т.е. к внутренней не относится кинетическая энергия движения системы, как целого и потенциальная энергия системы во внешних полях.
Число степеней свободы – число независимых переменных (координат), полностью определяющих положение системы в пространстве. Иногда молекулу одноатомного газа рассматривают как мт, которой присваивают 3 степени свободы поступательного движения. При этом энергию вращательного движения можно не учитывать.


В
классической механике молекула
двухатомного газа – совокупность двух
мт, жёстко связанных недеформируемой
связью. Эта система кроме 3-х степеней
свободы поступательного движения имеет
дополнительно ещё 2 степени свободы
вращательного движения, т.о. i=5.![]()
![]()
Трёхатомная и многоатомная молекулы имеют 6 степеней свободы: 3 поступательных и 3 вращательных.
Независимо
от общего числа степеней свободы 3 –
обязательно поступательные, на каждую
из них приходится 1/3 значения
 в
в :
:![]()
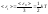
Закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы – kT, т.к. на неё кроме кинетической приходится ещё и потенциальная энергии, причём средне значение К и П энергий одинаковы, т.о.:
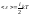
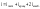
В классической теории рассматривают жёсткие связи, т.е. I совпадает с числом степеней свободы.
Т.к. в идеальном газе межатомного взаимодействия нет, то
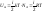 общая
формула:
общая
формула: