
- •1. Окускування дрібних матеріалів при виробництві кольорових металів. Обдавання, брикетування, агломерація: сутність процесів, їх переваги і недоліки (привести схему агломерації)
- •2. Шихтопідготовка в кольоровій металургії. Вимоги до якості шихт. Бункерний і штабельний способи приготування шихти, їх сутність і вживання (привести схеми приготування шихти)
- •3. Металургійні гази і пил, їх класифікація і характеристика. Технологічні і топкові гази, грубий і тонкий пил кольорової металургії (навести приклади)
- •8. Рафінувальні плавки в кольоровій металургії, їх види і призначення. Вогневе, лікваційне, сульфідуюче, хлорне, карбонільне, цементація рафінування (навести приклади хімічних реакцій)
- •9. Рудні плавки в кольоровій металургії. Плавка на штейн, відновна, електролітична, металотермічна, реакційна плавка (вкажіть призначення і наведіть приклади хімічних реакцій)
- •10. Обпалювання в кольоровій металургії. Кальцінуючий, окислювальний, агломеруючий, відновний, хлоруючий і фторуючий (дайте визначення і наведіть приклади хімічних реакцій)
- •Сушка в оборот
- •16. Збагачення руд кольорових металів. Завдання збагачення руд. Концентрат, проміжний продукт, хвости (дайте визначення і наведіть приклади). Способи збагачення руд
- •18. Руди і мінерали кольорових металів (дайте визначення і наведіть приклади). Класифікація руд і мінералів. Сульфідні, окислені, змішані, самородні, моно- і поліметалічні руди
- •19. Класифікація кольорових металів. Легкі, важкі, рідкісні, благородні метали. Основні властивості і сфери застосування кольорових металів
18. Руди і мінерали кольорових металів (дайте визначення і наведіть приклади). Класифікація руд і мінералів. Сульфідні, окислені, змішані, самородні, моно- і поліметалічні руди
Рудою називається гірська порода, що містить в своєму складі метал або метали в таких кількостях, які при сучасному рівні розвитку збагачувальної і металургійної техніки можуть бути економічно вигідно перероблені в товарну продукцію. Руда складається з мінералів – природних хімічних сполук. Наприклад відомо більш за 250 мідних мінералів, деякі з них: халькопірит, борніт, малахіт, куприт тощо. Мінерали підрозділяють на рудні (цінні) і порожню породу. До порожньої породи відносять мінерали, які не містять витягуванних елементів. В багатьох випадках до пустої породи відносять залізовмісні мінерали (сульфіди і оксиди), що на даний час не можна признати правильним. Найчастіше породоутворюючими елементами є кварц, карбонати, силікати та алюмосилікати.
Залежно від виду присутніх металовмісних мінералів руди кольорових металів діляться на наступні групи:
сульфідні, в яких метали знаходяться у формі сполук з сіркою - сульфидів. Прикладом таких руд можуть служити мідні, мідно-нікелеві і свинцево-цинкові руди;
окислені, в яких метали присутні у формі різних кисневмісних сполук: оксидів, карбонатів тощо. До цієї групи відносяться алюмінієві, окислені нікелеві, олов'яні руди, руди ряду рідкісних металів.
змішані, в яких метали можуть одночасно знаходитися як в сульфідній, так і в окисленій формі, а іноді в самородному стані (мідні руди);
самородні, містять метали у вільному стані. У самородному стані в природі зустрічаються золото, срібло, мідь , платина, вісмут і ртуть.
За числом присутніх металів руди класифікуються на монометалічні і поліметалічні (комплексні). Більшість руд кольорових металів є поліметалічними і містить мінімум два цінні компоненти.
19. Класифікація кольорових металів. Легкі, важкі, рідкісні, благородні метали. Основні властивості і сфери застосування кольорових металів
Згідно з промисловою класифікацією, всі метали діляться на дві групи: чорні і кольорові. Кольорові метали умовно діляться на п'ять груп:
Основні важкі метали: мідь, нікель, свинець, цинк і олово. Свою назву вони отримали із-за великих масштабів виробництва і вжитку, великої («важкої») питомої ваги в народному господарстві.
Малі важкі метали: вісмут, миш'як, сурма, кадмій, ртуть і кобальт. Вони є природними супутниками основних важких металів. Зазвичай їх отримують попутно.
Легкі метали: алюміній, магній, титан, натрій, калій, барій, кальцій і стронцій. Метали цієї групи мають найнижчу серед інших металів густину (питому масу).
Благородні метали: золото, срібло, платина і платиноїди (паладій, родій, рутеній, осмій, іридій). Ці метали володіють високою стійкістю до впливу навколишнього середовища й агресивних середовищ.
Рідкісні метали: підрозділяються на групи:
тугоплавкі метали (вольфрам, молібден, тантал, ніобій, цирконій і ванадій);
легкі рідкісні метали: літій, берилій, рубідій і цезій;
розсіяні метали: галій, індій, талій, германій, гафній, реній, селен і телур;
рідкісноземельні метали: скандій, ітрій, лантан і лантаноїди;
радіоактивні метали: радій, уран, торій, актиній і актиноїди.
Основні властивості. Деякі метали (мідь, магній, алюміній) володіють порівняно високими теплопровідністю і питомою теплоємністю, що сприяє швидкому охолодженню місця зварювання, вимагає застосування більш потужних джерел теплоти при зварюванні, а в ряді випадків попереднього підігріву деталі.
Для деяких металів (мідь, алюміній, магній) і їх сплавів спостерігається досить різке зниження механічних властивостей при нагріванні, у результаті чого в цьому інтервалі температур метал легко руйнується від ударів, або зварювальна ванна навіть провалюється під дією власної ваги (алюміній, бронза).
Всі кольорові сплави при нагріванні в значно більших обсягах, ніж чорні метали, розчиняють гази навколишньої атмосфери і хімічно взаємодіють з усіма газами, крім інертних. Особливо активні в цьому сенсі більш тугоплавкі і хімічно більш активні метали: титан, цирконій, ніобій, тантал, молібден. Цю групу металів часто виділяють у групу тугоплавких, хімічно активних металів.
Сфери застосування. У сучасній техніці обсяг застосування кольорових металів і сплавів на їх основі безперервно зростає. У зв'язку з бурхливим розвитком авіабудування, ракетної і атомної техніки, хімічної промисловості в якості конструкційних матеріалів в даний час стали застосовувати такі метали (і сплави на їх основі), як титан, цирконій, нікель, молібден і навіть ніобій, гафній та ін.
Області застосування окремих кольорових металів і сплавів на їх основі досить різноманітні.
Мідь і її сплави широко використовують в хімічному машинобудуванні, для виготовлення трубопроводів самого різного призначення, ємностей, різних судин у кріогенній техніці, в електроенергетиці і т. п.
Алюміній і його сплави застосовують для виготовлення різних ємностей в хімічній і харчовій промисловості. Сплави на основі алюмінію широко застосовують для літаків, ракет, судів, в будівництві та електроенергетиці. В зв'язку з їх порівняно високою міцністю при малій щільності, високою корозійною стійкістю в деяких агресивних середовищах і високими механічними властивостями при низьких температурах.
20. Принципова схема отримання титану з ільменітового концентрату. Наведіть хімічні реакції, що протікають на основних стадіях виробництва титану.
Ільменітовий концентрат

 Відновна
плавка
Відновна
плавка



 Чавун
Титановий шлак
Cl2
Чавун
Титановий шлак
Cl2




С поживачеві
Хлорування
поживачеві
Хлорування

Технічний Ti Cl4
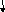
 Ректифікація
Ректифікація

Очищений Ti Cl4
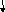



Відновлення титану


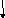
Титанова губка Mg Cl2


Дугова електроплавка Електроліз








 Злиток
титану
Хлор Магний
Злиток
титану
Хлор Магний
Рис.1. - Принципова схема отримання титану з ільменітових концентратів.
Основним матеріалом для виробництва титану є ільменітова руда. Титанові руди піддають збагаченню, в результаті якого одержують концентрати з підвищеним вмістом TiО2. При переробці ільменітових руд кількість TiО2 в концентратах досягає 60%.
Одержаний після збагачення руди електромагнітним або гравітаційним способом концентрат у суміші з деревним вугіллям, антрацитом піддають відновному плавленню в електродуговій печі з метою видалення оксидів заліза. Для цього концентрат суміші з коксом плавлять і витримують в печі при 17000С. У результаті зіткнення з вуглецевомістким і матеріалами оксиди заліза і титана відновлюються за реакцією
3(FeO·TiO2)+ 4С = 3Fe + Ti3O5 + 4CO. (1)
При цьому залізо відновлюється, навуглецьовується і утворює побічний продукт - чавун, який збирається на дні ванни печі, відділяючись від решти маси шлаку, внаслідок відмінності їх питомої ваги, а оксид титану TiO2 переходить у шлак. Чавун і шлак розливають окремо у виливниці. Основний продукт цього процесу - титановий шлак – містить 80-90 % ТiO2,2-5 % FeO і домішки - SiO2, Al2O3, СаО та ін.
Одержаний титановий шлак брикетують з коксом і піддають хлоруванню у спеціальних шахтних печах електроопору при температурі 600°С. У нижній частині печі розташовують вугільну насадку, що нагрівається при пропусканні через неї електричного струму. У піч подають брикети титанового шлаку, а через фурми всередину печі - хлор.
За наявності вугілля титан з діоксиду переходить в тетрахлорид:
TiO2 + 2Сl2 + С = TiCl4 + СО2. (2)
Тетрахлорид титану плавиться при температурі - 23°С і кипить при +136°С. Тому в умовах печі він інтенсивно випаровується і, захоплюючи за собою летючі хлориди домішок, прямує в конденсаційну установку. Наявність в установці ряду секцій з різним перепадом температур дозволяє розділити хлориди завдяки відмінності температур кипіння і таким чином виділити чотирихлористий титан, який далі піддають очищенню методом ректифікації у спеціальних установках. Найважливішу технологічну операцію - отримання металевого титану – здійснюють такими методами: розкладанням чотирихлористого титану натрієм або магнієм; відновленням двоокису і тетрахлориду титану кальцієм; електролізом хлористих і фтористих сполук титану.
Титан відновлюється за реакцією
TiCl4 + 2Mg = Ti + 2MgCl2. (3)
Для розділення продуктів реакції, що складаються з титанової губки (50-70%), залишку хлористого магнію (15-20%), що заповнює пори губки, і надлишку магнію (30-35%), користуються різницею тиску їх пари при температурі 900°С у вакуумі. Відокремлений дистиляцією магній знову використовують як відновник титану. Титанову губку дроблять і ретельно сортують. Найчистішу губку спрямовують на переплавлення; низькосортну, що містить включення, хлоридів, брикетують і використовують як розкислювач сталі у чорній металургії.
