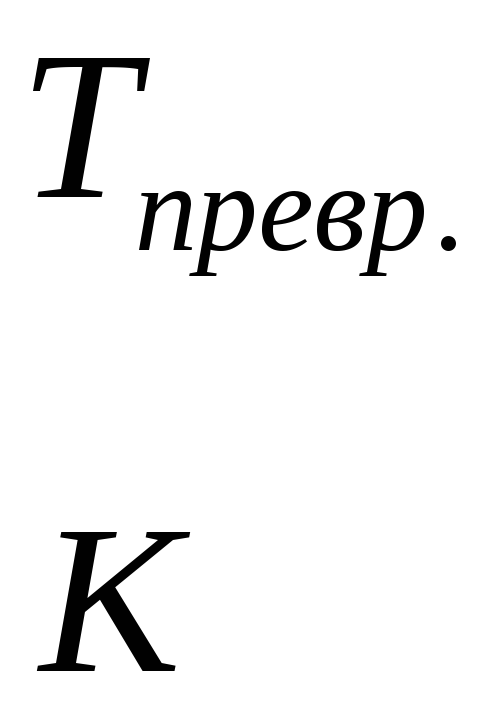19-06-2013_23-10-01 / 11 Практичне завдання
.doc
Практичне завдання
Для заданої реакції і температури:
а) обчислити константу рівноваги і розрахувати рівноважні концентрації;
б) вибрати склад відновної газової фази.
Для вирішення практичного завдання скористаємося методом ентропії розрахунку константи рівноваги хімічних реакцій.
Для розрахунку хімічних реакцій використовують поняття про хімічний потенціал:
![]() (1)
(1)
Ентропійний
метод розрахунку
![]() заснований на наступному:
заснований на наступному:
![]()
![]()
![]()
Зміну ентальпії та ентропії реакції обчислюємо за формулами:
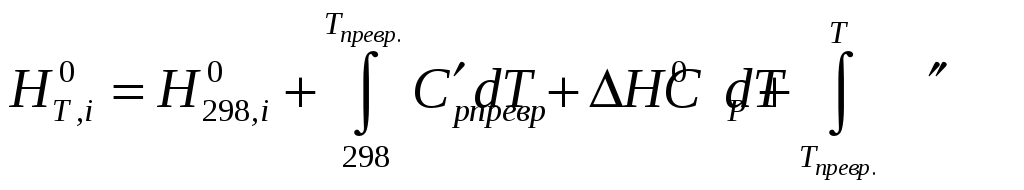
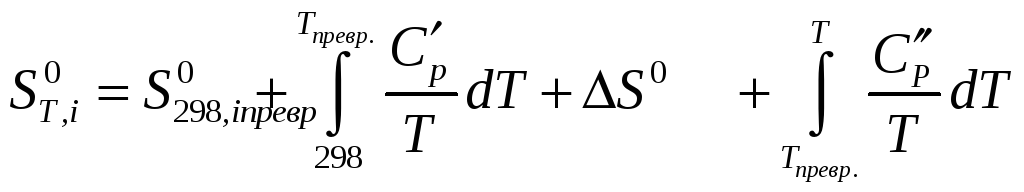
Приведені рівняння показують, як може змінюватися внутрішня енергія і ентропія довільної речовини при зміні її температури. У реакції беруть участь різні речовини і для кожної з них, залежно від наявності або відсутності модифікаційних і агрегатних перетворень, залежність внутрішньої енергії або ентропії від температури може виражатися різними рівняннями. Наприклад, якщо яка-небудь речовина не зазнає жодних змін в інтервалі температур від 298 до Т, то для такої речовини:
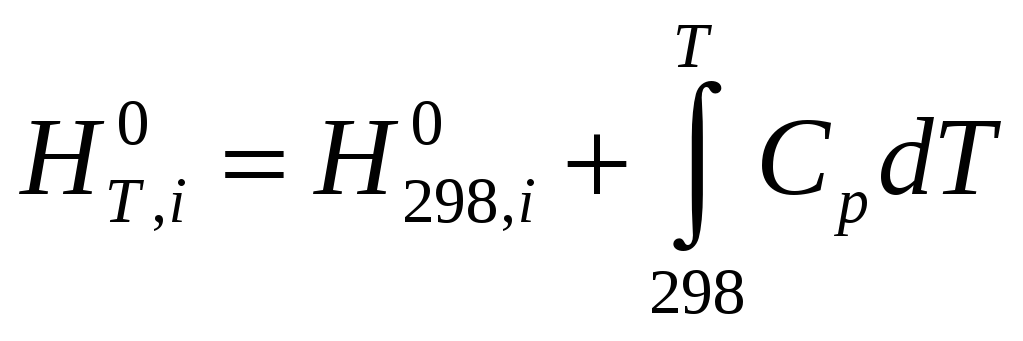 відповідно
відповідно ![]()
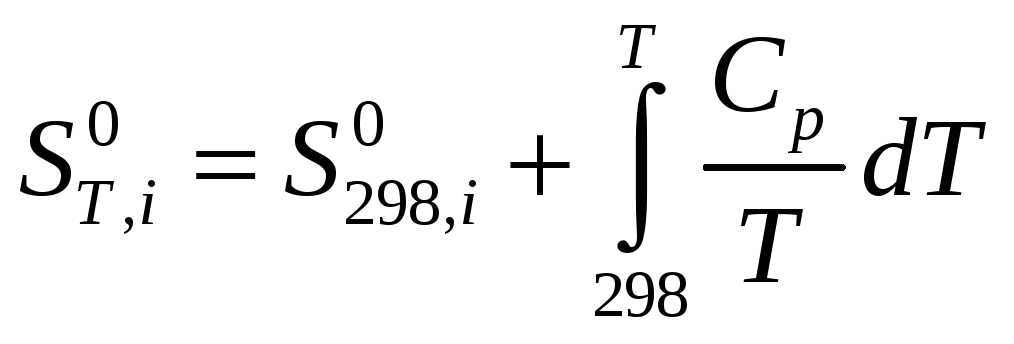
В
разі, якщо речовини зазнають зміни в
інтервалі температур від 298 до Т, величини
![]()
![]()
![]() можна знайти таким чином:
можна знайти таким чином:
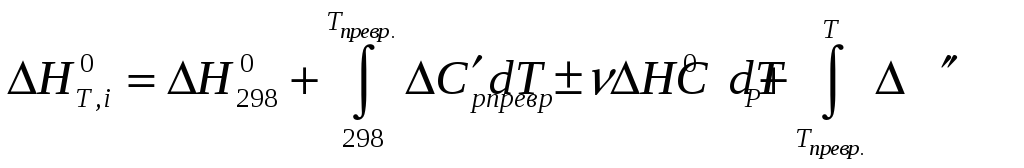

Розглянемо якісний приклад:
![]()

![]()
![]()
![]()
![]()
Отже,
бачимо, що лише одна речовина-учасник
реакції зазнає перетворення при
![]() ,
це означає, що весь інтервал розрахунку
розбиваємо на два проміжки: від
,
це означає, що весь інтервал розрахунку
розбиваємо на два проміжки: від
![]() до
до
![]() та від
та від
![]() до
шуканої температури. Отримуємо:
до
шуканої температури. Отримуємо:
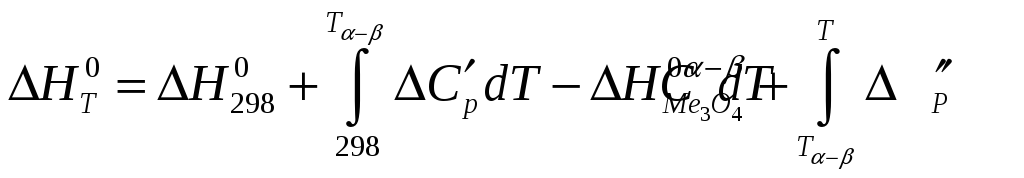
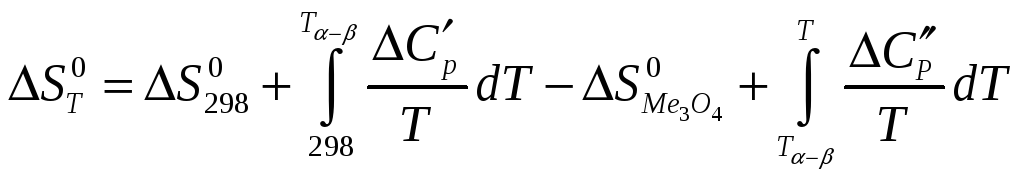
Оскільки
теплоємність кожної речовини залежить
від температури, таким чином
![]() ,
то
,
то
![]() та
та
![]() знаходяться для кожного температурного
інтервалу з врахуванням тих значень і
коефіцієнтів
знаходяться для кожного температурного
інтервалу з врахуванням тих значень і
коефіцієнтів
![]() ,
які справедливі для речовин в заданому
інтервалі:
,
які справедливі для речовин в заданому
інтервалі:
![]()
де
![]()
![]()
![]()
![]()
де
![]()
![]()
![]()
Підінтегральні
вирази в рівняннях
![]() та
та
![]() в загальному випадку беруться так:
в загальному випадку беруться так:

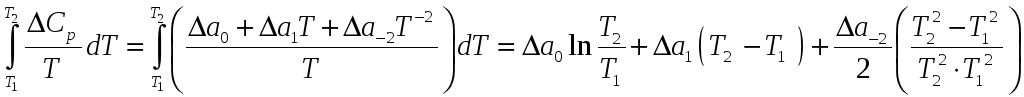
![]() знаходимо,
використовуючи закон Гесса, як різницю
теплот утворення речовин-продуктів та
речовин, які вступають в реакцію.
знаходимо,
використовуючи закон Гесса, як різницю
теплот утворення речовин-продуктів та
речовин, які вступають в реакцію.
![]()
Якщо в реакції бере участь проста речовина, то теплота його утворення ΔHº=0
![]() знаходимо,
як різницю абсолютних ентропій
речовин-продуктів і речовин, які вступають
в реакцію.
знаходимо,
як різницю абсолютних ентропій
речовин-продуктів і речовин, які вступають
в реакцію.
![]()
Отже,
обчислюємо
![]() та
та![]() ,
потім за рівнянням (1) знаходимо
,
потім за рівнянням (1) знаходимо
![]() ,
потім з рівняння
,
потім з рівняння
![]()
Знаходимо константу рівноваги.
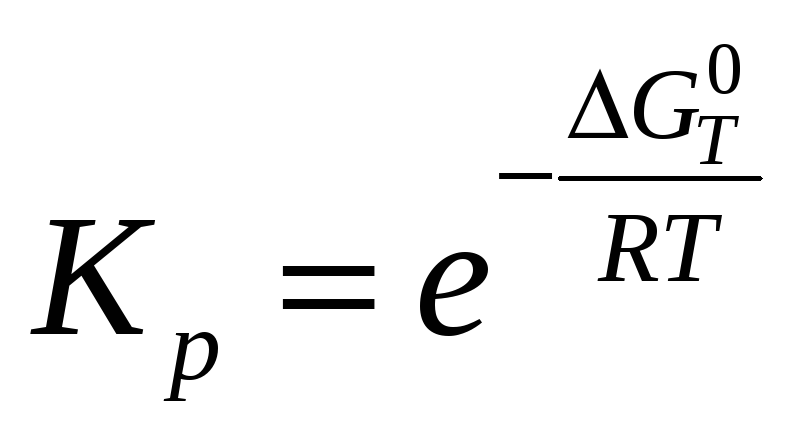
Значення константи рівноваги залежить лише від природи речовин і температури та не залежить від початкового стану системи. Величина константи рівноваги показує, наскільки сильно зміщується в ту або іншу сторону стан системи після протікання процесу: яких речовин буде багато, яких мало, або вміст їх в системі буде рівноважним.
Для заданої реакції константа рівноваги виражена:
![]() ;
;
![]()
![]()
звідки![]() ;
;
![]() .
.
Для вибору складу відновної газової суміші керуємося простим правилом: відновна суміш для відповідного оксиду повинна містити більшу долю газу-відновника (СО або Н2), ніж ту, яка відповідає рівноважному стану при заданій температурі.
ПРИКЛАД.
Дана реакція
![]() Т = 1100 К
Т = 1100 К
РІШЕННЯ. Скористаємося довідковими даними і представимо термодинамічні властивості речовин-учасників реакції у вигляді таблиці. 1
Таблиця 1 – Термодинамічні властивості речовин-учасників реакції
|
Речовина |
Фаза |
|
|
|
|
|
||
|
|
|
|
||||||
|
Н2
|
Г |
- |
130,58 |
27,72 |
3,39 |
- |
- |
- |
|
Н2О
|
Ж |
286,03 |
69,9 |
46,9 |
30,02 |
- |
373 |
40,90 |
|
|
Г |
- |
- |
90,9 |
- |
- |
- |
- |
|
Fe3O4
|
ТВ |
1122 |
146,6 |
51,83 |
6,78 |
- 1,59 |
1870 |
- |
FеO |
ТВ |
266,7 |
54,0 |
38,81 |
20,10 |
- |
1641 |
31,4 |
|
Ж |
- |
- |
60,7 |
- |
- |
2700 |
230,0 |
|
Константу рівноваги і рівноважні концентрації знаходимо за
допомогою рівнянь:
![]()
Обчислюємо за рівнянням:
![]()
Як показують табличні дані, з однією з речовин у вказаному інтервалі температур відбувається агрегатне перетворення – вода при 373 К переходить з рідкого в пароподібний стан. Тому формули для розрахунку зміни ентальпії і ентропії реакції набувають вигляду:


Тепловий ефект при 298 К обчислюємо як різницю між теплотою утворення речовин продуктів і речовин , які вступають у хімічну реакцію:

Величину
![]() знаходимо як різницю абсолютних ентропій
речовин учасників реакції:
знаходимо як різницю абсолютних ентропій
речовин учасників реакції:
![]()
Обчислюємо різницю теплоємкостей для реакції:
![]()
Інтервал температур: 298 – 373 К:
![]()
![]()
![]()
Інтервал температур 373-1100 К:
![]()
![]()
![]()
Знаходимо тепловий ефект реакції:

Обчислюємо зміну ентропії реакції:

Визначаємо зміну енергії Гіббса для заданої реакції:
![]()
Обчислюємо константу рівноваги:
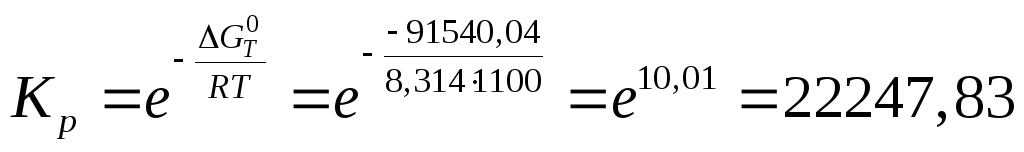
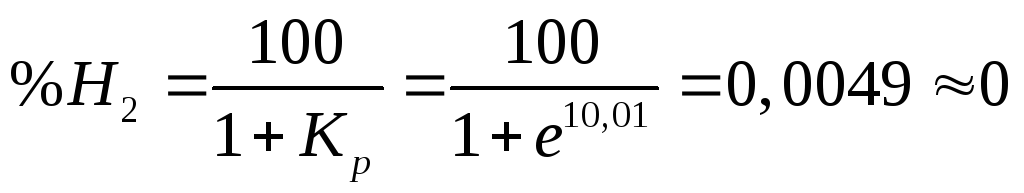
![]()
Вибираємо газову суміш для відновлення, в якій вміст відновника вище ніж в рівновазі й складає 40% Н2 та 60% Н2О.