
- •§1. Галлий ...................................................................................................................... 4
- •§2.Обзор важнейших соединений................................................................................ 6
- •§3.Трихлорид галлия, его строение, физические и химические свойства .............. 8
- •§4.Обзор прочих галогенидов галлия ....................................................................... 14
- •§5.Синтез трихлорида галлия ..................................................................................... 15
- •§1.Галлий
- •§2.Обзор важнейших соединений
- •§3.Трихлорид галлия, его строение, физические и химические свойства.
- •§4.Обзор прочих галогенидов галлия.
- •§5.Синтез трихлорида галлия.
- •I. Подготовка.
- •II. Синтез.
- •III. Очистка.
§3.Трихлорид галлия, его строение, физические и химические свойства.
п.1.Общая характеристика.
Трихлорид галлия (химическая формула GaCl3) – в чистом виде прозрачное, бесцветное, похожее на лёд крайне гигроскопичное вещество, кристаллизующееся в виде игольчатых кристаллов. Дымит на воздухе, сильно гигроскопичен. Хорошо растворяется в воде, при этом сильно гидролизуется.
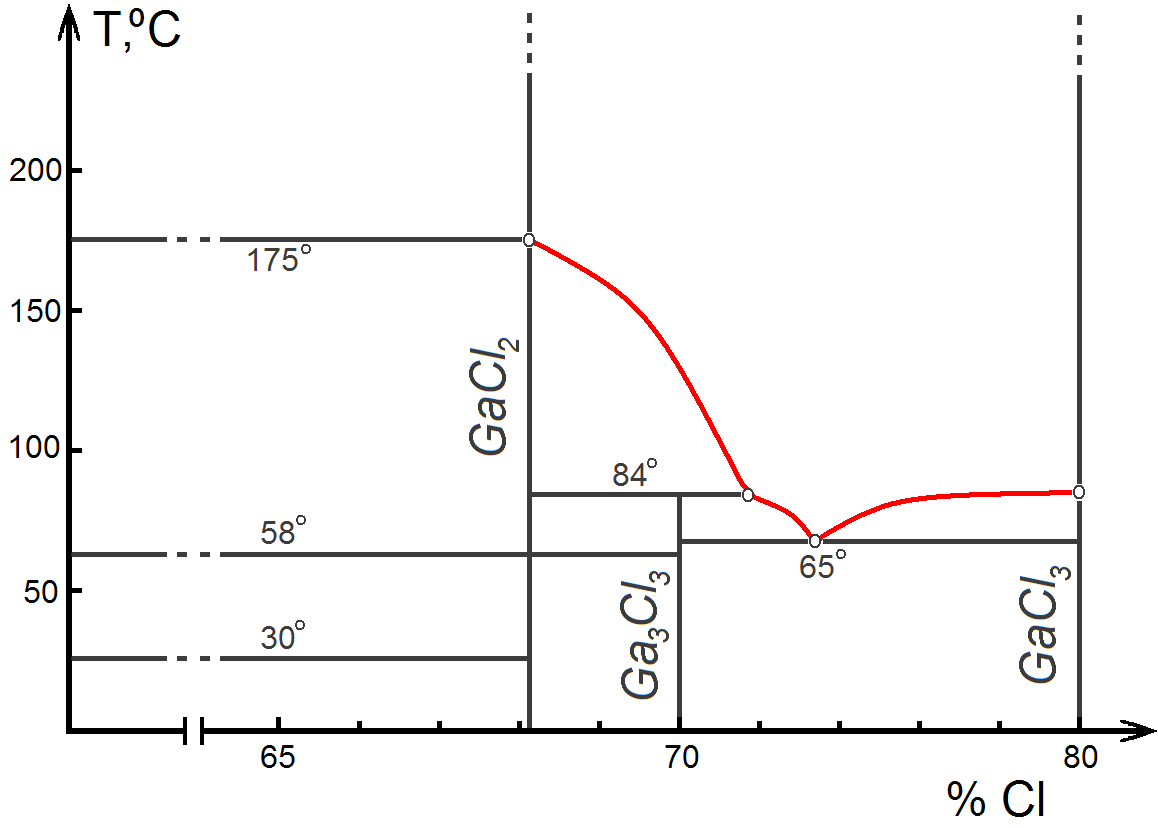
п.2.Диаграмма состояний галлий - трихлорид галлия.
Ниже приведена диаграмма системы галлий-трихлорид галлия (Рис.5).
Рис.5. Система галлий – трихлорид галлия [2].
п.3.Физические свойства.
Температура плавления хлорида галлия равна (77,9±0,2 °С).Различные источники приводят несколько отличающиеся значения температуры плавления (в °С): 75,5 76,0 76,65 77,0 77,5 (77,75±0,05) (78,0±0,3) что вызвано, по-видимому, различной степенью чистоты хлорида.
Плотность твердого хлорида, определенная пикнометрическим методом, равна 2,47 г/см³. Из рентгеновских данных вычислена плотность 2,50 г/см³.
Кристаллическая структура хлорида галлия была исследована Велвоком и Воррелом. По их данным, он обладает триклинной решеткой со следующими параметрами (в Å):
a=6,94 , b=6,84 , c=6,82 , a=119,5 , b=90,8 , g=118,8 , z=1 (Ga2Cl6)
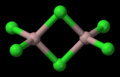
Атомы хлорида образуют в структуре хлорида галлия искаженную гексагональную плотнейшую упаковку со слоями, параллельными (001). В каждом слое 1/4 часть позиций упаковки не занята, так что каждый из двух периферических атомов хлора имеет 8 контактов с соседями вместо 12. Атомы галлия занимают половину имеющихся в структуре тетраэдрических пустот между двумя слоями атомов хлора, в результате чего в структуре наблюдаются димерные молекулы Ga2Cl6. Вследствие вакантности части позиций в структуре образуются каналы, параллельные (011). На основании изучения спектров комбинационного рассеяния можно прийти к выводу о существовании в твердом хлориде галлия димерных молекул . Считалось, что димер Ga2Cl6 можно рассматривать как комплексное соединение с координацинно-ковалентной связью, которое, однако, в значительной степени диссоциировано с образованием комплексного иона [GaH4−] Измерения ядерного квадрупольного резонанса твердого хлорида галлия также интерпретированы в смысле образования димерных молекул со степенью ионности связей галлий - хлор 50%. Последующие исследования ИК-спектров спектров комбинационного рассеяния подтвердили образование трихлоридом димерных мостиковых молекул (с симметрией D2h) как в кристаллическом состоянии, так и в расплаве.
Изменение объема при плавлении хлорида галлия составляет 17.%
Удельная электропроводность твёрдого хлорида галлия составляет (1,5·10-5)Ом -1см -1 при плавлении уменьшается до (1,7·10-6)Ом -1см -1, что объясняется превращением ионного кристалла в жидкость, состоящую главным образом из димерных молекул.
Плотность жидкого хлорида галлия при температуре плавления равна 2,0536 г/см3. Для зависимости плотности от температуры (в интервале 71-196 °С) Клеммом и Тильком предложено уравнение
Р = 2,063 - 0,00205*(t - 78)
В работе Гринвуда и Воде для этого же интервала рекомендуется уравнение:
Р = 2,0531 - 0,00209*(t - 78)
Зависимость давления пара от температуры представлена в таблице ниже и взята из статьи [3].
Таблица 1. Зависимость давления насыщенного пара и стандартной энтальпии сублимации GaCl3 от температуры.
Опыт 1.
T (log P/Па) ΔH˚(298K)
(˚K) кДж · моль-1
293.0 |0.83| 89.2
297.0 |1.06| 89.2
299.0 |1.13| 89.5
302.0 |1.23| 89.7
303.5 |1.32| 89.6
305.0 |1.37| 89.7
306.0 |1.40| 89.8
307.0 |1.46| 89.8
308.0 |1.49| 89.9
Средняя 89.6
Опыт 2.
T (log P/Па) ΔH˚(298K)
(˚K) кДж · моль-1
290.5 |0.76| 88.9
293.0 |0.84| 89.2
296.5 |0.95| 89.5
298.0 |1.07| 89.4
300.5 |1.15| 89.7
304.0 |1.31| 90.0
307.0 |1.42| 90.0
308.0 |1.47| 90.0
Средняя 89.6
Опыт 3.
T (log P/Па) ΔH˚(298K)
(˚K) кДж · моль-1
292.0 |0.79| 89.1
294.0 |0.90| 89.2
297.0 |1.03| 89.3
299.0 |1.12| 89.4
301.0 |1.22| 89.4
303.0 |1.28| 89.7
305.0 |1.32| 90.0
308.0 |1.45| 90.2
Средняя 89.5
Опыт 4.
T (log P/Па) ΔH˚(298K)
(˚K) кДж · моль-1
289.0 |0.63| 89.1
292.0 |0.79| 89.1
293.5 |0.87| 89.2
295.5 |0.96| 89.2
297.0 |1.02| 89.4
298.5 |1.07| 89.5
300.5 |1.14| 89.7
303.0 |1.26| 89.8
306.0 |1.44| 89.6
Средняя 89.4
В этой же статье авторами было предложено уравнение температурной зависимости давления насыщенных паров над твердым GaCl3 в небольшом интервале температур (289-308)°К :
log(P) = 13,80 – 3800*(Т) -1
п.4.Химические свойства.
Хлорид галлия – типичное молекулярное соединение, по многим свойствам напоминающее хлорид алюминия.
Очень хорошо растворяется в воде и органических растворителях, при этом в воде он сильно гидролизуется. Из кислых, (порядка 6М) водных растворов практически полностью экстрагируется такими органическими растворителями, как эфир, бутилацетат и т. п., что позволяет количественно отделить галлий от алюминия, хлорид которого не обладает подобным свойством. В таких кислых растворах галлий присутствует и виде хлоргаллиевой кислоты HGaCl4, которая и экстрагируется растворителем.
Хлорид галлия является очень сильной кислотой (по Льюису). Он может образовывать соединения с хлоридами большинства других элементов.
В настоящее время изучено около сорока двойных систем из хлорида галлия с хлоридами других элементов. В большинстве случаев при взаимодействии компонентов образуются соединения, количество которых в одной системе не превышает двух. Состав соединений независимо от валентности другого элемента отвечает отношению хлорида галлия к другому хлориду 1: 1 или 2: 1. Из двух соединений всегда более устойчиво то, где отношение компонентов 1: 1.
Соединения, образующиеся в системах с хлоридом галлия, относятся к следующим типам.
1. Хлорогаллаты - соединения, содержащие анионы [GaCl4]−. К ним относятся Ме[GaCl4], где Ме - катионы щелочных металлов, аммония, меди, серебра, одновалентных галлия, индия, таллия. Такой же анион образуется в соединениях с пентахлоридом фосфора [PCl4]+[GaCl4]–, тетрахлоридами селена и телура, а также, по-видимому, с трихлоридами висмута, сурьмы и мышьяка. В последних соединениях при переходе от висмута к мышьяку следует ожидать увеличения доли ковалентной связи.Возможно, что соединения (МеCl2·3GaCl3), где Mе = Mg, Ca, Sr, Ba, Cd, Hg, Sn, Pb, также содержат этот комплексный анион и образуют соединение Ме[GaCl4]2.
2. Хлордигаллаты - соединения с ионом [Ga2Cl7]− представляющим собой два искаженных тетраэдра с общей вершиной. К ним относятся соединения Mе[Ga2Cl7] где Ме = Nа, K, Rb, Cs, Tl, In+, Ga+. По-видимому, именно такое соединение образуется и в системе с LiCl, хотя авторы приписали ему состав 2:3. Можно предположить, что такой же анион существует в соединении с трихлоридом висмутата [BiCl2]+[Ga2Cl7] –. Во всех случаях термическая устойчивость хлордигаллатов ниже, чем хлорогаллатов.
3. Пентахлорогаллаты Mе(GaCl5) найдены в системах с хлоридами магния, кальция, стронция, бария, кобальта и железа. Соединения такого типа были предсказаны Горюновой. Структура их неясна.
4. Соединения состава MеGaCl8 с пентахлоридами ниобия, тантала и молибдена, скорее всего, представляют собой молекулярные структуры, хотя не исключено строение, подобное соединению с пентахлоридом фосфора.
Хлорогаллаты различного состава используются для изучения и получения некоторых интерметаллических соединений галлия, которые могут применяться в качестве полупроводников.
п.5.Металлорганические комплексы.
Галлий не является типичным комплексообразователем, например, по сравнению с d-элементами. Тем не менее получено множество металлорганических комплексных соединений хлорида галлия с различными лигандами. Так,наиболее простой комплекс можно получить прямым взаимодействием хлорида с аммиаком:
GaCl3 + NH3 = [GaCl3 · NH3]
Также хлорид галлия образует аддукты с другими азотсодержащими соединениями – пиридином, дипиридилом, триментиламином и т.д. С трифенилфосфином образует соединение[GaCl3 · PPh3], можно получить аналогичный продукт с триметиларсином.
Многочисленные комплексные соединения галогенидов галлия активно изучаются в последние годы, т.к. по результатам исследований этих соединений могут быть получены новые материалы для нанотехнологий. Так, соединения состава InxGa1-xN – перспективные материалы для твердотельной оптоэлектроники и преобразователей световой энергии в электрическую – синтезируются из аммиачных комплексов InCl3 и GaCl3.
п.6.Низшие хлориды.
При сплавлении с металлическим галлием трихлорид переходит в низшие хлориды. В литературе часто упоминается хлорид двухвалентного галлия GaCl2 и смешанный [2GaCl2·GaCl3], но, по-видимому, галлий в степени окисления +2 в кристалле существовать не может. По данным структурных исследований установлено, что дихлорид и гептахлорид тригаллия на самом деле представляют собой хлорогаллаты одновалентного галлия Ga[GaCl4] и Ga[Ga2Cl7]. Это нелетучие твёрдые белые вещества, неустойчивые к нагреванию (выше 300 °C дихлорид начинает диспропорционировать на трихлорид и металлический галлий). Дихлорид галлия растворим в бензоле (4,6 г на 100 г бензола), а также толуоле, причем эти растворы проводят электрический ток.
Монохлорид галлия GaCl образуется в газовой фазе при действии паров трихлорида на металл; при конденсации он диспропорционирует с образованием дихлорида. Степень окисления галлия в этом соединении - +1.
В присутствии воды низшие хлориды галлия разлагаются с выделением оранжево-коричневого осадка, который постепенно превращается в гидроокись галлия.
п.7.Применение.
Трихлорид галлия находит применение в различных отраслях науки.
GaCl3 служит для рафинирования галлия – его можно легко очистить от нелетучих примесей многократной пересублимацией, а затем, восстановив, получить довольно чистый металл.
Так как это соединение является сильной кислотой Льюиса, оно, наряду с другими веществами, используется в органической химии как катализатор некоторых реакций хлорирования, например, реакции Фриделя-Крафтса.
Трихлорид галлия является исходным веществом для получения некоторых важных соединений галлия, комплексов
Наверное, одно из самых интересных применений трихлорида галлия – нейтринная астрономия. Дело в том, что нейтрино крайне слабо взаимодействует с веществом, поэтому регистрировать эти элементарные частицы возможно лишь косвенно. Нейтрино в определённых условиях может поглощаться изотопами 71Ga и 37Cl, с образованием соответственно радиоактивных нуклидов 71Ge и 37Ar*, которые затем распадаются с образованием β-частиц высоких энергий:
νe+71Ga → 71Ge+e−
37Cl+νe → 37Ar*+e−
В нейтринных телескопах проектов GALLEX (Италия; Рис.6), SAGE (Россия) и GNO (США) используются несколько десятков тонн сверхчистого GaCl3, раствор которого помещён в герметичный резервуар, окруженный слоем воды и специальными детекторами: β-частицы, выделяющиеся в результате нейтринного захвата, имеют крайне высокую энергию и, проходя через слой воды, вызывают свечение (эффект Вавилова-Черенкова), которое регистрируется датчиками.
 Рис.6.
Фото нейтринного телескопа GALLEX
(из ресурсов интернет-форума Астрофорум).
Рис.6.
Фото нейтринного телескопа GALLEX
(из ресурсов интернет-форума Астрофорум).
Также в США и России предлагалось, наряду с другими соединениями, использование трихлорида галлия в качестве теплоносителя в первом контуре ядерных реакторов малой мощности. Однако для этой цели его не стали использовать, что связано с рядом нерешённых технологических проблем: в частности, недостаточно хорошо очищенный GaCl3 может образовать малолетучий тугоплавкий дихлорид, который забивает технологические каналы; кроме того, галлий довольно активно захватывает нейтроны (сечение захвата 2,71 барна).
Хлорид галлия с радиоактивным изотопом 72Ga (период полураспада - 14,2 часа) используется в современной медицине для лучевой диагностики рака костей.
