
- •Содержание
- •Тема 6. Жесткость воды и реакции солей жесткости в водных растворах
- •Часть 2
- •Тема 7. Окислительно-восстановительные реакции и их использование
- •Тема 8. Электрохимические системы и процессы (базовый материал)……81
- •Часть 3
- •Введение
- •1. Темы лабораторных работ
- •Тема 1. Химическая термодинамика (базовый материал)
- •Тема 2. Скорость химических реакций и методы ее регулирования (базовый материал)
- •Тема 3. Химическое равновесие (базовый материал)
- •Тема 4. Гетерогенные химические системы и поверхностные явления в них (спецраздел с элементами уирс) (базовый материал)
- •5.1 Электролитическая диссоциация и водородный показатель среды (рН)
- •5.2 Реакции обмена в растворах электролитов, в том числе гидролиз
- •5.3 Представление о химическом анализе
- •Тема 6. Жесткость воды и реакции солей жесткости в водных растворах (базовый материал)
- •2 Список рекомендуемой литературы
- •Часть 2
- •1. Темы лабораторных работ
- •Тема 7. Окислительно-восстановительные реакции и их использование в химическом анализе (базовый материал)
- •Тема 8 Электрохимические системы и процессы (базовый материал)
- •Лабораторная работа № 8.3 Электролиз растворов электролитов
- •2. Список рекомендуемой литературы
- •Часть 3
- •1. Темы и методики лабораторных работ
- •Тема 9. Отличительные реакции углеводородов различных классов
- •Описание опытов
- •Лабораторная работа № 9. 1 Качественные реакции предельных и непредельных углеводородов
- •Тема 10. Химические свойства и качественная идентификация гидроксипроизводных углеводородов
- •10.1 Кислотные свойства спиртов и фенолов
- •10.2 Основные свойства спиртов и фенолов
- •10.3 Реакции спиртов в качестве нуклеофилов
- •10.4 Нуклеофильное замещение он-группы спиртов
- •10.5 Окисление спиртов
- •Лабораторная работа № 10. 1
- •Тема 11. Химические свойства и качественная идентификация карбонильных соединений
- •Лабораторная работа № 11.1
- •Тема 12. Химические свойства и качественная идентификация карбоновых кислот
- •12.1 Электролитическая диссоциация
- •12.2 Декарбоксилирование карбоновых кислот
- •12.3 Реакции нуклеофильного замещения групп он в карбоксильной группе
- •Лабораторная работа № 12.1
- •Вопросы для защиты лабораторных работ и подготовки к экзамену по разделу "Химические свойства и типичные реакции органических соединений"
- •Список рекомендуемой литературы
- •350072, Г. Краснодар, ул. Московская, 2, кор. А
Тема 3. Химическое равновесие (базовый материал)
Рекомендуемая литература по теме 3 приведена на с. 24.
Химические реакции и физико-химические процессы могут быть необратимыми и обратимыми. Необратимые процессы протекают только в одном направлении и до конца, т.е. до полного расходования хотя бы одного из исходных веществ.
Реакции, которые могут одновременно проходить как в прямом, так и в обратном направлении, называются обратимыми. Обратимые реакции никогда не протекают до конца, т.к. ни одно из реагирующих веществ не расходуется полностью:
аА + вВ ⇄ cC + dD,
где A и B – исходные вещества; C и D – продукты прямой реакции; a, b, c и d – соответствующие стехиометрические коэффициенты.
Состояние химического
равновесия устанавливается при равенстве
скоростей прямой и обратной реакций:
![]() .
В соответствии с законом действия масс
получаем равенство:
.
В соответствии с законом действия масс
получаем равенство: ![]() ·
·![]()
![]() =
=
![]() ,
откуда
,
откуда
КР
= ![]() =
=![]() .
.
КР
– константа равновесия,
выражается через константы скоростей
прямой и обратной реакций ![]() и
и![]() или через равновесные концентрации
реагентов прямой ([A]а·[B]b)
и обратной ([C]c·[D]d)
реакций. В состоянии равновесия
концентрации всех веществ в реакционной
системе взаимосвязаны друг с другом,
изменение концентрации любого из них
вызывает изменение концентрации других.
Поэтому соотношение этих концентраций,
выражаемое константой равновесия, при
данной темпера-туре остается постоянной
величиной. Так, для системы: СО2(г)
+ 4Н2(г)
⇄
СН4(г)
+ 2Н2О(г)
константа равновесия может быть выражена
следующим образом:
или через равновесные концентрации
реагентов прямой ([A]а·[B]b)
и обратной ([C]c·[D]d)
реакций. В состоянии равновесия
концентрации всех веществ в реакционной
системе взаимосвязаны друг с другом,
изменение концентрации любого из них
вызывает изменение концентрации других.
Поэтому соотношение этих концентраций,
выражаемое константой равновесия, при
данной темпера-туре остается постоянной
величиной. Так, для системы: СО2(г)
+ 4Н2(г)
⇄
СН4(г)
+ 2Н2О(г)
константа равновесия может быть выражена
следующим образом:
КР
= ![]()
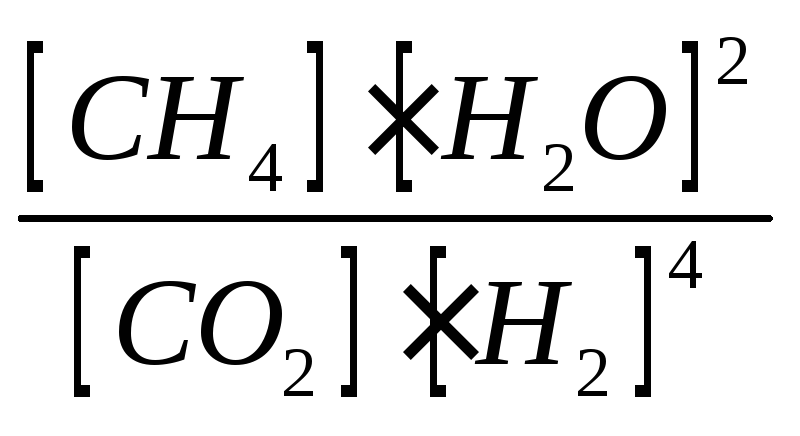 .
.
![]()
![]()
Физический смысл
константы равновесия
определяется соотноше-нием констант
скоростей прямой и обратной реакций ![]() и показывает, во сколько раз скорость
прямой реакции больше скорости обратной
реакции при одинаковой концентрации
всех веществ в системе, равной единице,
и данной постоянной температуре. Величина
константы равновесия зависит от природы
реагирующих веществ и температуры, но
не зависит от концентрации и присутствия
катализаторов.
и показывает, во сколько раз скорость
прямой реакции больше скорости обратной
реакции при одинаковой концентрации
всех веществ в системе, равной единице,
и данной постоянной температуре. Величина
константы равновесия зависит от природы
реагирующих веществ и температуры, но
не зависит от концентрации и присутствия
катализаторов.
Смещением или сдвигом равновесия называется процесс изменения равновесных концентраций веществ, вызванный нарушением равновесия. Состояние химического равновесия может существовать сколь угодно долго, но нарушается при изменении концентраций реагирующих веществ и продуктов реакций, температуры и давления (последнее – только для газообразных веществ). Все эти параметры влияют на скорость реакции. Таким образом, чтобы нарушить состояние химического равновесия, необходимо изменить скорости прямой или обратной реакций и тем самым нарушить их равенство.
Для смещения
равновесия и, как следствие, управления
направленностью обратимого процесса
может быть использован принцип
подвижного равновесия![]() (принцип
Ле Шателье):
изменение
одного из условий в равновесной системе
(температуры, давления, концентрации)
вызывает смещение химического равновесия
в направлении того процесса, который
противодействует произведенному
изменению.
(принцип
Ле Шателье):
изменение
одного из условий в равновесной системе
(температуры, давления, концентрации)
вызывает смещение химического равновесия
в направлении того процесса, который
противодействует произведенному
изменению.
Так, в системе СН4(Г) + СО2(Г) ⇄ 2СО(Г) + 2Н2(Г), ΔΗ>0 равновесие смещается вправо, т.е. в направлении прямой реакции в следующих случаях:
– при повышении температуры, т.к. при этом равновесие должно смещаться в сторону эндотермического процесса;
– при увеличении концентрации метана и (или) оксида углерода (IV) или при уменьшении концентрации оксида углерода (II) и водорода, что вытекает из закона действия масс;
– при понижении давления в системе, поскольку количество газообразных молекул продуктов прямой реакции преобладает над количеством молекул исходных веществ.
В случае реакции, протекающей в растворе, процесс обратим, если хотя бы один реагент и один продукт реакции проявляют свойства слабого электролита. Например, в обратимой реакции гидролиза ацетата калия СН3СООК + Н2О ⇄ СН3СООН + КОН, ΔΗ>0 реагентами – слабыми электролитами являются: в прямой реакции – вода, в обратной реакции нейтрализации – уксусная кислота. При этом равновесие смещено в сторону образования более слабого электролита – воды, т.е. влево. Для смещения равновесия вправо следует увеличить концентрацию воды (разбавить раствор), уменьшить концентрацию КОН (путем добавления кислоты, связывающей образующиеся при гидролизе ионы ОН¯), повысить температуру (поскольку реакция гидролиза эндотермична). Изменением давления невозможно сместить равновесие в данной реакции, т.к. в ней не участвуют газообразные вещества.
Рекомендуемая литература: [1], гл. 6, 6.2.8; [2], гл. 5, § 5.5, гл. 6, § 6.1; [5], гл. V.
Лабораторная работа № 3.1 Смещение химического равновесия (с элементами УИРС)
Цель работы: изучение факторов, которые вызывают смещение химического равновесия и позволяют управлять направленностью обратимых процессов.
Опыт 1. Влияние концентрации веществ на смещение химического равновесия (УИРС)
При взаимодействии хлорида железа (III) с роданидом аммония протекает обратимая реакция с образованием слабого электролита – роданида железа (III), имеющего интенсивную кроваво-красную окраску:
FeCl3 + 3NH4SCN ⇄ Fe(SCN)3 + 3NH4Cl
красный
Поскольку остальные вещества неокрашенные (NH4SCN и NH4Cl) или слабоокрашенные (разбавленный раствор хлорида железа (Ш) имеет светло-желтую окраску), смещение равновесия легко наблюдать по изменению интенсивности красной окраски1.
Реактивы: насыщенные растворы хлорида железа (III) и роданида аммония; кристаллические роданид аммония и хлорид аммония; дистиллированная вода.
Посуда и принадлежности: стандартные пробирки; два микрошпателя.
Методика проведения опыта. В пробирку добавьте по три капли растворов хлорида железа (III) и роданида аммония. Полученный темно-красный раствор разбавьте дистиллированной водой до светло-красной окраски. В этой системе установилось начальное состояние равновесия (пробирка №1, табл. 1.7).
Разделите полученный раствор на три пробирки. В одну пробирку (пробирка № 2) прибавьте 1-2 микрошпателя кристаллов роданида аммония, в другую (пробирка № 3) – 1-2 микрошпателя кристаллов хлорида аммония. Пробирку № 1 оставьте в качестве контроля для сравнения.
Сопоставьте интенсивность окрасок растворов во всех пробирках и отразите это в наблюдениях. На основании закона действующих масс напишите выражение для скорости прямой реакции, скорости обратной реакции и константы равновесия данной обратимой реакции.
Сделайте вывод о влиянии концентрации веществ на смещение химического равновесия и о причинах этого смещения. Объясните, почему изменение концентраций веществ влияет на скорость реакции.
Отметьте, сколько состояний равновесия Вы наблюдали. Определите, изменялась ли константа равновесия в ходе эксперимента или оставалась
постоянной и почему.
Результаты опыта занесите в таблицу 1.7.
Таблица 1.7 – Влияние концентрации веществ на смещение химического равновесия
|
Номер пробирки |
Добавленное вещество |
Изменение интенсивности окраски |
Направление смещения равновесия (вправо или влево) |
|
1 2 3 |
контроль NH4SCN NH4Cl |
|
|
Опыт 2. Влияние температуры на равновесие реакции обратимого гидролиза ацетата натрия
В основе опыта лежит реакция гидролиза ацетата натрия:
CH3COONa + H2O ⇄ NaOH + CH3COOH.
В этой обратимой реакции прямая реакция – гидролиз соли, обратная – нейтрализация. При смещении равновесия в сторону гидролиза образуется сильное основание, присутствие которого может быть установлено малиновым окрашиванием фенолфталеина, добавляемого в реакционную систему в качестве кислотно-основного индикатора.
Реактивы: 0,1 Н раствор ацетата натрия, спиртовый раствор фенолфталеина.
Посуда и принадлежности: пробирки, спиртовка, спички, держатель для пробирок.
Методика проведения опыта. Налейте в пробирку 3-4 мл раствора ацетата натрия и добавьте 1-2 капли раствора фенолфталеина. Нагрейте жидкость до кипения. В наблюдениях отметьте окраску раствора до и после нагревания. Охладите пробирку. Отметьте, изменился ли цвет жидкости в пробирке после охлаждения. Объясните, почему окраска фенолфталеина изменяется при нагревании и охлаждении.
Напишите выражение константы равновесия для данной реакции.
В выводах укажите:
– с какими тепловыми эффектами протекают прямая и обратная реакции и почему;
– каково направление смещения химического равновесия в данной реакции при повышении температуры и что является причиной этого.
Опыт 3. Влияние температуры на обратимую реакцию и установление термохимического типа прямой и обратной реакции (УИРС)
При действии раствора иода на крахмал образуется комплексное соединение – иодкрахмал, имеющий характерное синее окрашивание:
(С6Н10О5)n + m I2 ⇄ (С6Н10О5)n· m I2; ΔΗ = ?
бесцветное желтая синяя
соединение окраска окраска
Реактивы: раствор иода в воде (c желтой окраской средней интенсивности), свежеприготовленный крахмальный клейстер (приготовить суспензию из 0,5 г крахмала в 10 мл холодной воды, вылить ее в 150 мл горячей воды и довести до кипения).
Посуда и принадлежности: пробирки, спиртовка, спички, держатель для пробирок.
Методика проведения опыта. Налейте в пробирку 2-3 мл раствора крахмального клейстера, добавьте несколько капель раствора иода. Отметьте и запишите в графе "Наблюдения" окраску полученного раствора. Нагрейте пробирку на спиртовке. Отметьте изменение окраски. Пробирку охладите под струей воды из-под крана. Отметьте, что происходит с окраской раствора при охлаждении.
В выводах укажите направления смещения химического равновесия в данной обратимой реакции соответственно при повышении и понижении температуры, а также знаки тепловых эффектов прямой и обратной реакций. Объясните причины этого.
