
- •Экзаменационные вопросы по биологической химии
- •1. Предмет и задачи биологической химии. Обмен веществ и энергии, иерархическая структурная организация и самовоспроизведение как важнейшие признаки живой материи.
- •2. Гетеротрофные и аутотрофные организмы: различия по питанию и источникам энергии. Катаболизм и анаболизм.
- •3. Многомолекулярные системы (метаболические цепи, мембранные процессы, системы синтеза биополимеров, молекулярные регуляторные системы) как основные объекты биохимического исследования.
- •4. Уровни структурной организации живого. Биохимия как молекулярный уровень изучения явлений жизни. Биохимия и медицина (медицинская биохимия).
- •5. Основные разделы и направления в биохимии: биоорганическая химия, динамическая и функциональная биохимия, молекулярная биология.
- •6. История изучения белков. Представление о белках как важнейшем классе органических веществ и структурно-функциональном компоненте организма человека.
- •7. Аминокислоты, входящие в состав белков, их строение и свойства. Пептидная связь. Первичная структура белков.
- •8. Зависимость биологических свойств белков от первичной структуры. Видовая специфичность первичной структуры белков (инсулины разных животных).
- •9. Конформация пептидных цепей в белках (вторичная и третичная структуры). Слабые внутримолекулярные взаимодействия в пептидной цепи; дисульфидные связи.
- •11. Доменная структура и её роль в функционировании белков. Яды и лекарства как ингибиторы белков.
- •12.Четвертичная структура белков. Особенности строения и функционирования олигомерных белков на примере гемсодержащего белка - гемоглобина.
- •13.Лабильность пространственной структуры белков и их денатурация. Факторы, вызывающие денатурацию.
- •14.Шапероны - класс белков, защищающий другие белки от денатурации в условиях клетки и облегчающий формирование их нативной конформации.
- •15.Многообразие белков. Глобулярные и фибриллярные белки, простые и сложные. Классификация белков по их биологическим функциям и по семействам: (сериновые протеазы, иммуноглобулины).
- •17.Физико-химические свойства белков. Молекулярный вес, размеры и форма, растворимость, ионизация, гидратация
- •18.Методы выделения индивидуальных белков: осаждение солями и органическими растворителями, гель-фильтрация, электрофорез, ионообменная и аффинная хроматография.
- •19.Методы количественного измерения белков. Индивидуальные особенности белкового состава органов. Изменения белкового состава органов при онтогенезе и болезнях.
- •21 .Классификация и номенклатура ферментов. Изоферменты. Единицы измерения активности и количества ферментов.
- •22.Кофакторы ферментов: ионы металлов и коферменты. Коферментные функции витаминов (на примере витаминов в6, рр, в2).
- •23.Ингибиторы ферментов. Обратимое и необратимое ингибирование. Конкурентное ингибирование. Лекарственные препараты как ингибиторы ферментов.
- •25.Регуляция активности ферментов путем фосфорилирования и дефосфорилирования. Участие ферментов в проведении гормонального сигнала.
- •26.Различия ферментного состава органов и тканей. Органоспецифические ферменты. Изменение ферментов в процессе развития.
- •27.Изменение активности ферментов при болезнях. Наследственные энзимопатии. Происхождение ферментов крови и значение их определения при болезнях.
- •29.Обмен веществ: питание, метаболизм и выделение продуктов метаболизма. Органические и минеральные компоненты пищи. Основные и минорные компоненты.
- •30.Основные пищевые вещества: углеводы, жиры, белки, суточная потребность, переваривание; частичная взаимозаменяемость при питании.
- •31 .Незаменимые компоненты основных пищевых веществ. Незаменимые аминокислоты; пищевая ценность различных пищевых белков. Линолевая кислота - незаменимая жирная кислота.
- •32.История открытия и изучения витаминов. Классификация витаминов. Функции витаминов.
- •34.Минеральные вещества пищи. Региональные патологии, связанные с недостаточностью микроэлементов в пище и воде.
- •35.Понятие о метаболизме и метаболических путях. Ферменты и метаболизм. Понятие о регуляции метаболизма. Основные конечные продукты метаболизма у человека
- •36.Исследования на целых организмах, органах, срезах тканей, гомогенатах, субклеточных структурах и на молекулярном уровне
- •37.Эндэргонические и экзэргонические реакции в живой клетке. Макроэргические соединения. Примеры.
- •39.Окислительное фосфорилирование, коэффициент р/о. Строение митохондрий и структурная организация дыхательной цепи. Трансмембранный электрохимический потенциал.
- •40.Регуляция цепи переноса электронов (дыхательный контроль). Разобщение тканевого дыхания и окислительного фосфорилирования. Терморегуляторная функция тканевого дыхания
- •42.Образование токсических форм кислорода, механизм их повреждающего действия на клетки. Механизмы устранения токсичных форм кислорода.
- •43.Катаболизм основных пищевых веществ - углеводов, жиров, белков. Понятие о специфических путях катаболизма и общих путях катаболизма.
- •44.Окислительное декарбоксилирование пировиноградной кислоты. Последовательность реакций. Строение пируватдекарбоксилазного комплекса.
- •45.Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Связь между общими путями катаболизма и цепью переноса электронов и протонов.
- •46.Механизмы регуляции цитратного цикла. Анаболические функции цикла лимонной кислоты. Реакции, пополняющие цитратный цикл
- •47.Основные углеводы животных, их содержание в тканях, биологическая роль. Основные углеводы пищи. Переваривание углеводов
- •48.Глюкоза как важнейший метаболит углеводного обмена. Общая схема источников и путей расходования глюкозы в организме
- •49. Аэробный распад — основной путь катаболизма глюкозы у человека и других аэробных организмов. Последовательность реакций до образования пирувата (аэробный гликолиз).
- •50.Распространение и физиологическое значение аэробного распада глюкозы. Использование глюкозы для синтеза жиров в печени и в жировой ткани.
- •52. Биосинтез глюкозы (глюконеогенез) из аминокислот, глицерина и молочной кислоты. Взаимосвязь гликолиза в мышцах и глюконеогенеза в печени (цикл Кори).
- •54. Свойства и распространение гликогена как резервного полисахарида. Биосинтез гликогена. Мобилизация гликогена.
- •55. Особенности обмена глюкозы в разных органах и клетках: эритроциты, мозг, мышцы, жировая ткань, печень.
- •56. Представление о строении и функциях углеводной части гликолипидов и гликопротеинов. Сиаловые кислоты
- •57. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, непереносимость фруктозы и дисахаридов. Гликогенозы и агликогенозы
- •Глицеральдегид -3 –фосфат
- •58. Важнейшие липиды тканей человека. Резервные липиды (жиры) и липиды мембран (сложные липиды). Жирные кислоты липидов тканей человека.
- •Состав жирных кислот подкожного жира человека
- •59. Незаменимые факторы питания липидной природы. Эссенциальные жирные кислоты: ω-3- и ω-6-кислоты как предшественники синтеза эйкозаноидов.
- •60.Биосинтез жирных кислот, регуляция метаболизма жирных кислот
- •61.Химизм реакций β-окисления жирных кислот, энергетический итог.
- •62. Биосинтез и использование кетоновых тел в качестве источников энергии
- •6З.Пищевые жиры и их переваривание. Всасывание продуктов переваривания. Нарушение переваривания и всасывания. Ресинтез триацилглицеринов в стенке кишечника.
- •64.Образование хиломикронов и транспорт жиров. Роль апопротеинов в составе хиломикронов. Липопротеинлипаза.
- •65.Биосинтез жиров в печени из углеводов. Структура и состав транспортных липопротеинов крови.
- •66. Депонирование и мобилизация жиров в жировой ткани. Регуляция синтеза и мобилизации жиров. Роль инсулина, глюкагона и адреналина.
- •67.Основные фосфолипиды и гликолипиды тканей человека (глицерофосфолипиды, сфингофосфолипиды, гликоглицеролипиды, гликосфиголипиды). Представление о биосинтезе и катаболизме этих соединений.
- •68.Нарушение обмена нейтрального жира (ожирение), фосфолипидов и гликолипидов. Сфинголипидозы
- •Сфинголипиды, метаболизм: заболевания сфинголипидозы, таблица
- •69.Строение и биологические функции эйкозаноидов. Биосинтез простагландинов и лейкотриенов.
- •70.Холестерин как предшественник ряда других стероидов. Представление о биосинтезе холестерина. Написать ход реакций до образования мевалоновой кислоты. Роль гидроксиметилглутарил-КоА-редуктазы.
- •71.Синтез желчных кислот из холестерина. Конъюгация желчных кислот, первичные и вторичные желчные кислоты. Выведение желчных кислот и холестерина из организма.
- •72.Лпнп и лпвп - транспортные, формы холестерина в крови, роль в обмене холестерина. Гиперхолестеринемия. Биохимические основы развития атеросклероза.
- •73. Механизм возникновения желчнокаменной болезни (холестериновые камни). Применение хенодезокеихолевой кислоты для лечения желчнокаменной болезни.
- •74. Общая схема источников и путей расходования аминокислот в тканях. Динамическое состояние белков в организме.
- •75. Переваривание белков. Протеиназы - пепсин, трипсин, химотрипсин; проферменты протеиназ и механизмы их превращения в ферменты. Субстратная специфичность протеиназ. Экзопептидазы и эндопептидазы.
- •76. Диагностическое значение биохимического анализа желудочного и дуоденального сока. Дать краткую характеристику состава этих соков.
- •77. Протеиназы поджелудочной железы и панкреатиты. Применение ингибиторов протеиназ для лечения панкреатитов.
- •78. Трансаминирование: аминотрансферазы; коферментная функция витамина в6. Специфичность аминотрансфераз.
- •80. Окислительное дезаминирование аминокислот; глутаматдегидрогеназа. Непрямое дезаминирование аминокислот. Биологическое значение.
- •81. Основные источники аммиака в организме. Роль глутамата в обезвреживании и транспорте аммиака. Глутамин как донор амидной группы при синтезе ряда соединений.
- •82. Глутаминаза почек; образование и выведение солей аммония. Активация глутаминазы почек при ацидозе.
- •83. Биосинтез мочевины. Связь орнитинового цикла с цтк. Происхождение атомов азота мочевины. Нарушения синтеза и выведения мочевины. Гипераммонемии.
- •84. Обмен безазотистого остатка аминокислот. Гликогенные и кетогенные аминокислоты. Синтез глюкозы из аминокислот. Синтез аминокислот из глюкозы.
- •85. Трансметилирование. Метионин и s-аденозилметионин. Синтез креатина, адреналина и фосфатидилхолинов
- •86. Метилирование днк. Представление о метилировании чужеродных и лекарственных соединений.
- •87. Источники и образование одноуглеродных групп. Тетрагидрофолиевая кислота и цианкобаламин и их роль в процессах трансметилирования.
- •88. Антивитамины фолиевой кислоты. Механизм действия сульфаниламидных препаратов.
- •89. Обмен фенилаланина и тирозина. Фенилкетонурия; биохимический дефект, проявление болезни, методы предупреждения, диагностика и лечение.
- •90. Алкаптонурия и альбинизм: биохимические дефекты, при которых они развиваются. Нарушение синтеза дофамина, паркинсонизм.
- •91. Декарбоксилирование аминокислот. Структура биогенных аминов (гистамин, серотонин, γ-аминомасляная кислота, катехоламины). Функции биогенных аминов.
- •92. Дезаминирование и гидроксилирование биогеных аминов (как реакции обезвреживания этих соединений).
- •93. Нуклеиновые кислоты, химический состав, строение. Первичная структура днк и рнк, связи, формирующие первичную структуру
- •94. Вторичная и третичная структура днк. Денатурация, ренативация днк. Гибридизация, видовые различия первичной структуры днк.
- •95. Рнк, химический состав, уровни структурной организации. Типы рнк, функции. Строение рибосомы.
- •96. Строение хроматина и хромосомы
- •97. Распад нуклеиновых кислот. Нуклеазы пищеварительного тракта и тканей. Распад пуриновых нуклеотидов.
- •98. Представление о биосинтезе пуриновых нуклеотидов; начальные стадии биосинтеза (от рибозо-5-фосфата до 5-фосфорибозиламина).
- •99. Инозиновая кислота как предшественник адениловой и гуаниловой кислот.
- •100. Представление о распаде и биосинтезе пиримидиновых нуклеотидов.
- •101. Нарушения обмена нуклеотидов. Подагра; применение аллопуринола для лечения подагры. Ксантинурия. Оротацидурия.
- •102. Биосинтез дезоксирибонуклеотидов. Применение ингибиторов синтеза дезоксирибонуклеотидов для лечения злокачественных опухолей.
- •103. Биосинтез днк, субстраты, источники энергии, матрица, ферменты. Понятие о репликативном комплексе. Этапы репликации.
- •104. Синтез днк и фазы клеточного деления. Роль циклинов и циклинзависимых протеиназ в продвижении клетки по клеточному циклу.
- •105. Повреждение и репарация днк. Ферменты днк-репарирующего комплекса.
- •106. Биосинтез рнк. Рнк полимеразы. Понятие о мозаичной структуре генов, первичном транскрипте, посттранскрипционном процессинге.
- •107. Биологический код, понятия, свойства кода, коллинеарность, сигналы терминации.
- •108. Роль транспортных рнк в биосинтезе белков. Биосинтез аминоацил-т-рнк. Субстратная специфичность аминоацил-т-рнк-синтетаз.
- •109. Последовательность событий на рибосоме при сборке полипептидной цепи. Функционирование полирибосом. Посттрансляционный процессинг белков.
- •110. Адаптивная регуляция генов у про- и эукариотов. Теория оперона. Функционирование оперонов.
- •111. Понятие о клеточной дифференцировке. Изменение белкового состава клеток при дифференцировке (на примере белкового состава полипептидных цепей гемоглобина).
- •112. Молекяулрные механизмы генетической изменчивости. Молекулярные мутации: типы, частота, значение
- •113. Генетическая гетерогенность. Полиморфизм белков в популяции человека (варианты гемоглобина, гликозилтрансферазы, группоспецифических веществ и др).
- •114. Биохимические основы возникновения и проявления наследственных болезней (разнообразие, распространение).
- •115. Основные системы межклеточной коммуникации: эндокринная, паракринная, аутокринная регуляция.
- •116. Роль гормонов в системе регуляции метаболизма. Клетки-мишени и клеточные рецепторы гормонов
- •117. Механизмы передачи гормональных сигналов в клетки.
- •118. Классификация гормонов по химическому строению и биологическим функциям
- •119. Строение, синтез и метаболизм иодтиронинов. Влияние на обмен веществ. Изменение метаболизма при гипо- и гипертиреозе. Причины и проявление эндемического зоба.
- •120. Регуляция энергетического метаболизма, роль инсулина и контринсулярных гормонов в обеспечении гомеостаза.
- •121. Изменения метаболизма при сахарном диабете. Патогенез основных симптомов сахарного диабета.
- •122. Патогенез поздних осложнений сахарного диабета (макро- и микроангиопатии, нефропатия, ретинопатия, катаракта). Диабетическая кома.
- •123. Регуляция водно-солевого обмена. Строение и функции альдостерона и вазопрессина
- •124. Система ренин-ангиотензин-альдостерон. Биохимические механизмы возникновения почечной гипертонии, отеков, дегидратации.
- •125. Роль гормонов в регуляции обмена кальция и фосфатов (паратгормон, кальцитонин). Причины и проявления гипо- и гиперпаратироидизма.
- •126. Строение, биосинтез и механизм действия кальцитриола. Причины и проявление рахита
- •127. Строение и секреция кортикостероидов. Изменения катаболизма при гипо- и гиперкортицизме.
- •128. Регуляция синтезами секреции гормонов по принципу обратной связи.
- •129. Половые гормоны: строение, влияние на обмен веществ и функции половых желез, матки и молочных желез.
- •130. Гормон роста, строение, функции.
- •131. Метаболизм эндогенных и чужеродных токсических веществ: реакции микросомального окисления и реакции конъюгации с глутатионом, глюкуроновой кислотой, серной кислотой.
- •132. Металлотионеин и обезвреживание ионов тяжелых металлов. Белки теплового шока.
- •133. Токсичность кислорода: образование активных форм кислорода (супероксид анион, перекись водорода, гидроксильный радикал).
- •135. Биотрансформация лекарственных веществ. Влияние лекарств на ферменты, участвующие в обезвреживании ксенобиотиков.
- •136. Основы химического канцерогенеза. Представление о некоторых химических канцерогенах: полициклические ароматические углеводороды, ароматические амины, диоксиды, митоксины, нитрозамины.
- •137. Особенности развития, строения и метаболизма эритроцитов.
- •138. Транспорт кислорода и диоксида углерода кровью. Гемоглобин плода (HbF) и его физиологическое значение.
- •139. Полиморфные формы гемоглобинов человека. Гемоглобинопатии. Анемические гипоксии
- •140. Биосинтез гема и его регуляция. Нарушения синтеза тема. Порфирии.
- •141. Распад гема. Обезвреживание билирубина. Нарушения обмена билирубина—желтухи: гемолитическая, обтурационная, печеночно-клеточная. Желтуха новорожденных.
- •142. Диагностическое значение определения билирубина и других желчных пигментов в крови и моче.
- •143. Обмен железа: всасывание, транспорт кровью, депонирование. Нарушение обмена железа: железодефицитная анемия, гемохроматоз.
- •144. Основные белковые фракции плазмы крови и их функции. Значение их определения для диагностики заболеваний. Энзимодиагностика.
- •145. Свертывающая система крови. Этапы образования фибринового сгустка. Внутренний и внешний пути свертывания и их компоненты.
- •146. Принципы образования и последовательность фукционирования ферментных комплексов прокоагулянтного пути. Роль витамина к в свертывании крови.
- •147. Основные механизмы фибринолиза. Активаторы плазминогена как тромболитические средства. Основаные антикоагулянты крови: антитромбин III, макроглобулин, антиконвертин. Гемофилии.
- •148. Клиническое значение биохимического анализа крови.
- •149. Основные мембраны клетки и их функции. Общие свойства мембран: жидкостность, поперечная асимметрия, избирательная проницаемость.
- •150. Липидный состав мембран (фосфолипиды, гликолипиды, холестерин). Роль липидов в формировании липидного бислоя.
- •151. Белки мембран - интегральные, поверхностные, «заякоренные». Значение посттрансляционных модификаций в образовании функциональных мембранных белков.
- •153. Трансмембранная передача сигнала. Участие мембран в активации внутриклеточных регуляторных систем - аденилатциклазной и инозитолфосфатной в передаче гормонального сигнала.
- •154. Коллаген: особенности аминокислотного состава, первичной и пространственной структуры. Роль аскорбиновой кислоты в гидоксилировании пролина и лизина.
- •155. Особенности биосинтеза и созревания коллагена. Проявления недостаточности витамина с.
- •156. Особенности строения и функции эластина.
- •157. Гликозаминогликаны и протеогликаны. Строение и функции. Роль гиалуроновой кислоты в организации межклеточного матрикса.
- •158. Адгезивные белки межклеточного матрикса: фибронектин и ламинин, их строение и функции. Роль этих белков в межклеточных взаимодействиях и развитии опухолей.
- •159. Структурная организация межклеточного матрикса. Изменения соединительной ткани при старении, коллагенозах. Роль коллагеназы при заживлении ран. Оксипролинурия.
- •160. Важнейшие белки миофибрилл: миозин, актин, актомиозин, тропомиозин, тропонин, актинин. Молекулярная структура миофибрилл.
- •161. Биохимические механизмы мышечного сокращения и расслабления. Роль градиента одновалентных ионов и ионов кальция в регуляции мышечного сокращения и расслабления.
- •162. Саркоплазматические белки: миоглобин, его строение и функции. Экстрактивные вещества мышц.
- •163. Особенности энергетического обмена в мышцах. Креатинфосфат.
- •164. Биохимические изменения при мышечных дистрофиях и денервации мышц. Креатинурия.
- •165. Химический состав нервной ткани. Миелиновые мембраны: особенности состава и структуры.
- •166. Энергетический обмен в нервной ткани. Значение аэробного распада глюкозы.
- •167. Биохимия возникновения и проведения нервного импульса. Молекулярные механизмы синаптической передачи
- •168. Медиаторы: ацетилхолин, катехоламины, серотонин, γ-аминомаслянная кислота, глутаминовая кислота, глицин, гистамин.
- •169. Нарушения обмена биогенных аминов при психических заболеваниях. Предшественники катехоламинов и ингибиторы моноаминооксидазы в лечении депрессивных состояний.
- •170. Физиологически активные пептиды мозга.
- •Биохимические показатели биологических жидкостей человека
7. Аминокислоты, входящие в состав белков, их строение и свойства. Пептидная связь. Первичная структура белков.
α-Аминокислотыпредставляют собой производные карбоновых кислот, у которых один водородный атом, у α-углерода, замещен на аминогруппу (—NH2).
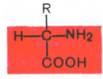
Аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связейбелковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью. В состав белков входят 20 природных аминокислот.
Кислотно-основные свойства.Эти свойства аминокислот определяют многие физико-химические и биологические свойства белков. На этих свойствах основаны, кроме того, почти все методы выделения и идентификации аминокислот. Аминокислоты легко растворимы в воде. Они кристаллизуются из нейтральных водных растворов в форме биполярных (амфотерных) ионов, а не в виде недиссоциированных молекул. В связи с этим, они могут проявлять как основные, так и кислотные свойства, что зависит еще от природы входящего в их состав радикала.
Стереохимия аминокислот.Важнейшим свойством аминокислот, освобождающихся в процессе гидролиза природных белков в условиях, исключающих рацемизацию, является их оптическая активность. Это свойство связано с наличием в молекуле всех природных аминокислот (за ислючением глицина) в α-положении асимметрического атома углерода. Стереохимию аминокислот принято оценивать не по оптическому вращению, а исходя из абсолютной конфигурации всех четырех замещающих групп, расположенных вокруг асимметрического атома углерода в вершинах модели тетраэдра. Абсолютную конфигурацию аминокислот принято соотносить стереохимически с соединением, произвольно взятым для сравнения, а именно с глицериновым альдегидом, также содержащим асимметрический атом углерода. Все аминокислоты, образующиеся при гидролизе природных белков в условиях, исключающих рацемизацию, принадлежит к L-ряду. Таким образом, природные аминокислоты имеют пространственное расположение, аналогичное конфигурации L-глицеринового альдегида.
Пептидная связь— вид амидной связи, возникающей при образованиибелковипептидовв результате взаимодействия α-аминогруппы (—NH2) однойаминокислотыс α-карбоксильной группой (—СООН) другой аминокислоты. Из двухаминокислот(1) и (2) образуетсядипептид(цепочка из двух аминокислот) и молекула воды. По этой же схемерибосомагенерирует и более длинные цепочки из аминокислот:полипептидыибелки.
Первичная структура— последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являютсяконсервативные мотивы— сочетания аминокислот, играющих ключевую роль в функциях белка. Консервативные мотивы сохраняются в процессеэволюциивидов, по ним часто удаётся предсказать функцию неизвестного белка. Первичная структура предопределяет все дальнейшие виды организации белковой молекулы.
