
m07-1
.pdf
Рис. 14. Зависимость скорости |
Рис. 15. Вытеснение быст- |
роста кристалла u и числа центров |
рорастущей грани bc медлен- |
кристаллизации п от переохлаждения t |
норастущими ab и cd |
(кривые Таммана) |
|
По мере увеличения переохлаждения обе величины растут, достигают максимума и уменьшаются, приближаясь к нулю. При больших переохлаждениях, чрезвычайно неблагоприятных для кристаллизации, образуется стеклообразное тело. Для роста совершенных единичных кристаллов необходимы по возможности малые переохлаждения, когда число центров невелико. Приведенные зависимости на рис. 14 не учитывают многих внешних факторов (примеси, размер слитка, условия теплоотвода и т. п.).
Различные грани кристалла растут с различной скоростью, что определяется ретикулярной плотностью, т. е. количеством атомов на единицу поверхности грани. При этом грани с малой ретикулярной плотностью растут быстрее, поскольку для их достроения требуется меньше вещества. Грани с высокой ретикулярной плотностью растут медленнее, вследствие чего наблюдается исчезновение быстрорастущих граней. Это обусловлено тем, что в процессе роста кристалл сохраняет равновесную форму, определяемую законом постоянства двугранных углов (рис. 15). Грани ab и cd, медленнорастущие ( υ1), вытесняют быстро растущую грань
bс(υ2;υ2 >υ1) Таким образом, форма кристалла должна определяться наиболее медленнорастущими гранями.
Механизм роста кристалла во многом определяется микрорельефом поверхностей, которые можно подразделить на атомно-гладкие. и ступенчатые. Образовавшийся на атомно-гладкой грани двумерный зародыш растет тангенциально (по поверхности). При этом атомы, поступающие из
41
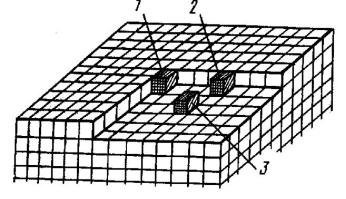
расплава на растущую поверхность, могут адсорбироваться в трех различных положениях (рис. 16).
Наиболее энергетически выгодным положением является положение так называемого повторимого хода, когда атом фиксируется в трехгранном угле, образованном ступенькой на растущей поверхности, изломом этой ступеньки и материнской гранью (число степеней свободы равно нулю). При попадании атома в двугранный угол, образованный ступенькой и материнской гранью, возможно его перемещение вдоль этой ступеньки до тех пор, пока он не попадет в положение повторимого хода (число степеней свободы равно 1). Атом, попавший на свободную материнскую поверхность, в конечном итоге займет это же положение (число степеней свободы равно 2). Когда грань будет застроена, для дальнейшего роста необходимо возникновение нового двумерного зародыша. Для зарождения необходимы большие пересыщения, чем для развития образовавшегося зародыша.
Рис. 16. Положения атома на растущей грани: 1 – положение повторимого хода (трехгранный угол); 2 – атом в двугранном углу;
3 – атом на поверхности
Скорость роста идеально гладкой грани пропорциональна частоте появления на ней двумерных зародышей. Этот этап является весьма чувствительным к пересыщению, и вероятность образования нового слоя при пересыщениях ниже 25 – 50 % совсем ничтожна. Дальнейшее разрастание слоя происходит быстро и от пересыщения не зависит. Однако в реальных кристаллах рост кристаллической поверхности становится непрерывным и осуществляется при малых пересыщениях порядка 1 % и ниже. Это противоречие между теорией и практикой объясняет так называемая дислокационная теория. В настоящее время эти представления о механизме и кинетике роста кристаллов из пара являются общепринятыми. Согласно дислокационной теории винтовые дислокации, всегда присутствующие в реаль-
42
ном кристалле и выходящие на растущую поверхность, обеспечивают наличие готовых ступенек. Частицы, адсорбированные поверхностью, свободно по ней перемещаются и, наконец, присоединяются к имеющемуся дислокационному выступу – ступеньке. В процессе кристаллизации ступеньки не зарастают, а сохраняются в новых слоях. Поэтому вся кинетика роста определяется движением ступенек и нет необходимости в появлении новых двумерных зародышей. При таком механизме роста полностью заполненных плоскостей нет, присоединение частиц происходит по спирали. Для образцов с достаточно совершенной структурой плотность дислокаций, выходящих на поверхность, достигает 104 см –2. Поэтому рост такой поверхности происходит во многих точках одновременно, и микрорельеф ее оказывается не гладким, а шероховатым.
Осуществление классического послойного роста гладких граней можно проводить лишь в специальных условиях.
5.4.Распределение примесей при кристаллизации
Впроцессе кристаллизации растворенное вещество (примесь) распределяется между твердой и жидкой фазами и концентрация его, как правило, в обеих фазах различна. Отношение концентрации растворенного ве-
щества в твердой фазе (Ств) к концентрации его в жидкой (Сж) называется коэффициентом распределения:
k= Cтв /Сж. |
(5.9) |
Иногда его называют коэффициентом сегрегации или коэффициентом ликвации. Коэффициент распределения – очень важная характеристика примеси. Он определяет поведение примеси при кристаллизации и характер распределения ее в выращенном кристалле, а также позволяет оценить эффективность очистки вещества в процессе кристаллизации. Величина k зависит от природы примеси и основного вещества, типа фазовой диаграммы соответствующей системы, условий кристаллизации, скорости перемещения расплавленной зоны, интенсивности перемешивания и т. п. При кристаллизации из расплава различают равновесный и эффективный коэффициенты распределения. Равновесный коэффициент распределения k0 применим к бесконечно медленной кристаллизации при равновесии между соприкасающимися фазами. Эффективный коэффициент распределения kэфф характеризует процессы кристаллизации с измеримой скоростью (состояние системы неравновесно). Величина k0 для различных примесей в
43
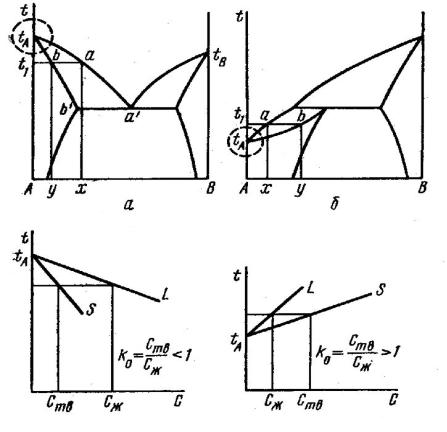
одном и том же веществе может меняться в очень широких пределах. Примеси, понижающие температуру плавления, имеют k0 < 1, а примеси, повышающие температуру, – ko > 1. На рис. 17 показаны участки фазовых диаграмм в области небольших концентраций примеси.
а б
Рис. 17. Участки диаграмм состояния в области разбавленных твердых растворов: a – примесь понижает температуру растворителя; :
b – примесь повышает температуру растворителя
При этих концентрациях можно использовать для описания состояния системы законы разбавленных растворов и считать, что линии солидуса и ликвидуса близки к прямым. Тогда коэффициент распределения легко рассчитать. Он равен отношению отрезков горизонтальных линий от оси температур до их пересечения с линиями солидуса и ликвидуса. Если угол между линиями солидуса и ликвидуса мал, и концентрации Ств и Сж близки, то равновесный коэффициент распределения близок к 1. Это наблюдается при большом сходстве природы и характера химической связи основного вещества и примеси.
Для оценки равновесного коэффициента распределения часто используются следующие эмпирические закономерности: 1) тетраэдрический ра-
44
диус многих примесей в германии и кремнии при температуре плавления полупроводника изменяется симбатно с изменением коэффициента распределения. Эта зависимость определяется типом вхождения примеси в решетку основного вещества и характером образующихся связей; 2) зависимость между k0 и стандартными энтальпиями сублимации примесей при температуре плавления; основой корреляции служит зависимость между энергией атомов в простом веществе и твердом растворе его в полупроводниковом материале.
В реальных условиях кристаллизация почти всегда протекает неравновесно. При заметных скоростях кристаллизации процессы диффузии не успевают выравнять концентрацию примеси во всем объеме расплава. При этом для примесей с k0 < 1 впереди фронта кристаллизации возникает слой жидкости толщиной δ, обогащенный примесью по сравнению с ее содержанием в расплаве. Поскольку наращивание кристалла происходит именно из этого прилегающего к кристаллу слоя, называемого диффузионным, а не из основной массы расплава, то и состав закристаллизовавшейся части также будет определяться отношением C'тв = кэффСж, где Сж – концентрация примеси в слое жидкости, прилегающем к фронту кристаллизации; Ств – концентрация примеси в твердой фазе вблизи фронта кристаллизации. Связь между равновесным и эффективным коэффициентом распределения определяется выражением:
kэфф = |
k0 |
|
|
|
. |
(5.10) |
|
υδ |
|||
|
k0 +(1−k0 )e− D |
|
|
Величина υδ/D называется приведенной скоростью. Она включает в себя три параметра; υ – скорость кристаллизации, см/с; δ – толщину диф-
фузионного слоя жидкости, см; D – коэффициент диффузии примеси в расплаве, cм2/с.
При малых значениях υδ/ D эффективный коэффициент kэфф приближается к равновесному k0 , а при больших kэфф становится равным единице. В реальных условиях kэфф имеет промежуточную величину между этими крайними значениями. Именно эта величина эффективного коэффициента распределения отражает конкретные условия кристаллизации. Для очистки наиболее благоприятны режимы, при которых kэфф → k0. Этому способствует медленность процесса кристаллизации (малые v), применение перемешивания (которое уменьшает толщину диффузионного слоя δ) и большие значения коэффициентов диффузии примеси. Толщина обогащенного слоя в за-
45

висимости от условий перемешивания может составлять 0,1 – 0,001 см. Скорости кристаллизации (в зонной плавке) составляют от нескольких долей миллиметров до 3 мм/мин и коэффициенты диффузии примесей в зависимости от их природы имеют порядок 10-4 – 10-6 см2/с.
5.5. Получение монокристаллов из расплава, направленная кристаллизация
Метод выращивания монокристаллов элементарных и сложных полупроводников из расплава, состав которого близок к составу получаемого кристалла, обладает двумя важными преимуществами по сравнению с остальными способами: высокой скоростью роста и возможностью получения больших монокристаллов. Однако этот метод неприменим для веществ, плавящихся инконгруэнтно, а также, если наблюдается фазовый переход в твердом состоянии. Кроме того, метод выращивания из расплава иногда связан с применением высоких температур, что также ограничивает его применимость.
Скорость роста кристалла будет определяться следующими факторами: 1) скоростью образования зародышей кристаллизации и 2) скоростью отвода тепла от фронта кристаллизации так, чтобы температура в нем не превышала температуры плавления растущего центра кристаллизации. Практически в любом расплаве присутствуют примеси, которые влияют на скорость роста и чистоту кристалла. Реальные процессы кристаллизации всегда связаны с относительно большими скоростями роста так, что равновесие между расплавом и растущим кристаллом не успевает устанавливаться, т. е. оттесняемая от фронта кристаллизации в расплав примесь (при k < 1) не успевает равномерно распределяться по всему объему жидкости, и концентрация примеси у границы раздела возрастает (рис. 18).
Рис. 18. Обогащение (а) и обеднение (б) расплава примесью вблизи фронта кристаллизации
46
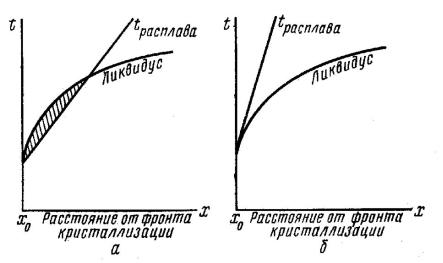
Таким образом, кристалл растет из слоя расплава, обогащенного примесью, причем это обогащение тем больше, чем больше скорость роста. Для получения совершенных монокристаллов необходимо учитывать возможность кристаллизационного переохлаждения, связанного с накоплением примеси вблизи фронта кристаллизации (рис. 19, а, б). Это явление возникает при недостаточно крутом градиенте температуры в экспериментальной установке, что приводит к переохлаждению жидкости вблизи фронта кристаллизации (температура плавления слоя жидкости оказывается выше фактически существующего распределения температуры). В переохлажденной жидкости спонтанно могут возникнуть новые центры кристаллизации, и в результате будет расти поликристалл. Во избежание структурного (кристаллизационного) переохлаждения необходимо создавать как можно более крутой градиент температур в экспериментальной установке (рис. 19, б).
Рис. 19. Распределение температуры при кристаллизации:
а– кристаллизационное переохлаждение;
б– способ его устранения
На формирование монокристалла влияет форма фронта кристаллизации. Так как рост кристалла всегда происходит в направлении, перпендикулярном фронту кристаллизации, то при выпуклом фронте увеличивается вероятность исчезновения в процессе роста побочных центров кристаллизации и, следовательно, получения структурносовершенного монокристалла. Влияние на форму фронта кристаллизации можно оказывать, изменяя условия теплоотвода через растущий кристалл. Кроме того, выращивать монокристаллы удается, используя контейнеры специальной формы или применяя монокристаллические затравки.
47
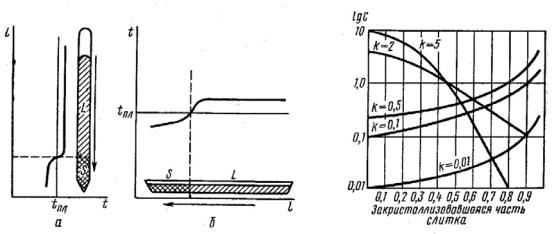
Для выращивания монокристаллов используют целый ряд разнообразных технических приемов (выращивание по методу Чохральского, Вернейля и др.). В лабораторной практике чаще всего осуществляется направленная кристаллизация расплава, т. е. жидкость затвердевает постепенно от одного конца контейнера к другому. Различают горизонтальный и вертикальный варианты этого метода (рис. 20). При выращивании монокристаллов важно знать, как распределяется имевшаяся в расплаве примесь по длине закристаллизовавшегося слитка. ЕСЛИ принято допущение (на практике осуществимое неполностью), что диффузия примеси в жидкости протекает мгновенно, то распределение примеси по длине образца можно описать уравнением
Сх = С0k (1-х)k-1, |
(5.11) |
где Сх – концентрация примеси в любой точке кристалла; Со – первоначальная концентрация примеси в жидкости; х – закристаллизовавшаяся часть расплава (х ≤ 1); k – коэффициент распределения, который характеризует отношение растворимости примеси в твердой и жидкой фазах.
Рис. 20. Варианты метода |
Рис. 21. Распределение |
направленной кристаллизации: |
примеси при направленной |
а – вертикальный; б – горизон- |
кристаллизации |
тальный |
|
Поскольку концентрация примесей в расплаве обычно мала, то интерес представляют только участки диаграмм состояния полупроводник – примесь, прилегающие к ординатам чистых компонентов. На этих участках диаграммы линии ликвидуса и солидуса, соответствующие разбавленным растворам, можно представить в виде прямых, а коэффициент распределения – как отношение отрезков, отсекаемых линиями ликвидуса и со-
48
лидуса на некоторой прямой, проведенной параллельно оси составов. Чем ближе расположены линии ликвидуса и солидуса, тем коэффициент распределения ближе к единице. Распределение примеси при направленной кристаллизации для различных коэффициентов распределения представлено на рис. 21.
Основная литература
1.Зиненко В.И. Основы физики твердого тела / В.И. Зиненко, Б.И. Сорокин, И.И. Турчин. – М. : Физматлит, 2001. – 336 с.
2.Павлов П.В. Физика твердого тела / П.В. Павлов, А.Ф. Хохлов. –
М. : Высш. шк., 2000. – 493 с.
3.Гончаров Е.Г. Химия полупроводников / Е.Г. Гончаров, Г.В. Семенов, Я.А. Угай. – Воронеж : Изд-во ВГУ, 1995. – 270 с.
4.Шалимова К.В. Физика полупроводников / К.В. Шалимова. – М. :
Энергия, 1971. – 312 с.
5.Вайнштейн Б.К. Современная кристаллография (в 4 томах) / Б.К. Вайнштейн, В.М. Фридкин, В.Л. Инденбом. – Том 2. – М. : Наука, 1979. – 360 с.
6.Зломанов В.П. Р—Т—х-диаграммы состояния систем металлхалькоген / В.П. Зломанов, А.В. Новоселова. – М. : Наука, 1987. – 207 с.
7.Угай Я.А. Введение в химию полупроводников / Я.А. Угай. – М. :
Высш. шк., 1975. – 302 с.
Дополнительная литература
1.Фистуль В.И. Физика и химия твердого тела / В.И. Фистуль. – М. :
Металлургия, 1995. – Т. 1. – 480 с.; Т. 2. – 320 с.
2.Бушманов Б.Н. Физика твердого тела / Б.Н. Бушманов, Ю.А. Хро-
мов. – М. : Высш. шк., 1971. – 224 с.
49
СОДЕРЖАНИЕ:
1.Особенности химической связи в полупроводниках…………………..3
2.Химическая классификация полупроводников………………………...7
3.Дефекты кристаллической решетки……………………………………22
3.Основные типы фазовых диаграмм………………………………….....28
5.Методы выращивания монокристаллов……………………………......37
Авторы:
доктор химических наук Яценко Олег Борисович, кандидат химических наук Чудотворцев Иван Геннадиевич кандидат химических наук Шаров Михаил Константинович
50
