
m07-1
.pdf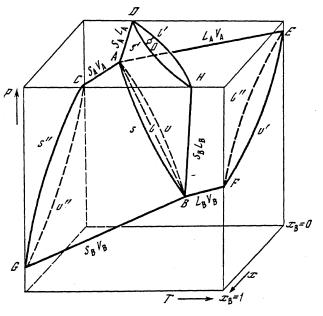
10, а штрихпунктиром. Линия А'О определяет давление пара над переохлажденной жидкостью, линия ОD – давление пара над перегретой твердой фазой, линия ВО соответствует переохлажденной смеси L + S. Энергия Гиббса таких систем больше равновесного значения, что приводит к самопроизвольному исчезновению метастабильной фазы.
4.2. P—T—x-Диаграмма состояния двухкомпонентной системы с неограниченной растворимостью во всех фазах и без соединений
Объемная Р—Т—х-диаграмма (рис. 11) состоит из плоских Р—Т- диаграмм чистых компонентов, сдвинутых по оси составов, различных линий и поверхностей, соединяющих эти диаграммы. Координаты нонвариантных трехфазных точек чистых компонентов А и В отвечают условиям: Р°А > Р°B и Тт,A < Тт,B.
Рис. 11. Р—T—х-диаграмма двухкомпонентной системы с неограниченной растворимостью во всех фазах
При переходе от одно- к двухкомпонентной системе линии двухфазного равновесия превращаются в соответствующие пары двухфазных поверхностей, например линии LAVA и LBVB в поверхности АЕL"FВL и АЕu'RВu. Для случая идеального поведения системы А – В форма указанных пар поверхностей напоминает чечевицу. Она ограничена двухфазными линиями чистых компонентов, а со стороны высоких температур – критической кривой, связывающей критические точки чистых компонентов. Фигуративные точки системы, находящиеся в объеме такой чечевицы, описывают средний состав системы, а каждой фазе отвечает точка на соответствую-
31
щей поверхности. Координаты этих точек необходимы для определения фаз, участвующих в равновесии, например, в точке о в равновесии участвуют фазы l' и s' массы которых тl и тs обратно пропорциональны длинам отрезков (правило рычага) оl' и оs' : тl тs = оl'/оs'.
Фигуративные точки системы в объеме Р—Т—х, ограниченные одноименными поверхностями, представляют область устойчивости соответствующих фаз. Область твердых растворов компонентов А и В ограничена поверхностями солидуса АsВGs''C и АDs'НВs; область жидкой фазы ограничена поверхностями ликвидуса АDL''НВL и АЕL"FВL; область пара ограничена поверхностями АEи'FВи и АuВGи"С.
Фазы, участвующие в трехфазном равновесии S + L + V, представлены в объеме Р—Т—х тремя линиями – s, l и u, каждая из которых является пересечением соответствующих поверхностей: линия АsВ – поверхностей солидуса АDs'НВs и АsВGs''; линия АlВ – поверхностей ликвидуса АDL'НВL и АЕL"FВL; линия АиВ – поверхностей пара АuВGи" и АEи'FВи. Указанные линии соединяют нонвариантные трехфазные точки чистых компонентов и расположены на одной трехфазной поверхности, имеющей форму листа. Этот «лист» в пространстве Р—Т—х ориентирован таким образом, что на координатную плоскость Р—Т он проектируется в виде одной, а на плоскости Т—х и Р—х – в виде трех линий.
4.3. P—T—x-Диаграмма состояния двухкомпонентной системы без соединений, с ограниченной растворимостью в твердой фазе
Рассмотрим Р—Т—х-диаграмму бинарной системы для случая ограниченной растворимости в твердой фазе и неограниченной растворимости в жидкой фазе и паре (рис. 12). Предположим, что отсутствуют экстремумы давления и температуры двухфазных равновесий S + V и L + V, а коорди-
наты тройных точек |
компонентов характеризуются неравенствами |
Тт,A < Тт,B, Р0A > Р0B, т. |
е, компонент с меньшей температурой плавления |
обладает большим давлением пара. Ввиду сложности изображения объемной Р—Т—х-диаграммы рассмотрим ее Т—х-, Р—Т-, Р—x-проекции.
На Т—х-проекции (рис. 12, а) представлены: температуры нонвариантных точек TА, TB чистых компонентов и нонвариантной эвтектической точки Q четырехфазного равновесия V + SА + L + SВ двухкомпонентной системы А—В; линии солидуса, ликвидуса и пара, описывающие температурную зависимость состава фаз, участвующих соответственно в следующих трехфазных равновесиях: линии TAD, TAE, TAC – для равновесия
32
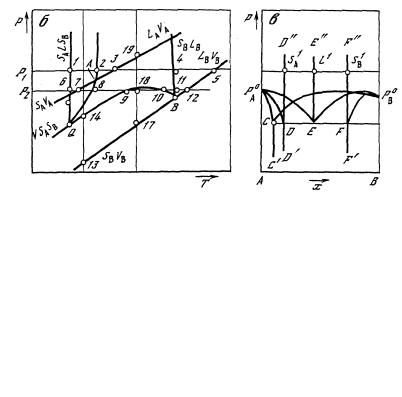
VSASB; линии СС'', DD', FF' – для равновесия VSASB; линии СТB, ЕТB, FТB – для равновесия VLSB. Обозначения трехфазных равновесий соответствуют возрастающему содержанию второго компонента.
а
б в
Рис. 12. Т—х- (а), Р—Т- (б) и Р—х- (в) проекции Р—Т—x-диаграммы двухкомпонентной системы, не образующей химическое соединение
и с ограниченной растворимостью в твердой фазе
На Р – T-проекции двухфазные равновесия с участием чистых компонентов изображены (см. рис. 12, б) линиями SАVA, SАLA, LАVA, SBVB, SBLB, LBVB, которые пересекаются в нонвариантных точках А и В. Твердые растворы SА и SВ на основе компонентов А и В участвуют в четырех трехфазных равновесиях, представленных линиями VSАSВ, SАLSВ, VSАL (АQ), VLSB (QB), которые пересекаются в нонвариантной точке Q. Линия SALSB описывает зависимость эвтектической температуры Q от давления. Линии VSASB, VSAL, VLSB, представляют температурную зависимость давления для трехфазных равновесий V+SA + SB и V + L+ S .
На Р—х-проекции (см. рис. 12, в) точками Р0А, Р0B, РQ представлено давление в нонвариантных точках А, В и Q. Линии Р0АC, Р0АD, Р0АЕ, Р0BC, Р0BЕ, Р0BF', СС', DD', FF' и DD", ЕЕ", FF" описывают барическую зависимость состава фаз, участвующих в трехфазных равновесиях VSAL, VLSB, VSASB и SАLSВ соответственно. На линиях Р0ВF, Р0ВЕ, Р0ВD, как и на линии
33
QВ (см. рис. 12, б), наблюдается максимум. Фазы, находящиеся в равновесии, описываются восходящими или нисходящими участками этих линий, поэтому кажущееся пересечение линий, например Р0ВЕ и Р0ВС, физического смысла не имеет.
4.4. Р—Т—х-Диаграмма состояния двухкомпонентной системы, в которой образуется конгруэнтно-плавящееся соединение SАB
Ввиду сложности объемной фигуры Р—Т—х- диаграммы рассмотрим
Т—х-, Р—Т-, Р—х-проекции и (Р—х)T- и (Т—х)P -сечения Р—Т—х-
диаграммы эвтектической двухкомпонентной системы, образующей кон-
груэнтно-плавящееся химическое соединение SАВ. Предположим, что ТQ1 < Тт,А < ТQ2 < Tmaxm, AB < Тт,B, где TQ1 и ТQ2 – эвтектические температуры, Tm,A и Tm,B – температуры плавления чистых компонентов, Tmaxm,AB –
максимальная температура плавления твердой фазы SАВ. Будем считать, что пар в системе состоит из атомов А, В и молекул АВ, парциальное давление молекул АВ PАВ меньше, чем давление пара P0А одного чистого компонента, но больше, чем давление пара Р0B второго чистого компонента.
4.4.1. Т—х-проекция
На Т—x-проекции (рис. 13, а) представлены следующие основные точки и линии: твердые фазы SА, SВ и SАB с небольшими областями гомогенности, температуры нонвариантных точек TА и ТB чистых компонентов, максимальная температура плавления соединения Tmaxm, AB, температуры нонвариантных точек конгруэнтного плавления TKm,AВ, сублимации TKC, со-
единения SАB.
Линии солидуса (TАSА, S'ABSmax, ABS''AB, TBSB), ликвидуса (TАLQ2 LmaxLQ1TB), пара (TАVQ2Vmaх,VQ1ТB, VQ1 V', VQ2V") описывают температурную зависимость состава твердых фаз, расплава и пара, участвующих в
трехфазных равновесиях: VSASAB, VSAL, VLSB, VSABL, SАВVL, SABVSB, VLSB соответственно. При обозначении трехфазных процессов в двухкомпонентной системе последовательность фаз соответствует увеличению мольной доли второго компонента, а конгруэнтная фаза записывается в середине.
34
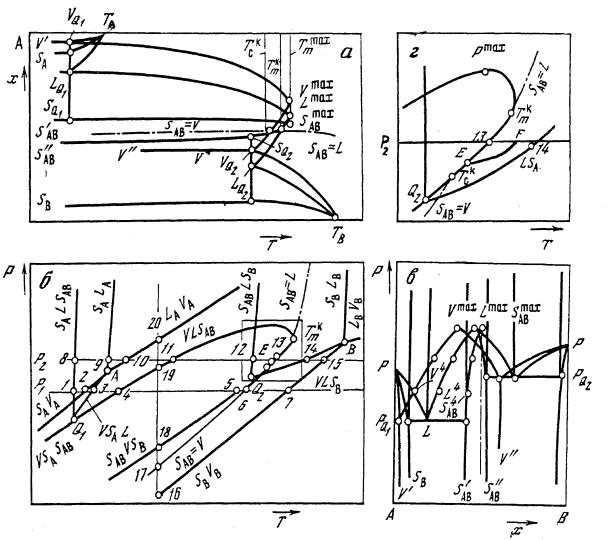
Рис. 13. (Т—х) (а),Р—Т- (б) и Р—х- (в) проекции Р—Т—х- диаграммы двух-
компонентной системы, образующей конгруэнтно-плавящееся соединение SAB; г – фрагмент Р—T-проекции вблизи Tmaxm, AB
В точках TKC и TKm, начинаются штрихпунктирные линии, описывающие на рис. 13, а, двухфазные конгруэнтные процессы SАВ = V и SАВ = L и являющиеся проекциями линий взаимного касания двухфазных поверхностей на плоскость Т—х. Указанные процессы имеют важное технологическое значение для приготовления соединений SAB c заданным составом.
Составы четырех фаз (SА, SAB, L, V и SАВ, V, L, SВ), участвующих в нонвариантных равновесиях, при эвтектических температурах ТQ1 и ТQ2 на рис. 13 представлены точками VQ1, SQ1А, LQ1, SQ1 и SQ2, VQ2, LQ2, SQ2B, которые соединены линиями, параллельными оси составов. Из этих точек начинаются линии, изображающие температурную зависимость состава твердых фаз и жидкости, участвующих в эвтектическом равновесии. Состав фаз при максимальной температуре плавления фазы SАB обозначен как Vmax, Lmax,SmaxAB.
35
4.4.2. Р—Т-проекция
На рис. 13, б изображена Р—T-проекция Р—T—x-диаграммы двухкомпонентной системы А—В, образующей химическое соединение, с ограниченной растворимостью в твердой фазе.
Моновариантные двухфазовые равновесия с участием чистых компонентов А и В на рис. 13, б представлены линиями SAVA, SALA, LAVA, SBVB, SBLB и LBVB которые пересекаются в нонвариантных точках А и В. Дополнительно к моновариантным трехфазным равновесиям VSAL и VLSB, включающим твердые растворы на основе чистых компонентов, на рис. 13, б представлены и моновариантные трехфазные равновесия с участием твердой фазы SAB: VSASAB (линия направлена вниз из точки Q1), SALSAB, VLSAB, SABVL, SABVSB, SAB LSB. Четырехфазные равновесия VSALSAB (точка Q1) и SАBVLSB (точка Q2) на Р—T-диаграмме проектируются как точки пересечения четырех линий соответствующих трехфазных равновесий. Последовательность обозначения равновесных фаз соответствует возрастанию в них содержания компонента В. Следует различать точки пересечения линий, истинные, имеющие физический смысл, например точки А, Q1, Q2, B, и кажущиеся, например пересечение линий SAVA и SALSAB, которые возникают при проектировании объемной фигуры на Р—T-плоскость.
Области, ограниченные линиями SAVA—VSAL—VSASAB, VSASAB— VLSAB—SABVL—SABVSB, SABVSB—VLSB—SBVB отвечают двухфазным равновесиям SB + V, V+SAB, и SB + V соответственно. В зависимости от температуры и давления в области, ограниченной линиями SALA, VSAL, VLSAB, SABVL, VLSB, LBVB, жидкая фаза L может находиться в равновесии с паром или твердыми фазами.
4.4.3. Р—х-проекция
Р—х-проекция Р—Т-х-диаграммы состояния двухкомпонентной системы представлена на рис. 13, в. Сплошные линии представляют зависимости состава фаз, участвующих в трехфазных равновесиях, от давления. Они соединяют нонвариантные точки РА, РQ1, РQ2, РB. Состав фаз, отвечающих нонвариантным равновесиям Q1 и Q2, представлен четырьмя точками, соединенными между собой горизонтальными прямыми. В сторону высоких давлений из этих точек развиваются линии, описывающие равно-
весия SA + L + SAB и SB + L + SAB, а в сторону низких давлений – равновесия V + SА + SАB и SАВ + V + SВ. Штрихпунктиром обозначены также линии
36
SAB = V и SAB = L, описывающие барическую зависимость точек конгруэнтной сублимации и плавления.
Глава 5. Методы выращивания монокристаллов
5.1. Чистые вещества и их классификация
Чистые материалы для полупроводниковой техники подразделяются на 3 класса: А, В, С. К классу чистоты А1 и А2 относятся вещества с содержанием примесей выше 0,01 %, которые можно определить методами классического химического анализа. К классам чистоты В3 – В6 и С7 – СЮ относятся вещества, для которых приводятся характеристики лишь по содержанию анализируемых примесей.
В последнее время высокочистые материалы принято подразделять на вещества эталонной чистоты (ВЭЧ) и особо чистые вещества (ОСЧ). В первых лимитируют присутствие небольшого количества особо нежелательных примесей. При этом указывают общее содержание примесей в виде цифр перед индексом ВЭЧ, а также количество определяемых примесей и их суммарное содержание. Например, обозначение 003ВЭЧ4-7 соответствует материалу с общим содержанием примесей 0,003 мас. %, с четырьмя определяемыми примесями, количество которых равно 10–7 мас. %. По сравнению с материалами класса ВЭЧ вещества ОСЧ характеризуются большей чистотой. При этом количество определяемых примесей значительно больше, а потому общее содержание примесей практически соответствует сумме определяемых. Например, обозначение ОСЧ10-5 соответствует особо чистому веществу с десятью определяемыми примесями и с их общим содержанием 10 5 мас.% (по старой классификации В5). В маркировке полупроводниковых материалов обозначают не только тип легирующей примеси, но и те свойства, которые наиболее важны для практического применения, а иногда и способ получения. Например, марка БКЭФ10/0,2 характеризует кремний (К), полученный бестигельной зонной плавкой (Б), электронного типа проводимости (Э), легированный фосфором (Ф) с удельным сопротивлением 10 Ом-см и временем жизни неосновных носителей 0,2 мкс; арсенид галлия АГДЦ 3.5×17 – дырочного типа (Д), легирован цинком (Ц) с концентрацией дырок 3.5×1017. Фосфид галлия, применяемый для фотодиодов, маркируется, например, так: ФГЭТК-К/30 [Э – электронного типа, ТК – легирован теллуром, кислородом, К – красное свечение р-n-перехода, 30 – яркость свечения, кд/м2 (нит)].
37
5.2. Термодинамические условия зарождения фазовой границы
Процессы кристаллизации представляют собой фазовые переходы, сопровождающиеся увеличением степени упорядоченности. Эти процессы подразделяются на 2 типа: газ—кристалл, жидкость (стекло)—кристалл.
Втермодинамическом отношении данные фазовые равновесия описываются однотипно. В предкристаллизационный период в жидкости образуются ассоциаты в пределах ближнего порядка, которые, однако, не могут стать зародышем новой фазы из-за термодинамической нестабильности. Эта нестабильность – следствие их большой поверхностной энергии. Возникающие таким образом гомогенные флуктуации не способны к самостоятельному существованию в расплаве, и время их релаксации зависит от многих факторов: вязкости, теплопроводности, теплоемкости и т. п. По мере снижения температуры стабильность и время релаксации (τ) гомогенных флуктуаций возрастают. Если τ → ∞, эта величина исключается, и для анализа системы достаточно знания термодинамических параметров.
Зародышем новой фазы следует считать ассоциат минимального размера, стабильность которого не зависит от времени. Образование зародыша сопровождается возникновением фазовой границы, что связано с затратой работы. Выделяющаяся при этом скрытая теплота кристаллизации должна эффективно отводиться для обеспечения изотермических условий.
Вчастности, образование гетерогенной флуктуации (зародыша новой фазы) в расплаве при температуре кристаллизации (температуре плавления) невозможно, поскольку выделяющаяся скрытая теплота кристаллизации способствует разрушению новообразований. Для образования зародыша необходимо переохлаждение расплава, компенсирующее выделение тепла.
Для оценки размера критического зародыша необходимо учесть соотношение объемной и поверхностной свободной энергии при образовании новой фазы. Изменение свободной энергии при кристаллизации (для сферического зародыша) можно представить в виде:
G = 4πr²γ + 4/3πr³ Gv, |
(5.1) |
где γ – удельная поверхностная энергия; Gv – изменение свободной энергии при кристаллизации для единицы объема; r – радиус зародыша; γ и Gv не зависят от r и имеют разные знаки.
С увеличением размера зародыша поверхностная энергия растет медленнее, чем уменьшается объемная энергия. При некоторой величине r оба члена равны друг другу, что является термодинамическим критерием воз-
38
никновения стабильного критического зародыша радиусом rк. Величину rк можно определить, приравняв нулю производнуюd( G)/dr:
d ( G) |
= 8πrγ + 4πr2 G = 0 |
; |
|
||
dr |
v |
|
|
|
|
|
4πr(2γ + r G) = 0. |
(5.2) |
Поскольку r = 0 не удовлетворяет условиям задачи, то справедливо единственное решение
rк = −2γ/ Gv. |
(5.3) |
Тогда свободная энергия критического зародыша
G = |
16πγ3 |
− |
32 πγ3 |
= |
16πγ3 |
|
(5.4) |
||
|
|
|
|
|
|||||
|
G )2 |
3 ( G )2 |
3( G )2 |
||||||
max |
( |
|
|
|
|
||||
|
|
|
|
|
|||||
|
|
v |
|
|
v |
|
v |
|
|
Как следует из (5.3), размер критического зародыша зависит от γ и Gv, которые определяются геометрией и энергетикой ближнего порядка.
В практическом отношении важно так называемое двумерное зарождение, которое реализуется при выращивании кристаллов на затравках. При этом ориентирующее влияние подложки, обусловленное избыточной поверхностной энергией, снижает флуктуацию энергии G, необходимую для образования двумерного зародыша, а также уменьшает размер критического зародыша. При этом свободную энергию зародыша можно представить в виде
|
d ( G) |
G = 2πrγ + πr2 |
Gv |
(5.5) |
Тогда из условия |
= 0 следует, что |
|
|
|
dr |
|
|
||
|
|
|
|
|
|
|
rк =−(γ/ Gv), |
(5.6) |
|
а |
|
|
|
|
|
|
G =πγ2/ G |
(5.7) |
|
|
|
max |
v. |
|
Решающую роль в процессе зарождения (и дальнейшего роста) кристаллов играет переохлаждение (пересыщение), которым определяется в конечном итоге разность химических потенциалов сосуществующих фаз. Существуют различные способы выражения пересыщений. Для выращивания из газовой фазы: Р = Р—Ps – абсолютное пересыщение; β = P/PS – относительное пересыщение; γ = P/Ps – коэффициент пересыщения; где Р – давление пара компонента в газовой фазе; Ps – равновесное давление пара над твердой фазой, Р > РS .
39
Для растворов используют концентрационное пересыщение: С = С – Cs – абсолютное, β = C/CS – относительное, γ= C/Cs – коэффициент пересыщения (С > Cs). Для кристаллизации из расплава используют величину переохлаждения T = Тпл. – Т, где Тпл. – температура плавления вещества, Т – температура переохлажденного расплава, Т < Тпл.
Величина пересыщения (переохлаждения) определяет вероятность образования зародышей, их размер и число. При значительных пересыщениях образование зародышей облегчается, критический радиус зародыша уменьшается и вследствие этого возрастает число центров кристаллизации. Таким образом, при значительных пересыщениях создаются условия, способствующие росту поликристалла.
Для получения монокристалла необходимо каким-нибудь образом подавить образование множественных центров кристаллизации. Одним из путей является снижение пересыщения (переохлаждения), способствующее увеличению критического радиуса зародыша. Введение монокристаллической затравки приводит к аналогичным результатам. При этом спонтанный рост трехмерных зародышей подавляется, а осуществляется двумерный рост кристалла на затравке, более выгодный в термодинамическом отношении.
5.3. Кинетика и механизм роста кристаллов
Скорость роста кристалла определяется линейным перемещением растущей грани кристалла параллельно самой себе в единицу времени:
υ = A exp |
− |
Gmax |
exp |
− |
H |
|
, |
(5.8) |
|
|
RT |
||||||||
|
|
RT |
|
|
|
|
|
||
где Gmax – изменение свободной энергии при образовании зародыша; H – скрытая теплота кристаллизации.
Процесс кристаллизации определяется двумя внутренними факторами: числом зародышей и скоростью их роста. Оба фактора зависят от переохлаждения. На рис. 14 приведены так называемые кривые Таммана, представляющие собой зависимости числа зародышей и скорости их роста от переохлаждения. При малых переохлаждениях т. е. при температурах, близких к равновесной температуре кристаллизации, и число центров, и скорость их роста близки к нулю.
40
