
m07-1
.pdfкой сильный окислитель, как кислород, вызывает окисление свинца до более высоких степеней окисления, чем халькогены.
Германий с серой и селеном образует как моно-, так и дихалькогениды. В системе олово – селен также фиксируются только два соединения:
моно- и диселенид олова. Наиболее сложно взаимодействие в системе олово – сера: помимо моно- и дисульфида олова образуются промежуточные сульфиды Sn2S3 и Sn3S4. Объясняется это большим сродством олова к сере.
По типу кристаллической решетки монохалькогениды элементов подгруппы германия делятся на две группы. Высокотемпературная модификация GeTe, халькогениды свинца и SnTe кристаллизуются в решетке поваренной соли. Ко второй группе монохалькогенидов, кристаллизующихся в орторомбической решетке, относятся GeS, GeSe, SnS и SnSe. Между указанными двумя группами структур нет принципиального отличия. По существу орторомбическая решетка представляет собой деформированную решетку поваренной соли, в которой каждый атом имеет координационное окружение в виде сильно искаженного октаэдра. Низкотемпературная полиморфная форма теллурида германия имеет ромбоэдрическую структуру. Температура фазового перехода зависит от состава и колеблется в пределах 390 – 460 °С. Вероятно, SnTe также характеризуется низкотемпературной ромбоэдрической модификацией, наблюдающейся при температурах намного ниже комнатной.
Полупроводниковые соединения с общей формулой А2В3 делятся на две группы – АIII2ВVI3 и АV2ВVI3. В первом случае это халькогениды металлов третьей группы (например, Al2S3, Ga2Se3), а во втором – соединения элементов пятой группы в степени окисления +3 (например, As2S3, Sb2Se3).
Соединения АV2ВVI3 характеризуются кристаллической структурой с низкой симметрией, поэтому обнаруживают сильную анизотропию свойств. Для их структур характерны слоистые и цепочечные решетки. Внутри слоев и цепочек они связаны ковалентными связми, а между слоями – силами Ван-дер-Ваальса. Поэтому для этой группы соединений характерны низкие температуры плавления.
Несколько меньше изучены соединения AIIBV (например, Zn3P2, Cd3As2, ZnP2, ZnAs2, ZnSb и т.д). На их фазовых диаграммах существует несколько химических соединений.
Среди других полупроводниковых соединений можно упомянуть силициды и карбиды, среди которых наибольшее значение имеет карбид кремния SiC. Известно достаточно большое количество полупроводнико-
21
вых соединений переходных металлов, таких как арсениды, антимониды, силициды и т.д., но они не имеют особенного значения на практике.
Глава 3. Дефекты кристаллической решетки
3.1. Равновесные и неравновесные дефекты
Идеальная упорядоченность в кристалле является такой же абстракцией, как и идеальный газ, идеальный раствор и т. д. Даже при термодинамическом равновесии в кристаллах существуют дефекты кристаллической решетки. Более того, равновесные дефекты решетки являются неотъемлемыми компонентами кристалла, их существование термодинамически обязательно.
В реальных кристаллах, кроме равновесных дефектов решетки, существуют неравновесные дефекты, обусловленные неидеальными условиями происхождения и жизни кристалла. При помощи одного только теплового движения эти дефекты не могут полностью исчезнуть даже за весьма длительное время и оказываются как бы «замороженными». Зачастую неравновесные дефекты решетки стабилизируются электрическими, магнитными или упругими полями, возникающими при росте кристалла, фазовых превращениях или внешних воздействиях. Концентрацию неравновесных дефектов решетки удается существенно снизить путем совершенствования методов получения и обработки кристаллов.
Все так называемые «структурно-чувствительные» свойства кристаллических материалов определяются наличием в них равновесных и неравновесных дефектов решетки. Кристалл откликается на внешние воздействия изменением своей реальной структуры – рождением, перестройкой, движением и аннигиляцией дефектов решетки. Пластическая деформация кристаллов, например, полностью сводится к движению различных дефектов решетки. Тепловое расширение кристаллов вызывается не только ангармонизмом колебаний атомов, но и возрастанием плотности дефектов решетки. Электрический ток в ионных кристаллах обусловлен в основном миграцией заряженных дефектов решетки, важнейшие свойства полупроводников определяются содержанием электрически активных дефектов решетки и т. д.
22

3.2. Точечные дефекты кристаллической решетки
Вакансии, т. е. незанятые узлы решетки, и междоузельные атомы, т. е. атомы, внедренные в междоузлия, являются дефектами-антиподами: аннигиляция вакансии и междоузельного атома восстанавливает правильность кристаллической решетки: VA + Ai = AA .
Энергия образования вакансии определяется работой по переносу атома из узла решетки на поверхность кристалла и оказывается обычно порядка электрон-вольта. Энергия образования междоузельного атома определяется работой по переносу атома с поверхности кристалла в междоузлие и достигает нескольких электрон-вольт из-за большого вклада энергии локальных искажений, возникающих при внедрении атома в междоузлие.
Возможность существования дефектов со столь высокой энергией в условиях термодинамического равновесия объясняется тем, что образование точечных дефектов намного повышает энтропию кристалла. Из кристалла, содержащего N одинаковых атомов, можно удалить п атомов различными способами:
CNn = |
N! |
|
. |
|
n!(N −n)! |
||||
|
|
|||
По формуле Больцмана соответствующее приращение конфигурационной энтропии равно:
N! |
|
S = k ln n!(N −n)! . |
(3.1) |
Если энергия образования одного дефекта равна Е, то образование п дефектов при температуре Т изменяет свободную энергию кристалла на:
F =nE−T S . (3.2)
Минимизация свободной энергии (3.2) с учетом только конфигурационной энтропии (1) и использованием для оценки факториалов больших чисел в выражении (1) формулы Стирлинга ln(m!) ≈ mln(m) дает для равновесного числа точечных дефектов оценку:
n = N exp(−E kT) |
(3.3) |
Для меди, например, энергия образования вакансии составляет около 1 эв, а междоузельного атома – 3,4 эв. Следует отметить, что при выводе формулы (3.3) не было учтено изменение колебательной энтропии кристалла: вблизи точечных дефектов атомы колеблются с измененными частотами и амплитудами, что повышает энтропию кристалла на некоторую величину, пропорциональную числу дефектов. В формулу (3.3) должен
23
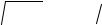
быть поэтому введен поправочный коэффициент, который, однако, не меняет результат по порядку величины.
Аналогичные расчеты можно сделать и в более сложных случаях. Рассмотрим, например, ионный кристалл. Здесь при образовании точечных дефектов должно соблюдаться условие электрической нейтральности кристалла в целом. Поэтому дефекты рождаются парами, либо вакансия и соответствующий междоузельный ион (дефект Френкеля), либо две вакансии с противоположным зарядом (дефект Шоттки), либо два междоузельных иона противоположного знака (антипод дефекта Шоттки). Для равновесной концентрации этих пар применима аналогичная (3.3) формула:
n = N1N2 exp(−E 2kT)
N1N2 exp(−E 2kT)
Здесь Е – энергия образования пары, N1 и N2 – число узлов, в которых могут находиться первый и второй партнеры пары. Поскольку энергия междоузельного иона намного превышает энергию вакансии, концентрация равновесных точечных дефектов в ионных кристаллах обычно определяется концентрацией дефектов Шоттки.
При образовании точечных дефектов происходят заметные смещения атомов, окружающих дефект. Атомы вокруг вакансии сдвигаются к центру вакантного узла. Междоузельный атом, наоборот, расталкивает окружающие атомы. В результате перенос атома на поверхность кристалла с образованием вакансии увеличивает объем кристалла менее чем на один атомный объем, а перенос атома с поверхности внутрь кристалла с образованием междоузельного атома обычно даже не уменьшает, а увеличивает объем кристалла. Сравнение плотности кристалла, определяемой путем измерения его макроскопических размеров, с рентгеновской плотностью, соответствующей среднему межатомному расстоянию (рентгенографической постоянной решетки), позволяет в принципе определить разность числа атомов и числа узлов, равную разности числа междоузельных атомов и числа вакансий. Упругое поле, возникающее вокруг точечных дефектов, оказывает определяющее влияние на взаимодействие точечных дефектов между собой и с другими дефектами решетки, особенно с дислокациями.
Взаимодействие точечных дефектов между собой приводит к возникновению различного рода комплексов. Реакции образования и распада комплексов можно рассматривать по аналогии с общими правилами реакций в газовых смесях или разведенных растворах. Простейшим примером может служить реакция образования двойных вакансий (бивакансий) в ме-
24
таллах: V + V =V2. Согласно закону действующих масс концентрации вакансий [V] и бивакансий [V2] связаны условием:
[V2 ]= K[V ]2 . |
(3.4) |
Константа равновесия К = αехр(U/kT), где α – число возможных ориентаций бивакансий в кристалле, равное половине координационного числа (т. е. числа ближайших соседей для данного узла), U – энергия связи вакансий в бивакансии. Обычно эта энергия связи заметно меньше энергии образования одиночной вакансии, и концентрация бивакансий не превышает концентрацию одиночных вакансий.
Дальнейшее объединение вакансий в зависимости от типа кристалла и внешних условий может дать плоские пустоты (атомной толщины) или трехмерное образование (каверна).
Переходя к междоузельным атомам, следует отметить, что это название само по себе не очень удачно. Междоузельные атомы далеко не всегда располагаются в характерных для решетки данного кристалла междоузлиях. В гранецентрированных кубических металлах, например, междоузельные атомы не внедряются ни в тетраэдрические (1/4, 1/4, 1/4), ни в октаэдрические (1/2, 1/2, 1/2) междоузлия, а вытесняют из узла какой-либо атом (рис. 7, а) и образуют с ним пару (гантель), ориентированную вдоль одного из направлений <100>. В этих металлах междоузельный атом может образовывать также краудион (сгущение): в направлении <110> на длине в несколько межатомных расстояний располагается один лишний атом
(рис. 7, б).
а) б)
Рис. 7. Варианты расположения междоудельных атомов в решетке: а – междоузельныйатомвгантельнойконфигурации(плоскость {110} ГЦК-
решетки); б – краудионнаяконфигурациямеждоузельногоатомавдольоси <110>. Показана плоскость {001} ГЦК-решетки
25

В кристаллах, состоящих из атомов нескольких сортов, точечными дефектами могут служить атомы, занимающие узлы чужой подрешетки (антиструктурные дефекты). Повышение концентрации таких дефектов соответствует начальной стадии разупорядочения.
Примесные атомы как внедренные в междоузлия, так и располагающиеся в узлах, сами являются точечными дефектами решетки и оказывают существенное влияние на концентрацию собственных дефектов решетки, повышая иногда концентрацию последних на несколько порядков. Так, например, в чистых кристаллах NaCl концентрация вакансий VNa и VCl определяется из закона действующих масс для реакции образования дефектов Шоттки:
[ Na][ Cl] |
( |
). |
(3.5) |
V V |
=Aexp |
−U kT |
|
Из условия электронейтральности:
V =V |
= Aexp −U 2kT |
(3.6) |
|
[ Na] [ Cl] |
( |
). |
|
Сопоставляя полученное выражение с формулой (3.3) и учитывая, что
вкристалле NaCl число узлов для Na и Cl одинаково, получим А = 1.
Вкристалле NaCl с примесью СаС12 ионы Са2+ замещают ионы Na+ и
должны быть дополнительно нейтрализованы катионными вакансиями VNa (образование междоузельных ионов Cl- энергетически менее выгодно). Ус-
ловие электронейтральности приобретает вид: [VNa] = [VCl] + [Ca2+].
Из уравнения (5) для концентрации катионных вакансий следует:
|
2+ |
|
= |
|
2+ |
|
+Aexp(−U 2kT). |
(3.7) |
[VNa]=1 2 Ca |
|
1 4 Ca |
|
|||||
По мере понижения температуры концентрация VNa приближается к концентрации примеси, а концентрация VCl становится ниже, чем в чистых кристаллах NaCl. Влияние примеси на концентрацию вакансий становится незаметным лишь в случае высоких температур и слаболегированных кристаллов, когда концентрация дефектов Шоттки превышает концентрацию примеси. Для сильнолегированных кристаллов, вплоть до температуры плавления, концентрация катионных вакансий равна концентрации двухвалентной примеси, а анионные вакансии практически отсутствуют.
Нейтрализация заряженных точечных дефектов возможна не только с помощью других дефектов решетки, но и с помощью соответствующих искажений электронной структуры кристалла – чаще всего электронов в зоне проводимости или дырок в валентной зоне. В первом случае заряжен-
26

ный точечный дефект служит акцептором (захват электрона освобождает в валентной зоне дырку, способную мигрировать через кристалл), во втором случае – донором (добавляется электрон в зоне проводимости). В полупроводниках подобным образом можно управлять величиной и типом проводимости.
В ионных кристаллах комплексы из точечных дефектов, электронов и дырок образуют различные центры окраски. Простейшим примером является F-центр – анионная вакансия, скомпенсированная электроном, размазанным по всем окружающим катионам.
3.3. Дислокации
Дислокации в кристаллах – специфические линейные дефекты, нарушающие правильное чередование атомных плоскостей. В отличие от точечных дефектов, нарушающих ближний порядок, дислокации нарушают дальний порядок в кристалле, искажая всю его структуру. Кристалл с правильной решеткой можно изобразить в виде семейства параллельных атомных плоскостей (рис. 8, а). Если одна из плоскостей обрывается внутри кристалла (рис. 8, б), ее край образует линейный дефект, называемый краевой дислокацией. На рис. 8, в показан другой тип дислокации – винтовая дислокация. Здесь ни одна из атомных плоскостей не оканчивается внутри кристалла, но сами плоскости лишь приблизительно параллельны и смыкаются друг с другом так, что фактически кристалл состоит из единственной винтообразно изогнутой атомной плоскости. При каждом обходе вокруг оси дислокации эта «плоскость» поднимается на один шаг винта, равный межплоскостному расстоянию.
Рис. 8. Схема расположения атомных плоскостей в кристалле:
а– в идеальном кристалле, б – с краевой дислокацией,
в– с винтовой дислокацией
27
Глава 4. Основные типы фазовых диаграмм
4.1. Диаграмма состояния однокомпонентной системы
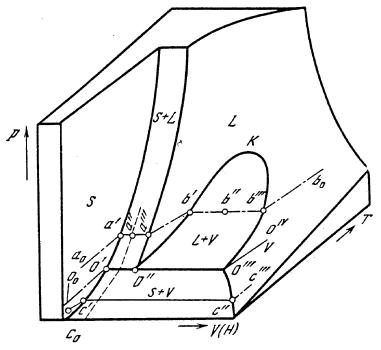
Однокомпонентную систему можно рассматривать как систему, где отсутствуют химические превращения, а возможны лишь фазовые переходы, т.е. изменения агрегатного состояния и кристаллической структуры рассматриваемого вещества. Для изображения областей существования фаз данного вещества обычно используется совокупность переменных Р, Т, V. Графическим изображением взаимозависимости этих переменных является объемная Р – Т – V-диаграмма (рис. 9).
Точка, представляющая в выбранной системе координат состояние и условия существования (т. е. Р, Т, V) системы, называется фигуративной точкой. Фигуративные точки, охватывающие все возможные сочетания Р, Т, V фазы, образуют некоторую поверхность, называемую полем существования фазы. Сочетания таких полей и образуют объемную Р – Т – V-диаграмму однокомпонентной системы.
Рис. 9. P—T—V диаграмма CO2
Рассмотрим схему объемной Р – Т – V-диаграммы для диоксида углерода (рис. 9). Она образована поверхностями солидуса S, ликвидуса L и
28
пара V. Поверхности L и V при температурах выше критической К непрерывно переходят одна в другую.
При переходе от одной фазы к другой удельные свойства изменяются скачкообразно, поэтому поверхности (поля) существования фаз сдвинуты друг относительно друга. Отсюда следует, что точки, не лежащие на поверхностях устойчивости фаз, не отражают состояния равновесия в системе. Исключением являются точки, соединяющие границы двух фазовых полей. Так, фигуративная точка, например b", лежащая на поверхности, соединяющей границы полей существования двух фаз, представляет средний мольный объем системы. Каждой же фазе соответствует своя фигуративная точка: L-фазе – точка b', а V-фазе – точка b'".
Важное значение имеют понятия сопряженных точек, сопряженных кривых, коннод. Фигуративные точки, представляющие при данной температуре объемы двух равновесных фаз, называются сопряженными точками, например точки а и а'", b' и b'", с' и с" и т. д.
Линии, соединяющие сопряженные точки, например а и а"', b' и b'", называются коннодами или нодами. Если состояние системы представлено, например, фигуративной точкой b", то она состоит из фаз Ь' и b'", относительные количества (т) которых определяются по правилу рычага на основании отношения длин отрезков b'b" и b"b'": тb'1тb'" = b"b'"/b'b".
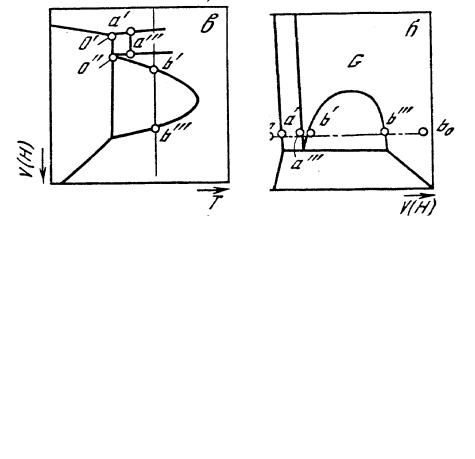
На рис. 10 изображены проекции объемной Р – Т – V-диаграммы, на плоскости Р – Т, Р – V и Т – V.
Тройная точка о на рис. 10, а представляет собой совмещение проекций фигуративных точек трех фаз: твердой (о'), жидкой (о") и паровой (о'"). Поэтому в тройной точке возможно существование одной, двух и трех фаз. Основными элементами P-T-диаграммы являются следующие: моновариантные линии двухфазного равновесия SL, LV и SV (линия АО); нонвариантная точка о пересечения трех двухфазных линий; критическая нонвариантная точка K; поля существования твердых, жидких фаз и пара.
Моновариантные двухфазные равновесия – S + V (сублимация), S + L (плавление), L + V (испарение) чистого компонента – представлены линиями сублимации (SV), плавления (SL), испарения (LV).
Наклон двухфазных линий определяется соотношением объемов равновесных фаз. Линия сублимации имеет положительный наклон, так как мольный объем пара значительно превосходит мольный объем твердой фазы и заканчивается в нонвариантной точке О.
29
а |
б |
в
Рис. 10. Проекции P—T—V диаграммы CO2: a – P—T-проекция; б – P-V-проекция; в – V—T-проекция
Линия испарения начинается в нонвариантной точке О и заканчивается в критической точке К, где фазы L и V оказываются идентичными. Наклон линий LV также положителен по той же причине.
Линия плавления начинается в нонвариантной точке О. Так как различие свойств твердой и жидкой фаз велико, то критическая точка кривой плавления неизвестна. Для подавляющего большинства веществ такой переход сопровождается увеличением объема, т. е. с увеличением давления температура плавления повышается. Однако для некоторых веществ (например, германия, кремния, галлия, арсенида галлия, чугуна, воды, висмута) мольный объем жидкой фазы меньше, чем твердой. Поэтому с повышением давления температура плавления таких веществ уменьшается.
Моновариантные линии двухфазных равновесий пересекаются в нонвариантной, или тройной точке О (рис. 10, а), где в равновесии существуют три фазы: S + L + V. Продолжения моновариантных кривых за тройную точку соответствуют метастабильным равновесиям и показаны на рис.
30
