
aaa24092012
.pdf3.2. Температура
Применяют две температурные шкалы – термодинамическую и Международную практическую, градуированные соответственно в градусах Кельвина (К) и в градусах Цельсия (0С). В Международной практической шкале температура замерзания и кипения воды при нормальном атмосферном давлении 1,013 105 Па равна соответственно 0
и 100 0С. Градус Цельсия равен градусу Кельвина.
Термодинамическая температура T и температура по Междуна-
родной шкале t связаны соотношением: |
|
|
T 273,15 |
t . |
(31) |
Температура T 0 Ê называется абсолютным нулем. |
Температура |
|
0 К недостижима, хотя приближение к ней сколь угодно близко считается возможным.
3.3. Масса молекул. Количество вещества
Массы атомов и молекул малы и составляют очень малые величины (так, масса молекулы воды составляет 3·10-26 кг). Поэтому для характеристики масс атомов и молекул применяются безразмерные величины, получившие название относительной атомной массы элемента и относительной молекулярной массы вещества.
Относительной атомной массой ( Ar ) элемента называется от-
ношение массы атома этого элемента к 1/12 массы атома 12С.
Относительной молекулярной массой (Mr ) вещества называ-
ется отношение массы молекулы этого вещества к 1/12 массы атома 12С.
Масса, равная 1/12 массы атома 12С, называется атомной едини-
цей массы (а.е.м.). Обозначим ее måä . Тогда масса атома будет равна
Ar måä , а масса молекулы mo Mr måä.
Числом Авогадро называется число атомов, содержащихся в 12 граммах углерода:
NA 6,022 1023 ì îëü 1.
30

Отношение числа молекул N к числу Авогадро NA называют
количеством вещества:
|
N |
. |
(32) |
|
|||
|
NA |
|
|
Единицей количества вещества является моль; в одном моле лю-
бого вещества содержится NA молекул.
Масса одного моля вещества называется молярной массой .
Молярная масса связана с массой одной молекулы m |
0 |
соотношением: |
|
|
|
m0NA |
|
(33) |
и измеряется в кг/моль. Молярные массы некоторых веществ:
|
|
êã |
, |
|
|
êã |
, |
|
|
êã |
. |
|
|
0,032 |
|
|
0,028 |
|
|
|
0,002 |
|
|||
|
|
|
|
|||||||||
|
O2 |
ì î ëü |
|
|
N2 |
ì î ëü |
|
|
H2 |
|
ì î ëü |
|
|
|
|
|
|
|
|
|
|
||||
Если m - масса всего вещества, то количество вещества ν в молях равно:
|
m |
. |
(34) |
|
|||
|
|
|
|
Объем одного моля газа (V0) при нормальных условиях (давление p0= 101,3 кПа; температура T0 273 K ) составляет 22,4·10-3 м3 . Поэтому
при нормальных условиях число молей газа, содержащихся в объеме V , равно:
V .
V0
3.4. Основное уравнение молекулярно-кинетической теории идеальных газов и уравнение состояния идеального газа
В молекулярно-кинетической теории используется модель идеального газа, в которой считают:
1)собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2)между молекулами газа отсутствуют силы взаимодействия;
3)столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
31
4) время столкновения молекул много меньше времени пробега молекулы между столкновениями.
Реальные газы при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу.
Рассмотрим идеальный газ, который в объеме V содержит N молекул, движущихся со скоростями 1, 2, , N . Соударения между моле-
кулами газа приводят к тому, что скорости молекул непрерывно меняют-
ся по величине и направлению. Средняя кинетическая энергия одной молекулы массы m0 :
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
2 |
|
|
|
||||||
|
|
|
|
|
EÊÈÍ |
|
|
O |
ÊÂ |
|
, |
(35) |
|||||||||||
|
|
|
|
|
|
|
2 |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
2 ... |
N |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где |
ÊÂ |
1 |
2 |
|
|
|
- средняя квадратичная скорость теп- |
||||||||||||||||
|
|
N |
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
лового движения молекул. Она связана с термодинамической темпе- |
||||||||||||||||||||||
|
ратурой T газа соотношением: |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
mO ÊÂ |
|
|
3 |
kT , |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
|
||||
где |
-23 |
- постоянная Больцмана. |
|
|
|||||||||||||||||||
k 1,38 10 |
Äæ / Ê |
|
|
||||||||||||||||||||
|
Отсюда: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
ÊÂ |
|
|
3kT |
. |
|
|
(36) |
|||||||||||
|
|
|
|
|
|
mo |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Учитывая, что постоянная Больцмана k , газовая постоянная R и
число Авогадро NA связаны соотношением k R , а молярная масса
NÀ
mO NÀ, получаем формулу для вычисления средней квадратичной скорости в виде:
ÊÂ |
3RT |
. |
(37) |
|
|
||
Основное уравнение МКТ имеет вид:
|
1 |
2 |
|
2 |
|
, |
(38) |
p |
|
n m0 êâ |
|
|
n EÊÈÍ |
||
3 |
3 |
32

где n N - концентрация молекул. Откуда, воспользовавшись формулой
V
|
mO |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
ÊÂ |
|
3 |
kT , легко получить полезное соотношение: |
|
||||||||
2 |
|
|
|
|
|||||||||
2 |
|
|
p nkT . |
(39) |
|||||||||
|
|
|
|
|
|
|
|
||||||
|
Уравнение состояния идеального газа или уравнение Мен- |
||||||||||||
делеева-Клапейрона: |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
pV |
m |
RT , |
(40) |
||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||
где R 8,31 |
Äæ |
- универсальная газовая постоянная. |
|
||||||||||
|
|
||||||||||||
|
|
ì î ëü Ê |
|
|
|
|
|
|
|||||
|
При постоянной массе газа m для двух различных состояний газа |
||||||||||||
можно записать объединенный газовый закон: |
|
||||||||||||
|
|
|
|
|
|
|
p1V1 |
|
p2V2 |
. |
(41) |
||
|
|
|
|
|
|
|
T1 |
|
|||||
|
|
|
|
|
|
|
|
T2 |
|
||||
3.5. Изопроцессы в газах
Изопроцессами называют процессы, протекающие в системе с неизменной массой при постоянном значении одного из параметров состояния системы.
1. T const– изотермический процесс (закон Бойля – Мариотта:
pV const ).
2. p const - изобарический процесс (закон Гей – Люссака:
V const ).
T
3. V const – изохорический процесс (закон Шарля:
p const ).
T
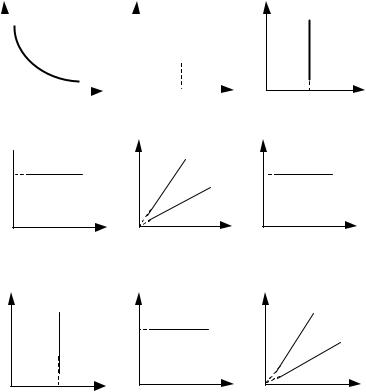
Ниже представлены графики всех изопроцессов в координатах p,V ; V,T и p,T (рис. 21).
Закон Дальтона: давление смеси газов равно сумме парциальных давлений p1, p2,...,pN входящих в нее газов
p p1 p2 ... pN . |
(42) |
33
p |
|
|
V |
|
|
|
p |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 V
p
0 V
0 |
T |
0 |
T |
|
|
||
V |
p |
p |
|
|
1 |
|
|
|
p2 |
|
|
0 |
T |
0 |
T |
|
|
||
|
p2 p1 |
|
|
p |
|
V |
|
p |
V1 |
|
|
|
|
|
|
|
|
|
|
|
V2 |
0 |
V |
0 |
T |
0 |
T |
|
|
|
|
|
V2 V1 |
Рис.21. Графики изотермического, изобарического и изохорического процессов
Парциальное давление – это давление, которое производил бы газ, входящий в состав смеси газов, если бы только он один занимал весь объем, занимаемый смесью при той же температуре.
4. ТЕРМОДИНАМИКА
Термодинамика – раздел физики, изучающий свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, а также процессы перехода между этими состояниями. Термодинамика устанавливает связи между макроскопическими параметрами системы, не вдаваясь при этом в микроскопическую структуру вещества.
34
4.1. Внутренняя энергия. Работа газа. Первый закон термодинамики
Внутренняя энергия U – это энергия теплового движения микрочастиц системы (молекул, атомов, электронов, ядер и т.д.) и энергия взаимодействия этих частиц. В термодинамике практический интерес представляет не само значение внутренней энергии, а ее изменение ΔU. Для одноатомного газа:
U |
3 |
|
m |
R T . |
(43) |
|
|
||||
2 |
|
|
|
||
Внутренняя энергия тела изменяется как при совершении работы A, так и при теплопередаче. Мера изменения внутренней энергии тела при теплопередаче называется количеством теплоты Q. Количество теплоты,
как и работа, измеряется в джоулях (Дж).
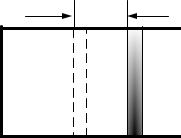
При сообщении газу в изобарном процессе некоторого количества теплоты он совершает работу по перемещению поршня на малое расстояние l (рис. 22):
A F l pS l p V , |
(44) |
где F - сила, действующая на поршень со стороны молекул газа, l - малое расстояние, на которое передвигается поршень, p- давление газа, V - изменение объема газа, S - площадь поршня.
ΔV  F
F
Рис.22. Работа газа при расширении
Таким образом, работа расширения газа равна произведению давления газа на изменение его объема.
При расширении газа изменение объема V 0, и работа A 0, при сжатии газа изменение объема V 0, и работа A 0.
35
Первое начало термодинамики:
Q U A |
(45) |
– количество теплоты Q , переданное системе, |
идет на изменение ее |
внутренней энергии U и на совершение работы A против внешних сил
– закон сохранения и превращения энергии применительно к термодинамическим процессам.
Количество теплоты Q считается положительным, если тепло передает-
ся из окружающей среды данной системе, механическая работа A считается положительной, если система производит работу над окружающими телами.
4.2.Изопроцессы в термодинамике
1.Изотермический (T const): U 0, Q A.
2. |
Изохорический процесс |
(V=const): A p V 0, Q U . |
3. |
Изобарический процесс |
( p const ): Q U A. |
4. |
Адиабатный процесс (Q 0 – процесс, при котором нет теплооб- |
|
мена с окружающей средой): |
A - U (работа против внешних сил со- |
|
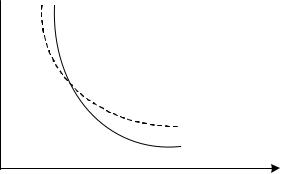
вершается за счет уменьшения внутренней энергии, газ охлаждается). Известно, что изотермический процесс подчиняется уравнению
pV const , а адиабатный процесс - уравнению pV const . На рис. 23
представлены для сравнения в координатах p,V графики изотермиче-
ского и адиабатного процессов. Так как коэффициент Пуассона 1, то адиабата идет круче изотермы.
p
адиабата
изотерма
pV const pV γ const
0 V
Рис.23. Графики изотермического и адиабатического процессов
36
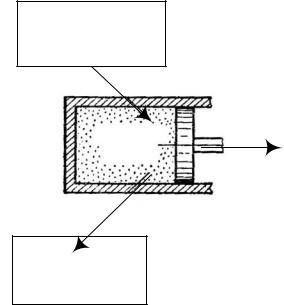
4.3. Тепловой двигатель
Тепловым двигателем называют периодически действующее устройство, которое превращает получаемую извне теплоту в механическую работу. Схематически тепловой двигатель изображен на рис. 24.
Нагреватель
T1
Q1
АПОЛЕЗН
Рабочее
тело
Q2
Холодильник
T2 T1
Рис.24. Схематическое представление теплового двигателя
Работа за цикл равна разности принятого газом от нагревателя количества теплоты Q1 и отданного газом холодильнику количества теплоты Q2 :
A Q1 Q2 .
Тогда КПД ( ) теплового двигателя определяется как:
|
A |
, или |
|
Q1 Q2 |
. |
(46) |
|
|
|||||
|
Q1 |
|
Q1 |
|
||
Самой "выгодной" с точки зрения КПД ( ) тепловой машиной является машина, работающая по циклу Карно, состоящему из двух изотерм и двух адиабат (рис.25). На участках 1-2 и 2-3 газ, расширяясь, совершает работу, а на участках 3-4 и 4-1 работа совершается над газом.
37
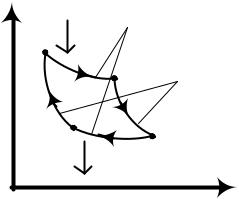
p |
Изотермы |
1 |
Q1 |
|
2 Адиабаты |
4 |
3 |
|
Q2 |
0 V
Рис. 25. Цикл Карно
В результате кругового цикла Карно внутренняя энергия системы не изменится и произведенная работа определяется площадью фигуры, заключенной внутри контура 1-2-3-4-1.
КПД тепловой машины, работающей по циклу Карно, вычисляется по формуле:
|
T1 T2 |
, |
(47) |
|
T1
где T1 - температура нагревателя, T2 - температура холодильника.
5.ЭЛЕКТРОСТАТИКА
5.1.Электрический заряд и его свойства. Закон Кулона
При трении диэлектрических тел о бумагу или мех (янтаря о шерсть, стекла о бумагу) наблюдается явление, получившее название электризации тел. Стекло или янтарь начинают притягивать мелкие твердые предметы. Говорят, что после такого механического трения тела становятся электрически заряженными и начинают взаимодействовать друг с другом (притягиваться или отталкиваться). Считается, что при этом на телах появляются электрические заряды. Условно принято считать, что заряженный при трении янтарь имеет отрицательный заряд, а заряженное при трении стекло – положительный заряд.
38
Электрический заряд – источник электромагнитного поля, связанный с материальным носителем. Вся совокупность электрических и магнитных явлений есть проявление существования, движения и взаимодействия электрических зарядов. Электрический заряд принято обозначать буквой q . Единица измерения электрического заряда – кулон
(Кл).
Заряд является фундаментальной характеристикой элементарных частиц.
Существует минимальный электрический заряд, называемый эле-
ментарным электрическим зарядом, он обозначается буквой e
(e 1.6 10 19Êë ). Электрон - носитель элементарного отрицательного электрического заряда (q e). Протон, позитрон (q e) – носители эле-
ментарного положительного электрического заряда. Любые заряженные тела имеют заряд, кратный элементарному, то есть электрический заряд дискретен: если число электронов на теле равно N , то суммарный элек-
трический |
заряд тела q Ne . Например, электрический заряд |
q 3.0 10 19 |
Êë в природе не существует. |
Обобщение опытных данных позволило Фарадею сформулировать один из фундаментальных законов физики – закон сохранения электрических зарядов: алгебраическая сумма электрических зарядов изолированной системы остается неизменной, какие бы процессы не происходили внутри системы (XVIII в.).
Точечный заряд – заряженное тело, размерами которого в условиях данной задачи можно пренебречь.
Закон Кулона: модуль силы взаимодействия между покоящимися точечными зарядами прямо пропорционален произведению модулей этих зарядов, обратно пропорционален квадрату расстояния между ними
и зависит от среды, в которой расположены заряды: |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
q1 |
|
|
|
q2 |
|
|
, |
(48) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
где |
- |
|
|
|
|
|
|
|
F 4 0 |
r2 |
|
||||||||||
относительная диэлектрическая проницаемость |
среды, |
||||||||||||||||||||
0 |
8.85 |
10 |
12 |
|
Ô |
- электрическая постоянная (полезно запомнить, что |
|||||||||||||||
|
|
|
|
ì |
|||||||||||||||||
1 |
9 |
10 |
9 |
|
ì |
|
). |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
4 0 |
Ô |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
39
