
- •Экзаменационный билет №22
- •2. Охарактеризуйте стабильность кислоты аскорбиновой в водном растворе.
- •3. Проведите сравнительную оценку различным способам стерилизации инъекционных растворов в промышленном производстве.
- •4. Дайте теоретическое обоснование организации рабочего места для изготовления приведенной выше прописи?
- •5. Виды шиповника как лекарственные растения - источники витамина с.
- •6. Производство ферментов имеет определенную специфику их получения с помощью биотехнологии.
- •Требования, предъявляемые к промышленному штамму
Экзаменационный билет №22
1. Комплекс испытаний, применяемых для оценки качества кислоты аскорбиновой в виде 5% раствора для инъекций, а также лекарственных форм внутриаптечного изготовления предусматривает применение в качестве реагентов соединений йода (растворы йода и калия йодата). В соответствии с химической структурой лекарственного средства дайте обоснование выбору и использованию данных реагентов в аналитическом контроле кислоты аскорбиновой:
Исходя их химического строения и свойств кислоты аскорбиновой, объясните способность ее реагировать с раствором йода и калия йодата.
Предложите другие реакции для идентификации лекарственного препарата и укажите степень их специфичности.
Рассмотрите применение 0,1М раствора йода в количественном определении кислоты аскорбиновой на примере лекарственной прописи состава:
Кислоты аскорбиновой 0,1
Кислоты никотиновой 0,05
Сахара 0,25
Предложите способ количественного определения кислоты никотиновой с учетом присутствия в смеси второго компонента.
Укажите значение молярной массы эквивалента для обоих веществ и формулы для расчета их содержания.
Объясните сущность йодатометрического титрования кислоты аскорбиновой в растворе для инъекций и необходимость применения при этом раствора формальдегида. Как отразится на результате анализа его отсутствие? Укажите значение молярной массы эквивалента.
Ответ
Acidum ascorbinicum
V itaminum
C
itaminum
C
Кислота аскорбиновая
Витамин С
Ascorbic Acid
Функциональные группы: лактонная группировка, спиртовые гидроксильные группы, енольные гидроксильные группы, два оптически активных атома углерода (хиральные центры).
Подлинность: 1. ИК-спектр (в сравнении со стандартом или со спектром в ФС).
2. УФ-спектр ( max зависит от рН среды: при рН 7 λ=265 nm, при рН 2 – λ=243 nm)
3. Тпл.=190°C-193°C ( с разложением). Из-за нестойкости препарата при нагревании для определения Тпл. его предварительно сушат при температуре 60°C в течение 2 часов. Скорость подъема температуры - 5°C в 1 минуту (по той же причине).
4. Удельное вращение (от +22° до +24°) - 2% водный раствор.
ГФ Х регламентирует в качестве испытания на подлинность следующие реакции:
5. Реакция «Серебряного зеркала»: к раствору препарата приливают раствор серебра нитрата, происходит окисление кислоты аскорбиновой до кислоты дегидроаскорбиновой). Образуется темный осадок металлического серебра.

6. Реакция с 2,6-дихлорфенолиндофенолятом. К препарату добавляют указанный реактив, происходит восстановление реагента и синее окрашивание реагента исчезает.

Нефармакопейные реакции:
Аскорбиновая кислота обладает восстановительными свойствами (за счет наличия в структуре молекулы двух енольных гидроксилов). Поэтому препарат вступает в ОВР с окислителями, в том числе с реактивом Фелинга, раствором йода и калием йодатом, которые окисляют кислоту до дикетоаскорбиновой.
7. За счет наличия енольных гидроксилов в молекуле аскорбиновой кислоты препарат дает кислую реакцию среды на лакмус. При действии разбавленными растворами щелочей она ведет себя как одноосновная кислота. Разрыва лактонного цикла в этих условиях не происходит, а образуются нейтральные монощелочные соли.
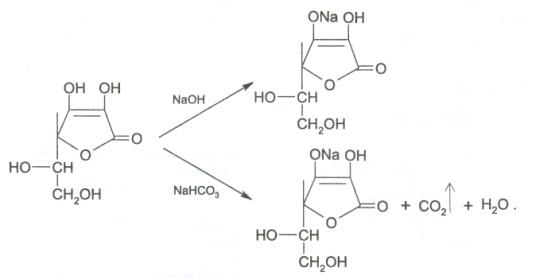
8. Кислотные свойства обуславливают реакцию образования аскорбината железа. Реактив – железа (II) сульфат, не обладающий свойствами окислителя. Происходит реакция солеобразования, наблюдается фиолетовое окрашивание.

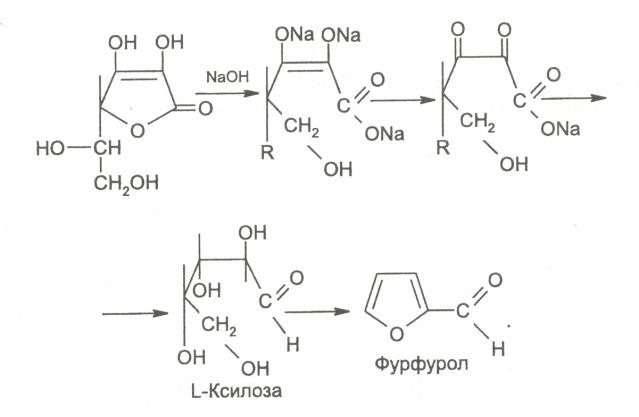
9. Взаимодействие с сильными щелочами. Происходит реакция гидролиза лактонного кольца и образование фурфурола.
По ГФХ препарат должен выдерживать испытание на органические примеси, сульфатную золу и тяжелые металлы.
Количественное определение: Йодатометрия (ГФ Х. Вариант прямого титрования)
Кислоту аскорбиновую титруют в присутствии калия йодида, небольшого количества кислоты хлороводородной и крахмала 0,1 н. стандартным раствором калия йодата до синего окрашивания:
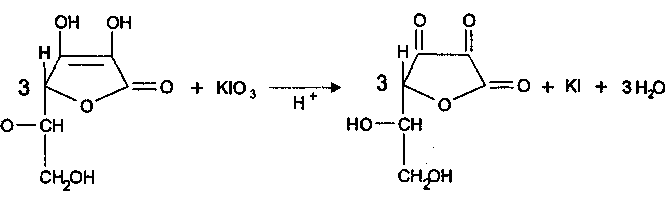
Избыточная капля титрованного раствора калия йодата реагирует с калия йодидом, выделяя йод, который указывает на конец титрования:
![]()
Возможные методы количественного определения аскорбиновой кислоты:
ОВР: йодометрия, индофенольный метод, йодхлорметрия, цериметрия. Кислотно-основные: алкалиметрия. Физико-химические: спектрофотометрия
Анализ смеси: Rp: Acidi ascorbinici 0,1
Acidi nicotinici 0,05
Sacchari 0,25
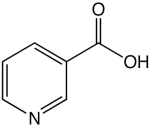
Реакция подлинности на кислоту никотиновую (ГФХ) 1. ИК-спектр (в сравнении со стандартом или со спектром в ФС). 2. УФ-спектр 3. Тпл.=234-238°C 4. Реакция разложения кислоты никотиновой путем нагревания с кристаллическим карбонатом натрия. Образуется пиридин, который легко обнаружить по характерному запаху:

5. Кислота никотиновая ввиду кислых свойств ее растворов обладает способностью образовывать нерастворимые соли (с ионами меди образуется осадок синего цвета – никотинат меди)

Если эту реакцию проводить в присутствии роданида аммония, то образуется тройное комплексное соединение, окрашенное в зеленый цвет. Если два ингредиента смеси обладают кислотными свойствами, а один из них является восстановителем, возможно их количественное определение в одной навеске. Для количественного определения ингредиентов проводят последовательное титрование вначале суммы кислот стандартным раствором натрия гидроксида. При этом значение величины z при расчете молряной массы эквиваленты М (1\z) для каждого вещества равно 1. Таким образом, Мэкв. (к-ты аскорбиновой)=176,13 г/моль, Мэкв.(к-ты никотиновой)=123,11 г/моль.

 +
NaOH
+
NaOH
 +
H2O
+
H2O
Метод – прямая алкалиметрия, вариант нейтрализации, основан на кислотных свойствах препаратов. Титрант – 0,1 Н NaOH
Индикатор – фенолфталеин. Затем йодометрическим методом в той же аликвотной доле определяют кислоту аскорбиновую.
Метод – прямая йодометрия, основана на окислительно-восстановительных свойствах препарата. Титрант – 0,1 н раствор йода. Индикатор – крахмал. В точке эквивалентности наблюдается окрашивание раствора за счет взаимодействия избыточной капли йода с крахмалом и образования комплекса синего цвета.

2С+1 – 2е =2С+2 (f=1/2)
Расчет содержания кислоты никотиновой проводят по разности титрований с учетом эквивалентных объемов титрантов, когда количество 0,1 Н раствора йода, пошедшего на титрование кислоты аскорбиновой, в 2 раза больше, чем количество 0,1 Н раствора натрия гидроксида, израсходованного на такую же массу кислоты аскорбиновой. При титровании кислоты аскорбиновой 0,1 Н раствором йода f=1/2. Мэкв.=88,06 г/моль. Это означает, что на одну и ту же аликвотную долю смеси будет расходоваться 0,1 н раствора йода в два раза больше, чем 0,1 н раствора натрия гидроксида. Поэтому при расчете количества раствора, пошедшего на титрование кислоты никотиновой, из общего объема 0,1 н раствора гидроксида натрия следует вычесть ½ объема 0,1 н раствора йода, ихрасходованного на титрование кислоты аскорбиновой.
![]()

где Х – масса определяемого вещества, г; V - объем титрованного раствора, мл; k – коэффициент поправки на титрованный раствор; P – общая масса порошка по прописи, г;
а – объем, мг, или масса, г, лекарственной формы, отобранный для анализа, k - поправочный коэффициент.
1 мл 0,1 н раствора йода соответствует 0,008806 г кислоты аскорбиновой.

1 мл 0,1 н раствора едкого натра соответствует 0,01231 г к-ты никотиновой.
В растворах аскорбиновая кислота легко окисляется, инъекционные растворы готовят на воде, насыщенной СО2, с добавлением стабилизаторов-антиоксидантов (натрия сульфит, натрия метабисульфит). В раствор аскорбиновой кислоты для инъекций добавляют натрия гидрокарбонат для нейтрализации кислой реакции среды, раздражающей ткани. При йодатометрическом методе количественного определения кислоты аскорбиновой в инъекционном растворе следует учитывать наличие антиоксидантов-стабилизаторов, которые будут реагировать с титрантом — КIO3. Поэтому вначале к раствору добавляют раствор формальдегида, связывающий антиоксиданты. Затем кислоту аскорбиновую титруют стандартным раствором калия йодата.

