- •Основные законы и формулы обучения физике Справочник для студентов всех форм обучения с техническим уклоном, преподавателей и абитуриентов.
- •Оглавление
- •Предисловие
- •Кинематика
- •2. Динамика
- •3. Законы сохранения
- •4. Законы вращательного движения
- •5. Гармонические колебания
- •6. Элементы молекулярной физики и термодинамики.
- •7. Элементы механики жидкостей
- •8. Элементы теории относительности
- •9. Электрическое поле
- •10. Электроёмкость. Конденсаторы
- •11. Законы постоянного тока
- •12. Магнитное поле тока. Электромагнитная индукция.
- •13. Магнитное поле катушки
- •14. Сила Лоренца
- •15. Электромагнитные колебания
- •16. Переменный ток
- •17. Оптика. Квантовая природа излучения.
- •18. Элементы физики атомного ядра.
18. Элементы физики атомного ядра.
 –радиус
ядра.
–радиус
ядра. –энергия
связи нуклонов в ядре.
–энергия
связи нуклонов в ядре.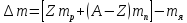 –дефект
массы ядра.
–дефект
массы ядра.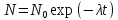 –закон
радиоактивного распада.
–закон
радиоактивного распада.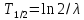 –период
полураспада.
–период
полураспада.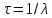 –среднее
время жизни радиоактивного ядра.
–среднее
время жизни радиоактивного ядра.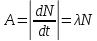 –активность
нуклида.
–активность
нуклида. –правило
смещения для α – распада.
–правило
смещения для α – распада.•
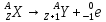 –правило
смещения для
–правило
смещения для
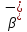 – распада.
– распада.•
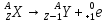 –правило
смещения для
–правило
смещения для
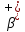 – распада.
– распада.•
 –символическая
запись ядерной реакции.
–символическая
запись ядерной реакции.
Библиографический список.
1. Трофимова Т. И. Курс физики. – М.: Высшая школа, 1997. – 542с.
Волькенштейн В. С. Сборник задач по общему курсу физики. – СП. – б.: Специальная литература, 1999. – 327 с.
Трофимова Т. И., Павлова З. Г. Сборник задач по курсу физики с решениями. – М.: Высшая школа, 2002. – 591 с.
Чертов А. Г., Воробьев А. А. Задачник по физике. – М.: Физматлит, 2003. – 639 с.
Савельев И. В. Курс общей физики ( Электричество и магнетизм ). – М.: АСТ, 2002. – 336 с.
Овчинников В. А., Демин В. Б., Познер А. А. Учебное пособие для поступающих в вузы. Екатеринбург: УМЦ – УПИ, 2003.
Першин В. К., Зольников П. П., Поленц И. В., Фишбейн Л. А., Хан Е. Б. Курс общей физики. Электродинамика. – Екатеринбург. «Издательство УМЦ – УПИ». – 2006. – 287 с.
Першин В. К., Зольников П. П., Фишбейн Л. А., Хан Е. Б., Чернобородова С. В. Курс общей физики. Механика. – Екатеринбург, «УрГУПС». – 2007. – 367 с.
Масленников Ю.И. Механика. Текстовые задания: сборник задач/ Ю.И.Масленников – Екатеринбург: УрГУПС, 2012 – 40с.
10. Масленников Ю.И. Электромагнетизм. Текстовые задания: Сборник задач / Ю.И. Масленников. Екатеринбург УрГУПС, 2012 – 40с
Приложение
Свойства
идеального газа:
1) все вещества состоят из атомов и
молекул, в ИГ размерами и взаимодействиями
молекул пренебрегают; 2) все направления
для движения молекул равновероятны; 3)
между соударениями молекула движется
прямолинейно; 4) длина свободного пробега
(l)
определяется размерами сосуда (l 1/n);
5) скорость молекул
1/n);
5) скорость молекул
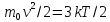 и
и ; 6) при одной температуре (T=)
кинетические энергии молекул одинаковы
; 6) при одной температуре (T=)
кинетические энергии молекул одинаковы
 значит
значит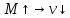 и наоборот.
и наоборот.
Основное
уравнение МКТ.
При упругом ударе о стенку импульс
молекулы
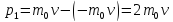 .
Импульс всех молекул
.
Импульс всех молекул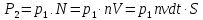 ,
гдеS
– площадь, n
– концентрация, V
– объем. В замкнутом объеме (кубе)
давление на площадь S
равно
,
гдеS
– площадь, n
– концентрация, V
– объем. В замкнутом объеме (кубе)
давление на площадь S
равно
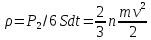 (основное уравнение МКТ). При умножении
левой и правой частей сначала на объем
одного моля
(основное уравнение МКТ). При умножении
левой и правой частей сначала на объем
одного моля ,
а затем на число молей
,
а затем на число молей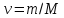 ,
получим уравнения Менделеева Клапейрона
(МК) для одного моля
,
получим уравнения Менделеева Клапейрона
(МК) для одного моля и нескольких молейV.
и нескольких молейV.
Из
уравнений МКТ и МК следуют газовые
законы. Далее используя приведенные
определения числа (количества вещества)
молей
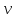 ,
молекулярной массыM,
числа молекул в одном моле
,
молекулярной массыM,
числа молекул в одном моле
 скорости молекул
скорости молекул , получим формулы для нахождения давления
, получим формулы для нахождения давления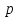 концентрацииn
и плотности
концентрацииn
и плотности
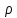 ;
числа молекулN,
числа молей
;
числа молекулN,
числа молей
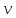 ,
молярного объема
,
молярного объема ,
коэффициента диффузии молекулД,
внутренней энергии
,
коэффициента диффузии молекулД,
внутренней энергии
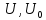 .
.
Энтропия.
Круговым процессом (или циклом) называется
процесс, при котором система, пройдя
через ряд состояний, возвращается в
исходное состояние. A
=
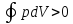 – прямой круговой цикл, идущий по часовой
стрелке. Прямой цикл используется в
тепловых двигателях, где работа
совершается за счет теплоты, полученной
извне.
– прямой круговой цикл, идущий по часовой
стрелке. Прямой цикл используется в
тепловых двигателях, где работа
совершается за счет теплоты, полученной
извне.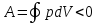 – обратный круговой цикл, идущий против
часовой стрелки. Обратный цикл используется
в холодильных машинах, где за счет работы
внешних сил теплота переносится к телу
с более высокой температурой. В результате
обратимого кругового процесса система
возвращается в исходное состояние и,
следовательно, полное изменение
внутренней энергии газа равно нулю.
Поэтомупервое
начало термодинамики
для кругового процесса
– обратный круговой цикл, идущий против
часовой стрелки. Обратный цикл используется
в холодильных машинах, где за счет работы
внешних сил теплота переносится к телу
с более высокой температурой. В результате
обратимого кругового процесса система
возвращается в исходное состояние и,
следовательно, полное изменение
внутренней энергии газа равно нулю.
Поэтомупервое
начало термодинамики
для кругового процесса
 .
Термический коэффициент полезного
действия для кругового процесса
.
Термический коэффициент полезного
действия для кругового процесса .
.
Изменение
энтропии.
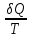 – приведенное
количество теплоты.
– приведенное
количество теплоты.
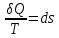 –это
функция состояния системы (энтропия).
Она не зависит от пути, каким система
пришла в это состояние, она характеризует
меру неупорядоченности системы.
–это
функция состояния системы (энтропия).
Она не зависит от пути, каким система
пришла в это состояние, она характеризует
меру неупорядоченности системы.
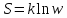 –энтропия,
где k
– постоянная Больцмана, w
– термодинамическая вероятность.
–энтропия,
где k
– постоянная Больцмана, w
– термодинамическая вероятность.
Принцип возрастания энтропии – все процессы в замкнутой системе ведут к увеличению энтропии. Любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает (второй закон термодинамики).
Изменение
энтропии при изотермическом процессе
(m
=,M
=, pV=
).
Используя определения – приведенное
количество теплоты и первое начало
термодинамики (dU
=
0, Q
= νRTdV)
– запишем
Q
= νRTdV)
– запишем

Изменение
энтропии при изохорическом процессе
(m=,
V=,
M=,p/T=).
Первое начало термодинамики –
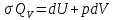 ;pdV
=
0, dU
=
ν
;pdV
=
0, dU
=
ν dT.
Для идеального газа
dT.
Для идеального газа
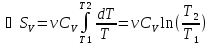 .
.
Изменение
энтропии при изобарическом процессе
(m
=, M
=,V/T
=). Первое начало термодинамики –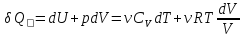 .
Приведенное количество теплоты
характеризует изменение энтропии
(δQ/T)
–
.
Приведенное количество теплоты
характеризует изменение энтропии
(δQ/T)
–