
- •Часть V. Химические системы
- •12. Строение атомов и природа химической связи
- •12.1. Электронные орбитали, подоболочки и оболочки атомов
- •12.2. Строение сложных атомов. Обоснование периодического закона д.И. Менделеева
- •12.3. Химическая связь
- •13. Химическое строение веществ. Закономерности
- •13.1. Теория химического строения
- •13.2. Важнейшие классы неорганических веществ
- •13.3. Энергетика химических реакций. Химическая кинетика. Теория активированного комплекса. Катализ. Цепные реакции
- •13.4. Необратимые и обратимые реакции. Химическое равновесие. Принцип Ле Шателье – Брауна
- •14. Основы органической химии
- •14.1. Общая характеристика и особенности органических веществ
- •14.2. Основы классификации органических веществ
- •14.3. Органические соединения – основа жизни: жиры, углеводы, белки
12.2. Строение сложных атомов. Обоснование периодического закона д.И. Менделеева
Количество электронов, находящихся в любой подоболочке или оболочке, не может превысить ее указанную выше «вместимость». Поэтому при возрастании порядкового номера атома и соответствующем увеличении числа электронов они должны заполнять все новые и новые подоболочки и слои. Заполнение орбиталей, подоболочек и оболочек при увеличении числа электронов идет в порядке возрастания энергии. При этом выполняются два правила Клечковского:
1)
в первую очередь заполняются подоболочки
с наименьшим значением суммы
![]() ;
;
2)
если у нескольких подоболочек значения
![]() одинаковы, то их заполнение происходит
в порядке возрастанияn.
одинаковы, то их заполнение происходит
в порядке возрастанияn.
В
соответствии с этими правилами очередность
заполнения подоболочек такова (над
обозначением каждой подоболочки в
скобках указано соответствующее
значение суммы
![]() ):
):
![]() (12.5)
(12.5)
Наглядно распределение электронов по состояниям можно представить с помощью энергетической диаграммы для сложных атомов, представленной на рисунке 12.1. На этом рисунке по вертикальной оси отложена энергия электронов, а в виде горизонтальных отрезков (энергетических уровней) показаны значения энергии электронов для первых подоболочек и оболочек. Эти разрешенные значения энергии образуют энергетический спектр электронов в сложных атомах.
Из схемы (12.5) и рисунка 12.1 следует, что вначале целиком заполняется первый слой, затем целиком второй слой, при заполнении последующих слоев ситуация усложняется. У третьего слоя вначале заполняются подоболочки 3s и 3p, затем подоболочка 4s четвертого слоя, и лишь затем завершается заполнение третьего слоя (подоболочки 3d). Далее продолжается заполнение четвертого слоя (подоболочка 4p), потом начинается заполнение пятого слоя (подоболочка 5s) и так далее в соответствии с правилами Клечковского.
П ри
распределении электронов по орбиталям
в пределах одной подоболочки выполняется
правило Хунда: в основном, то есть
невозбужденном, состоянии атома электроны
распределяются по орбиталям так, чтобы
их суммарный спин был максимален.
ри
распределении электронов по орбиталям
в пределах одной подоболочки выполняется
правило Хунда: в основном, то есть
невозбужденном, состоянии атома электроны
распределяются по орбиталям так, чтобы
их суммарный спин был максимален.
Рисунок 12.1 - Энергетический спектр электронов в сложных атомах. Над каждым энергетическим уровнем указано обозначение соответствующей подоболочки и ее «вместимость» (в скобках). Чтобы подчеркнуть, что уровень 4s имеет энергию, меньшую энергии уровня 3d, уровень 4s продлен пунктиром. Аналогично показано, что уровень 5s ниже уровня 4d.
Электронная
конфигурация атома, то есть распределение
электронов по подоболочкам и оболочкам
в атоме описывается символическими
формулами, где последовательно
перечисляются целиком и частично
заполненные подоболочки и в виде верхних
индексов указывается количество
электронов в каждой из этих подоболочек.
Например, электронная конфигурация
атома кислорода, имеющего восемь
электронов, описывается формулой
![]() .
.
Далее приведены формулы электронной конфигурации и распределения электронов по орбиталям для первых 11 элементов таблицы Д.И. Менделеева (нижний левый индекс указывает порядковый номер Z элемента в таблице Д.И. Менделеева, то есть число протонов в ядре атома и число электронов, окружающих ядро).
1 .
Водород1H:
формула
.
Водород1H:
формула
![]() ,
,
р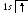 аспределение
по состояниям или
аспределение
по состояниям или
2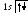 .
Гелий2He:
формула
.
Гелий2He:
формула
![]() ,
распределение по состояниям
,
распределение по состояниям
3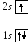
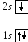 .
Литий3Li:
.
Литий3Li:
![]() ,
распределение по состояниям
или
,
распределение по состояниям
или
4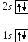 .
Бериллий4Be:
.
Бериллий4Be:
![]()
Р еакционная
способность атомов, то есть их способность
соединяться с другими атомами и создавать
молекулы, определяется наличием
неспаренных электронов, то есть
электронов, находящихся на орбиталях
в одиночестве. Валентность атома, то
есть способность образовывать определенное
число связей с другими атомами,
определяется числом неспаренных
электронов. Из приведенных примеров
видно, что водород и литий – одновалентные
элементы, а у гелия нет неспаренных
электронов, поэтому он химически инертен,
то есть не способен образовывать
молекулы. Так и есть в действительности.
Но из распределения электронов по
состояниям может показаться, что и
бериллий химически инертен, хотя в
действительности он способен к химическим
реакциям и проявляет валентность, равную
двум, например, при образовании оксидаBeO.
Это объясняется тем, что за счет небольшого
увеличения энергии атом бериллия может
перейти в возбужденное состояние Be*,
в котором один из электронов из подоболочки
2s
переходит на одну из орбиталей подоболочки
2p
и электроны по орбиталям распределяются
так:
еакционная
способность атомов, то есть их способность
соединяться с другими атомами и создавать
молекулы, определяется наличием
неспаренных электронов, то есть
электронов, находящихся на орбиталях
в одиночестве. Валентность атома, то
есть способность образовывать определенное
число связей с другими атомами,
определяется числом неспаренных
электронов. Из приведенных примеров
видно, что водород и литий – одновалентные
элементы, а у гелия нет неспаренных
электронов, поэтому он химически инертен,
то есть не способен образовывать
молекулы. Так и есть в действительности.
Но из распределения электронов по
состояниям может показаться, что и
бериллий химически инертен, хотя в
действительности он способен к химическим
реакциям и проявляет валентность, равную
двум, например, при образовании оксидаBeO.
Это объясняется тем, что за счет небольшого
увеличения энергии атом бериллия может
перейти в возбужденное состояние Be*,
в котором один из электронов из подоболочки
2s
переходит на одну из орбиталей подоболочки
2p
и электроны по орбиталям распределяются
так:
Возбужденный атом Be* имеет два неспаренных электрона, что и объясняет его двухвалентность. Спины обоих неспаренных электронов сонаправлены, чтобы в соответствии с правилом Хунда общий спин электронов атома был максимален.
5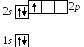 .
Бор5В:
в основном состоянии
.
Бор5В:
в основном состоянии
![]()
П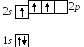 ри
таком распределении электронов бор был
бы одновалентным, но в действительности
он проявляет валентность, равную трем,
как, например, в оксидеB2O3.
Так получается из-за перехода атома в
возбужденное состояние B*,
в котором распределение электронов
таково:
ри
таком распределении электронов бор был
бы одновалентным, но в действительности
он проявляет валентность, равную трем,
как, например, в оксидеB2O3.
Так получается из-за перехода атома в
возбужденное состояние B*,
в котором распределение электронов
таково:
При этом атом бора имеет три неспаренных электрона, что и объясняет его трехвалентность.
6 .
Углерод6С:
в основном состоянии формула
.
Углерод6С:
в основном состоянии формула
![]() и распределение электронов с учетом
правила Хунда таково:
и распределение электронов с учетом
правила Хунда таково:
П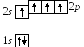 ри
этом углерод двухвалентен, как, например,
при образовании одного из оксидов –
угарного газа СО. Однако, чаще углерод
четырехвалентен, как в другом оксиде –
углекислом газе СО2.
Валентность, равная четырем, опять же
достигается за счет перехода атома в
возбужденное состояние C*
с четырьмя неспаренными электронами:
ри
этом углерод двухвалентен, как, например,
при образовании одного из оксидов –
угарного газа СО. Однако, чаще углерод
четырехвалентен, как в другом оксиде –
углекислом газе СО2.
Валентность, равная четырем, опять же
достигается за счет перехода атома в
возбужденное состояние C*
с четырьмя неспаренными электронами:
Так теория строения атомов объясняет тот факт, что некоторые элементы способны проявлять различную валентность.
7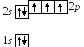 .
Азот7N:
.
Азот7N:
![]() :
:
При таком распределении электронов азот трехвалентен.
8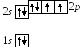 .
Кислород8О:
.
Кислород8О:
![]() :
:
Эта схема объясняет двухвалентность кислорода.
9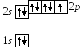 .
Фтор9F:
.
Фтор9F:
![]()
Фтор одновалентен.
1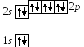 0.
Неон10Ne:
0.
Неон10Ne:
![]()
Видно, что у неона целиком заполнены первые две оболочки: K-оболочка и L-оболочка, и нет неспаренных электронов. Поэтому неон химически инертен.
1 1.
Натрий11Na.
У натрия начинается заполнение
3s-подоболочки
M-слоя.
Формула
1.
Натрий11Na.
У натрия начинается заполнение
3s-подоболочки
M-слоя.
Формула
![]() ,
схема распределения электронов такова:
,
схема распределения электронов такова:
Очевидно, что натрий одновалентен.
Химические
свойства атомов в основном определяются
наличием (или отсутствием) неспаренных
(валентных) электронов, располагающихся
в частично заполненных (валентных)
подоболочках. У многих элементов
валентные подоболочки находятся на
большем среднем расстоянии от ядра, чем
целиком заполненные, и поэтому называются
внешними. Очень важно, что строение
валентных оболочек повторяется. Так у
лития и следующего через восемь номеров
натрия имеется по одному валентному
электрону, находящемуся в s-подоболчке
(2s
у Li,
3s
у Na).
Еще через восемь номеров находится
калий 19K,
у которого электронная конфигурация
такова:
![]() ,
то есть также имеется один неспаренный
электрон во внешнейs-подоболочке.
Далее период повторяемости несколько
изменяется: с интервалом в 18 номеров
следуют рубидий 37Ru
и цезий 55Cs,
у которых также имеется по одному
валентному электрону во внешней
s-подоболочке.
Следующий аналогичный элемент – франций
87Fr
– находится в таблице Д.И. Менделеева
через 32 номера после цезия. Сходство в
строении электронных оболочек приводит
к сходству химических свойств перечисленных
элементов: все они одновалентные металлы,
имеют высокую реакционную способность,
образуют гидроксиды LiOH,
NaOH,
KOH,
…, которые все являются сильными
щелочами, и т.д. Эти элементы называют
щелочными металлами и объединяют в
подгруппу Iа
первой группы, иногда добавляя в нее
также и водород, имеющий единственный
электрон в s-подоболочке.
,
то есть также имеется один неспаренный
электрон во внешнейs-подоболочке.
Далее период повторяемости несколько
изменяется: с интервалом в 18 номеров
следуют рубидий 37Ru
и цезий 55Cs,
у которых также имеется по одному
валентному электрону во внешней
s-подоболочке.
Следующий аналогичный элемент – франций
87Fr
– находится в таблице Д.И. Менделеева
через 32 номера после цезия. Сходство в
строении электронных оболочек приводит
к сходству химических свойств перечисленных
элементов: все они одновалентные металлы,
имеют высокую реакционную способность,
образуют гидроксиды LiOH,
NaOH,
KOH,
…, которые все являются сильными
щелочами, и т.д. Эти элементы называют
щелочными металлами и объединяют в
подгруппу Iа
первой группы, иногда добавляя в нее
также и водород, имеющий единственный
электрон в s-подоболочке.
Такая же периодичность свойств наблюдается у других элементов, объединяемых в соответствующие группы и подгруппы. Например подгруппу IIа образуют так называемые щелочноземельные металлы: бериллий 4Be, магний 12Mg, кальций 20Ca, стронций 38Sr, барий 56Ba, радий 88Ra. У всех этих элементов, как у рассмотренного выше бериллия, в основном состоянии имеется по два электрона во внешней s-подоболочке. Сходство строения валентных оболочек приводит к тому, что у щелочноземельных металлов также схожи и химические свойства.
Еще одним ярким примером повторяемости химических свойств являются благородные (инертные) газы, фактически не образующие химических соединений. К ним относятся уже рассмотренные выше гелий 2He, неон 10Ne, а также аргон 18Ar, криптон 36Kr, ксенон 54Xe, радон 86Rn. У всех этих элементов нет частично заполненных подоболочек, то есть нет неспаренных электронов, что и объясняет их химическую инертность.
Таким образом, теория строения сложных атомов объясняет периодический закон Д.И. Менделеева.
