
- •Содержание
- •I.Определение эффективности периодической ректификационной колонки с насадкой
- •III Получение фенола и ацетона кислотным разложением гидропероксида изопропилбензола
- •1. Теоретическое обоснование процесса
- •2. Экспериментальная часть
- •3 Обобщение и оценка результатов
- •1. Теоретические основы
- •Катализ окисления солями переходных металлов
- •2. Экспериментальная часть
- •3. Обобщение и оценка результатов
- •Лабораторная работа №3
- •1.Теоретическое обоснование процесса
- •2 Экспериментальная часть
2 Экспериментальная часть
2.1 Характеристика сырья и материалов
Исходное соединение - гидроперекись изопропилбензола; растворитель - о-ксилол; основные продукты разложения - фенол и ацетон. Основные характеристики этих веществ приведены в таблице 1 [2].
Таблица 6 — Физико-химические свойства исходных веществ и продуктов реакции кислотного разложения гидропероксида изопропилбензола
|
Вещество |
ММ |
Плотность, г/см3 |
Tпл, °С |
Tкип, °С |
|
Гидропероксид |
152 |
1,062 |
---- |
53\0,1мм 60\0,2мм |
|
Изопропилбензол |
120,2 |
0,862 |
-96,9 |
150,5 |
|
О-ксилол |
106,17 |
0,881 |
-47,8 |
139,1 |
|
Фенол |
94,11 |
1,071 |
43,2 |
182,2 |
|
Ацетон |
58,08 |
0,792 |
-95,3 |
56,2 |
О-ксилол — применяют в качестве растворителя лакокрасочных материалов, высо¬кооктановой добавки к авиационным бензинам. Используют для получения фталевого ан¬гидрида [3].
Фенол (бензенол) - кристаллическое вещество. Плохо растворяется в воде. Сильнейший антисептик. При попадании на кожу вызывает ожоги. С водой образует кристалло¬гидрат. Используется в производстве фенолоальдегидных полимеров, е-капролактама, бисфенола А, нитро- и хлорфенолов, фенолсульфокислот, красителей и лекарственных препаратов. Эфиры фенола - присадки к топливам и смазочным маслам [3].
Ацетон (диметилкетон, пропанон) - бесцветная легко испаряющаяся жидкость со специфическим запахом. Смешивается с водой и многими органическими растворителями в любых соотношениях. Горюч. Получают гидратацией пропина, окислением изопропило-вого спирта или разложением гидропероксида изопропилбензола (кумола). Применяют как растворитель лаков и красок, используют в производстве метилметакрилата, киноплёнки, ацетатного шёлка, бездымного пороха и лекарственных препаратов. Применяют в качестве растворителя ацетилена (в баллонах) [3].
2.2 Методика эксперимента
Реакция осуществляется в трёхгорлой колбе, снабжённой мешалкой, обратным хо¬лодильником, капельной воронкой и термометром. Постоянная температура от 35 до 40 С поддерживается с помощью водяной бани. Разложению подвергается раствор гидропероксида в о-ксилоле с массовой долей 20 % до остаточной массовой доли гидропероксида не более 1%.
Вначале готовится раствор гидропероксида изопроиилбензола (ГПИПБ) в о-ксилоле заданной концентрации 20 % и заносится в капельную воронку. В реактор вносятся 20 см о-ксилола и 0,5 см3 серной кислоты. Включают воду на обратный холодильник, колбу помещают в предварительно нагретую, до температуры от 35 до 400С и включают мешалку. При достижении в колбе температуры 35 °С медленно капают раствор гидропероксида из капельной воронки с тем, чтобы температура не превышала 40 °С. Окончание подачи гидропероксида считается началом опыта.
Перед началом опыта и через 30 минут отбирают пробы на содержание гидропероксида через боковой отвод при остановленной мешалке. Проба отбирается массой от 0,2 до 0,5 г в предварительно взвешенную на аналитических весах колбу.
Разложение считается законченным при остаточной массовой доле гидропероксида менее 1 %. По окончании реакции снимают водяную баню, выключают перемешивание и воду на холодильник. Проводится анализ реакционной смеси на содержание фенола и ацетона.
2.3. Методика определения органических гидропероксидов (см. с 13)
d=152![]() 0,1/2
0,1/2![]() 1000=0,0076
1000=0,0076
![]()
Масса исходной смеси 26,2г
Масса гидропероксида в исходной смеси:
mгип=22,6*1,062=5,8г
Количество гидропероксида в исходной смеси
nгип= mгип/Мгип=5,8/152,19=0,038моль
2.4. Методика определения ацетона в реакционной смеси разложения ГПИПБ [1]
Так как ацетон мешает определению фенола бромированием, то предварительно он отгоняется с водяным паром из подщелаченной реакционной смеси. В круглодонную колбу на 250 см3 берут массу от 2,5 до 3,0 г реакционной смеси, приливают 25 см3 NaOH массовой долей 10 % и 20 см3 дистиллированной воды и присоединяют к шариковому холодильнику. Коническую колбу на 150 см3, содержащую 25 см3 раствора C(NH2OH-HC1) = I моль/дм3 и несколько капель индикатора бромфенолового синего, ставят под алонж так, чтобы его конец опускался в жидкость. Содержимое круглодонной колбы нагревают до кипения и ведут отгонку ацетона с водяным паром в течение 30 минут после начала кипения.
По окончании отгонки, содержимое приёмника оттитровывают раствором С(КОН) = 0,1 моль/дм3 до изменения цвета от жёлтого до синего.
Определение содержания ацетона в реакционной смеси.
Расчёт ведётся по формуле, %:
W= (V—Vx)*t*С*100
g
V- объём щелочи, израсходованный на титрование анализируемой пробы, см3 (V=7,3см3);
Vх - объём щелочи, израсходованный на титрование холостой пробы (Vx=0,3 см3);
t - титр раствора щелочи (t = 1,55 см3);
С - масса ацетона, соответствующая 1 см3 раствора C(NaOH) = 0,1 моль/дм3, г/ см3 (0,0058 г/см3);
g - масса навески анализируемой пробы, г (g=2,72г.)
W=![]() =2,317%
=2,317%
Масса о-ксилола:
mо-кс=Vо-кс*![]() о-кс=20*0,881=17,604%
о-кс=20*0,881=17,604%
Масса ацетона:
mац=![]() =
=![]() =0,931
=0,931
2.5 Методика определения фенола в реакционной смеси разложения ГПИПБ
Определение фенола в подщелаченной реакционной смеси, оставшейся после отгонки ацетона, основано на реакции бромирования избытком брома. Бром получают при подкислении бромид-броматного раствора. Непрореагировавший бром определяется ио-дометрически.
Остаток после отгонки ацетона охлаждают и количественно переносят в мерную колбу на 250 см3 , содержимое колбы доводят дистиллированной водой до метки и перешивают. Берут пипеткой 10 см3 этого раствора и помещают в коническую колбу на 250 см3, затем приливают 50см3 водного раствора бромид-бромата калия и 6 см3 концентрированной соляной кислоты. Закрыв колбу пробкой, тщательно перемешивают её содержимое и оставляют на 30 минут при комнатной температуре. После этого приливают 15 см3 раствора KI, снова энергично перемешивают и оттитровывают выделившийся йод раствором гипосульфита в присутствии раствора крахмала
Определение содержания фенола в реакционной смеси
Расчёт ведётся по формуле. %:
W=![]() ,
,
где W-массовая доля фенола,%
Va- объём раствора гипосульфита натрия, пошедший на титрование холостого хода, см3 (Va=29 см3);
Vb- объём раствора гипосульфита натрия, пошедший на титрование пробы, см3(Vb=24,1 см3)
T- титр раствора C(Na2S2O3) = 0,1 моль/дм3 (t = 0,939)
g - масса навески анализируемой пробы, г(g=2,72г.)
0,0016-масса фенола, соответствующая 1 см3 раствора гипосульфита натрия, г/см3
W=![]() =6,9%
=6,9%
Масса фенола:
mф=![]() =
=![]() =2,7741
г
=2,7741
г
3.5 Материальный баланс и безразмерные характеристики процесса
Данные по материальному балансу представлены в таблице 2.
Таблица 7 - Материальный баланс кислотного разложения гидропероксида на фенол и ацетон
|
Компонент
|
ММ |
Пропущено |
Получено |
| |||||||
|
Масса, г
|
Мас. доля
|
Количество вещества, моль
|
|
Масса, г |
Мас. доля. |
Количество вещества, моль
|
| ||||
|
Гидропероксид |
152 |
6,97 |
17,33 |
0,046 |
|
0,096 |
0,24 |
0,0006 |
| ||
|
Изопропилбензол |
120,2 |
15,65 |
38,91 |
0,13 |
|
15,65 |
38,91 |
0,13 |
| ||
|
О-ксилол |
106,16 |
17,604 |
43,76 |
0,166 |
|
17,604 |
43,76 |
0,166 |
| ||
|
Фенол |
94,11 |
- |
- |
- |
|
2,77 |
6,9 |
0,029 |
| ||
|
Ацетон |
58,08 |
- |
- |
- |
|
0,93 |
2,317 |
0,016 |
| ||
|
Не индифи- цированные продукты |
- |
- |
- |
- |
|
3,174 |
- |
- |
| ||
|
Всего |
- |
40,224 |
100,00 |
|
|
40,224 |
100,00 |
|
| ||
Степень превращения ГПИПБ;
XГПИПБ
= =
=![]()
![]() 100=98,69%
100=98,69%
Выход ацетона;
А![]() =
=![]() =
=![]() =34,78%
=34,78%
Вывод фенола:
![]() =
= 100=63,04%
100=63,04%
Селективность:
![]() =
=![]() =35,27%
=35,27%
![]() =
=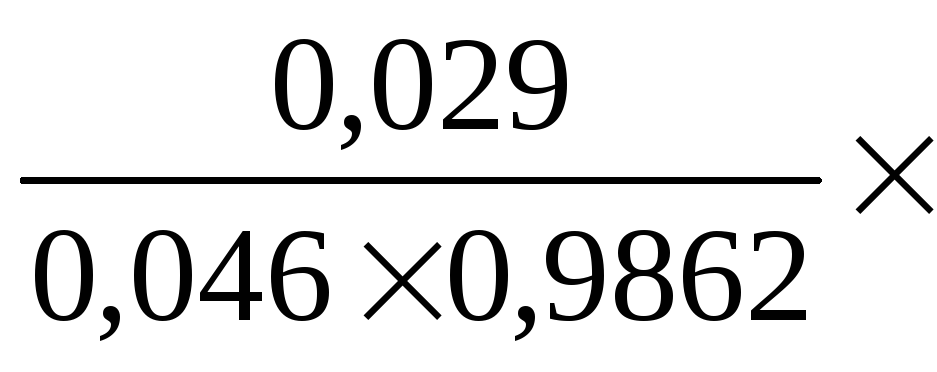 100=63,9%
100=63,9%
Теоретические расходные коэффициенты:
![]()
![]() т
гипериза/т ацетона
т
гипериза/т ацетона
![]()
![]() т гипериза/т ацетона
т гипериза/т ацетона
Практические расходные коэффициенты
![]() т гипериза/т ацетона
т гипериза/т ацетона
![]() т гипериза/т ацетона
т гипериза/т ацетона
Выводы:
На основе опытных данных был составлен материальный баланс процесса и найдены такие его безразмерные характеристики как степень превращения гидропероксида и селективность, и выход по ацетону и фенолу. Следует отметить практически 100% степень превращения гидроперекиси.
Заключение
В ходе лабораторного практикума изучены процессы окисления изопропилбензола в гидроперекись, разложение гидропероксида изопропилбензола на фенол и ацетон, и определение эффективности периодической ректификационной колонки с насадкой и разделение сложных смесей методом ректификации.
При проведении процесса дегидрирования изопропилового спирта был получен ацетон, проведен титриметрический анализ, на основе полученных данных составлен материальный баланс, и рассчитаны основные безразмерные характеристики процесса: степень превращения, селективность, выход.
При проведении каталитического окисления изопропилбензола была получена гидроперекись, определено его содержание в оксидазе в различные моменты времени реакции, и построена кривая накопления гипериза.
При проведении процесса кислотного разложения гипериза на фенол и ацетон определено содержание фенола и ацетона в полученной реакционной смеси, составлен материальный баланс процесса, и рассчитаны основные безразмерные характеристики процесса: степень превращения, селективность, выход.
Расхождение между лабораторными и промышленными показателями объясняется погрешностями в выполнении работ, несовершенством лабораторных установок.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
Тепеницина Е. П. Химическая технология органических веществ. Методические указания к лабораторным работам –Ярославль: ЯПИ, 1993-132 с.
Гороновский М. Т. Краткий справочник по химии / М. Т. Гороновсий, Ю. П. Назаренко, Е.Ф. Неркач.-Киев: Наукова Думка, 1974-992 с.
Коган В.Б. Равновесие между жидкостью и паром. Т. 2. / В.Б. Коган, В.М. Фридман, В.В.Кафаров.- М.Л, : Наука, 1966.-1422 с.
