
- •Содержание
- •I.Определение эффективности периодической ректификационной колонки с насадкой
- •III Получение фенола и ацетона кислотным разложением гидропероксида изопропилбензола
- •1. Теоретическое обоснование процесса
- •2. Экспериментальная часть
- •3 Обобщение и оценка результатов
- •1. Теоретические основы
- •Катализ окисления солями переходных металлов
- •2. Экспериментальная часть
- •3. Обобщение и оценка результатов
- •Лабораторная работа №3
- •1.Теоретическое обоснование процесса
- •2 Экспериментальная часть
1. Теоретические основы
Реакция окисления органических веществ относится к реакциям радикального цепного вырожденно-разветвлённого окисления, состоящая из трёх основных
стадий [1]
I стадия: Зарождения (инициирования) цепей
В общем случае зарождение цепи в отсутствие инициирующих добавок происходит при взаимодействии растворённого в системе кислорода с наиболее слабыми C-H связями окисляющегося органического соединения по бимолекулярной:
R H+O2
R+HO2
H+O2
R+HO2
и тримолекулярной:
2 RH+O2
2R+H2O
RH+O2
2R+H2O
В начальном периоде окисления скорость зарождении мала, что может быть одной из причин длительных периодов индукции при окислении органических соединений.
II стадия: Продолжения цепи.
Цепная реакция окисления в жидкой фазе осуществляется как чередование двух элементарных актов:
R +O2
RO2
+O2
RO2
R O2+RH
ROOH+R
O2+RH
ROOH+R
Алкильный радикал R очень быстро и практически без энергии активации реагирует с кислородом, превращаясь в перекисный радикал RO2. Образовав перикисный радикал образует пероксид и радикал R, две эти реакции составляют звено цепи.
III стадия: Обрыва цепи
Гибель свободных радикалов в цепных жидкофазных реакциях происходит в результате взаимодействия двух радикалов с образованием молекулярных продуктов:
R +R
Rt1
+R
Rt1
R +RO2
Rt2
+RO2
Rt2
R O2+RO2
Rt3
O2+RO2
Rt3
Реакция радикально-цепного окисления очень чувствительна к добавкам ингибиторов – веществ, тормозящих окисление, обрывая цепи по реакции с перекисными радикалами. К таким ингибиторам относятся фенолы и ароматические амины.
Катализ окисления солями переходных металлов
При окислении органических соединений в качестве катализаторов обычно используют органические соли кобальта, марганца, железа и других переходных металлов. Катализаторы ускоряют окисление и сокращают период индукции. Они позволяют проводить окисление при более низкой температуре, тем самым уменьшая количество нежелательных продуктов.
При окислении алкилбензолов влияние ароматического кольца сказывается как на повышении реакционной способности соседнего с ним атом углерода боковой цепи, так и на стабильности образующихся гидропероксидов. Реакция их образования протекает в жидкой фазе уже при температуре от 1000С до 1200С.
Наиболее стабильны гидропероксиды трет-алкилбензолов.
Глубина окисления алкилбензола или концентрация гидропероксида в оксидате ограничивается развитием побочных реакций. В начале гидропероксид получается с выходом почти 100% , но затем выход постоянно падает, и все больше возрастает образование побочных продуктов. В связи с этим окисление ведут до степени превращения трет-алкилбензолоа: от 0.25 до 0.30 или до массовой доли гидропероксида в реакционной массе около 30% .
2. Экспериментальная часть
2.1 Характеристика сырья и материалов.
Цель работы: каталитическое окисление ароматических углеводородов и построение кривой накопление гидропероксидов.
Физико-химические свойства исходных веществ и продуктов реакции представлены в таблице 1. [2]
Таблица 4 – Физико-химические свойства исходных веществ и продуктов реакции.
|
Вещество |
Молярная масса, г/моль |
Плотность, г/см
|
Температура кипения, °С |
Растворимость | |
|
|
|
|
|
в воде |
в углеводородах |
|
Изопропилбензол
Л |
120,19 |
0,8618 |
152,39 |
н.р. |
сп., э., бз. |
|
Гидропероксид изопропилбенз-ола Бензола |
136 |
1,062 |
100,5 |
— |
— |
2.2 Методика проведения эксперимента.
Окисление проводится согласно методике, на лабораторной установке, представленной на рисунке 3.
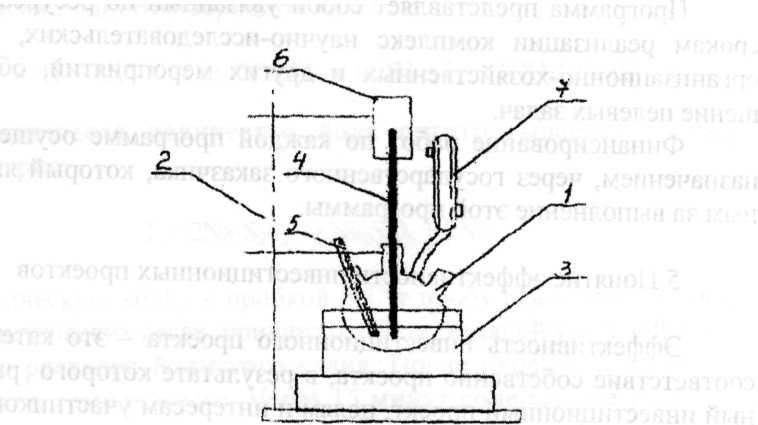
Рисунок 3 – Схема установки каталитического окисления ароматических углеводородов.
1 – трехгорлая колба ( реактор); 2 – штатив; 3- водяная баня ; 4- мешалка; 5 – термометр; 6 – электродвигатель; 7 – обратный холодильник.
Залить в реактор 20 см изопропилбензола, внести навески катализатора и добавок, ввести необходимое количество катализатора - гидроперекись изопропилбензола из капельницы (осторожно, при попадании гидроперекиси изопропилбензола на плитку, может произойти вспышка и взрыв). Загрузка в реактор производится через боковой отвод, который затем закрывается пробкой.
Взвесить колбы с пробками для анализа на аналитических весах. Колбы должны быть чисто вымыты, высушены и подписаны.
Подставить предварительно нагретую до нужной температуры масленую баню под реактор и включить перемешивание.
Через пять минут, когда температура в реакторе достигает заданной, включить подачу кислорода. Скорость кислорода регулируется зажимом на линии реометра. Начало подачи кислорода считается началом опыта.
Через каждые 30 минут производить отбор проб на содержание гидроперекиси капилляром через боковой отвод при остановленной мешалке. Проба отбирается массой от 0,2 до 0,3 г в предварительно взвешенную колбу и взвешивается на аналитических весах. Анализ проводится в промежуток времени до следующего отбора.
Время реакции, скорость подачи кислорода и температуру бани отмечать в рабочем журнале каждые 30 минут, концентрацию гидропероксида каждый час. Время реакции в минутах считается от начала реакции.
2.3 Методика проведения анализа
Определение органических гидропероксидов основано на реакции окисления ими иодистоводороднои кислоты:
ROOH + 2KI + 2СН3СООН -» ROH +12 + 2СН3СООК + Н20.
Выделившееся количество йода оттитровывается раствором гипосульфита натрия:
I2+ 2Na2S203 -» Na2S406 + 2NaI.
В коническую колбу с пробкой берут пробу реакционной смеси от 0,2 до 0,3 г на аналитических весах, приливают 10 см ледяной уксусной кислоты и 1,5 см3 50 %-го раствора йодистого калия. После перемешивания содержимого колбу ставят в темное место. Через 15 минут содержимое колбы разбавляют 25 см3 дистиллированной воды. Выделившийся в результате реакции йод оттитровывают раствором в присутствии раствора крахмала до обесцвечивания.
По окончании процесса.
Расчёт содержания гидропероксида в пробе
W=![]() ,
,
где W – массовая доля гидропероксида , %
Va – объём раствора тиосульфата натрия, пошедший на титрование пробы, см3
Vb - объём раствора тиосульфата натрия, пошедший на титрование холостой пробы, см3
t – титр раствора тиосульфата натрия с концентрацией 0,1 моль/дм3
d – массагидропероксида кумола, соответствующая 1 см3 раствора
С (Na2S2O3 )=0,1 моль/дм3
Масса гидропероксида кумола составит:
d=![]() ,
,
где Мг.м. – молярная масса гидропероксида, г/моль
z – число эквивалентности, равное числу электронов, участвующих в реакции.
d=![]() =7,6*10-3
=7,6*10-3
