
- •Руды и минералы Au, Ag. Формы нахождения Au, Ag в рудах
- •Iтонкое измель флотация, обжиг
- •II. Плавка золотой головки
- •III. Гидрометаллургичесие методы
- •III. Влияние температуры
- •IV. Вязкость пульп
- •I. Метод перколяции
- •II. Метод кучного выщелачивания
- •III. Цианирование перемешиван
- •Au содовый раствор
- •Сжатый |оздах
- •1 Раствор
- •Сдира,н
- •Цианирование
- •Поведение примесей Au
- •III. Цианирование перемешиван
1 Раствор
Рис. 30.
Выделение Аи из цианистых растворов
[Ag(CN)2]"
[Cu(CN)3]2
4-
Cau=2 - 15 мг/л. CCN"= 0.02-0.05%
[Fe(CN)6]
[Pt(CN)6]2
и
др.
Такой раствор поступает на извлечение Аи. Методы извлечения Аи:
Цементация Zn ;
S = 1-6 М2
Цементация А1 (если растворы богаты по Ag);Сорбция на смолах (в технологии сорбционного выщелачивания); 6. Электролиз (если Cau>0.541 г/л).
Цементация цинком
Физико-химические основы:
2[Au(CN)2]+ +Zn = [Zn(CN)4f'+2Au; E=-0.54 * (-1.26)= 0.82 В >0;
2 [Ag(CN) 2J~ +Zn = [Zn(CN)4]2' + 2Ag ; E=-0.31 * (-1,26)=0.95 В >0.
9au(CN)-4/AU = - 0.54 В; ф Ag(CN)~4/Ag = - 0.3 1 B; ф zn(CN) 4/Zn = - 1 -26 B; ф Cu(CN) 4/cu = - 0.87 B; ф Pt(CN) 4/Pt = - 0.68 B.
Т.к. E>0, то процесс термодинамически возможен.
Kpau=1 .0-1023; Kp Ag=l .4-1032
Большие значения Кр свидетельствуют о высокой степени протекания реакции, т.е. Аи и Ag из раствора могут быть выделены практически нацело. На практике, остаточная концентрация Аи в растворе 0,002 * 0,03 мг/л. Как видно из ф, кроме Аи и Ag будут цементироваться и другими металлами.
Теоретический расход Zn 0,19г. на 1г. Аи.
Практически, расход Zn в 10-И 00 раз больше, что связано с протеканием побочных реакций (1,2)
Zn + 2Н20 + 4CN = [Zn(CN)4]2' + Н2 + 201Г (1)
ф °n(CN)2 4/Zn = " 1.26 В
ф °2Н20/Н2+20Н -2е = " 0.83 В Поэтому процесс термодинамический возможен.
2Zn + 02 + 2Н20 + НС1\Г = 2[Zn(CN)4]2' + 40Н (2)
ф °02+2H20/40H -4е = + 0.40 В
Процесс термодинамический возможен. Иногда в производственных растворах появляется белый осадок.
Это нарушение технологического процесса, т.к. осадок обволакивает частички Zn и закрывает доступ Аи комплекса к Zn. Zn(OH)2 и Zn(CN)2.
Установлено, что они образуются при недостатке CN* в растворе и защитной щелочи.
Zn ► Zn02~ Н2° ( Zn(OHh:
I
Zn(OH)2 + [Zn(CN)4]2' > 2Zn(CN)2 + 20И.
Для предотвращения протекания данных реакций и выпадения белых осадков, необходимо концентрацию CN" и защитной щелочи поддерживать на достаточно высоком уровне.
Если растворы не деаэрированы, т.е. Со2= 3-8 мг/л, то концентрация: CCn = 0.05 - 0.08 %;
Сон"(защ.щ.) = 0.05 -0.08 %.
Если растворы хорошо деаэрированы, т.е. Сог=0.5 - 2 мг/л, то концентрация:
Ccn =0.02 -0.03 %;
С()Н (защ. щ.) =0.02-0.03 %.
Электрохимическая природа цементации
Исследованиями установлено, что процесс цементации носит электрохимический характер. Процесс можно представить как работу мк/г.э., где на анодных участках идет концентрация Zn, а на катодных участках восстановление Аи, 02 и Н20.
Исследованиями установлено, что скорость процесса лимитируется величиной предельного тока, т.е. диффузией ионов [Au(CN)2]~ к поверхности Zn.
Поэтому все факторы, ускоряющие диффузию, будут служить ускорением процесса цементации Аи целиком:
величина катодной поверхности Zn;
интенсивность перемешивания;
температура.
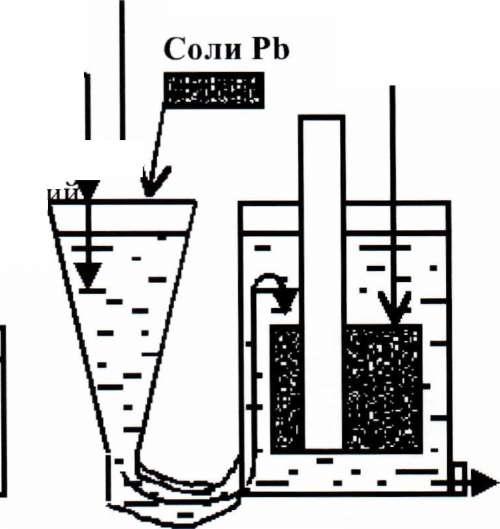
Но на практике пользуются не всеми факторами. Для увеличения величины поверхности Zn использовали вместо Zn стружки высокодисперсную Zn пыль.
Увеличение величины катодной поверхности достигается введением в раствор РЬ (в виде солей). РЬ - губка на поверхности, Zn - частицы.
Pb(NO,) + Zn Zn (N03)2 + Pb
Pb
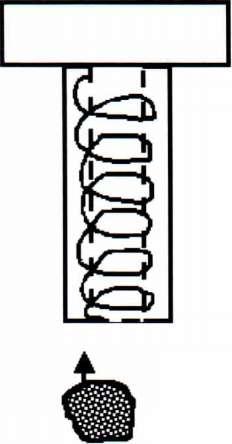
Перемешивание, с одной стороны, ведет к увеличению диффузии ионов [Au(CN)2] - к поверхности Zn, с другой стороны, - к протеканию побочных реакций. Чаще всего побочные реакции протекают интенсивнее, чем основная.
Поэтому процесс цементации ведут без перемешивания методом перколяции, т.е. просачиванием Au-содержащсго раствора через слой Zn порошка. Повышение температуры увеличивает скорость как основных, так и побочных реакций, резко увеличивая расход Zn- пыли. Поэтому процесс ведут при обычной температуре. Для снижения расхода Zn на практике производят перед осаждением деаэрацию растворов, т.е. С02 в растворе и поддерживают на определенном уровне концентрацию CN" и защитной щелочи.
Влияние примесей на процесс
Все примеси, присутствующие в растворе отрицательно влияют на процесс цементации.
Если много Си - образуется пленка.
Если много As, Sb - образуют- ся нерастворимые пленки, сульфиды на поверхности Zn.
Если щелочные металлы - образуют ZnS на поверхности Zn.
Поэтому при высоком содержании примесей в растворе процесс цементации ведется в специальном режиме.
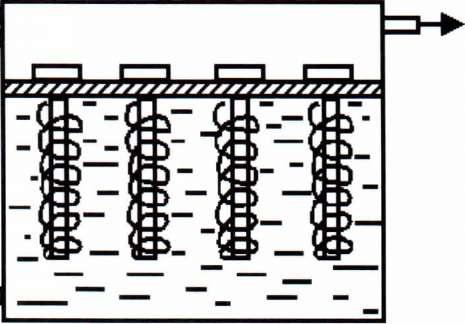
Практика цементации
Направляемые на цементацию цианистые растворы не должны содержать взвеси, т.к. она может оседать на поверхности Zn-порошка, снижая степень цементации Аи.
Для удаления взвесей раствор отправляют на осветление, которое проводят:
в мешочных фильтрах;
в рамных-вакуумных фильтрах;
в пресс-фильтрах;
в песочных фильтрах;
свечевые (патронные фильтры).
патрон
к
вакууму
Статический
воздух
раствор
раствор
Рис.
31.
СЬ
из раствора в газовую фазу
\
г
Вакуум-
насос
Осветленный
ш Аи-содержащ, раствор
Чан
поиемный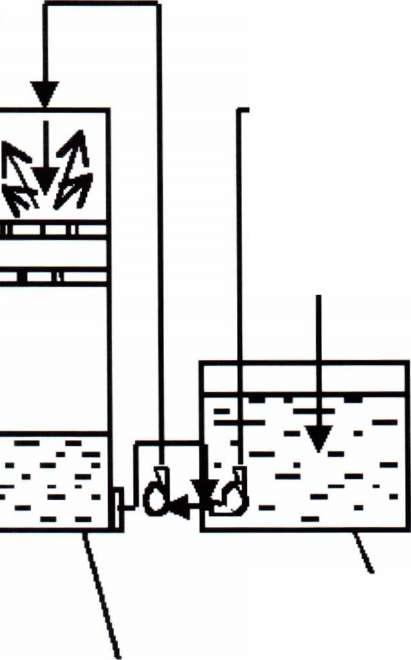
Деаэратор или вакуум-рессивер
Рис. 32.
Съем Au-осадка (споласкивание) ведется 1-2 раза в месяц. Конечной продукцией процесса данной операции являются Au-Zn осадки, или
Слой
Zn,
max Аи
Au+Zn-осадки на специализированный завод на извлечение Аи. Глубина осаждения Аи: EAu > 99.5 * 99.9%. Согласно техническим условиям: Аи - 3 ч- 35 %; Zn - 20 ч- 60 %; РЬ - до 10 %; Си-0.1 +30%.
Переработка Au-Zn осадков (цианшламов)
Полученные в процесс цементации Аи Au-Zn-осадки имеют следующие
вещества.
Состав: Au, Ag, Zn, Pb, ZnC03, Zn(OH)2, Zn(CN)2, Си; соединения Си; соединения Fe, As, Sb, CaO, Si02 (напр. FeAsC>4, Ca3(AsC>4)2) и др.
Химический состав: (лекция 12).
Au-Zn-осадки перерабатывают с целью получения более богатого, обогащенного по Au, Ag продукта.
Методы переработки
1. Кислотный
Включает выщелачивание в слабом растворе H2SC>4, сушку и прокалку кека и плавку полученного продукта.
Выщелачивание
Применяется 10-15% раствор H2S04- Процесс ведут в чанах, футерованных РЬ, оборудованых мощной вытяжной вентиляцией. Подогрев до 50-70°С.
Выщелачивание ведут либо с воздушным, либо с механическим перемешиванием.
Zn + Н 2SO 4 = ZnSO 4 + Я гО
ZnCO з + И 2SO 4 = ZnSO 4 + Н 2СО 3
Zn (CN )2 + Н 2SO л = ZnSO 4 + 2HCN t
рь + h2so4 = Pbso 4 4 +я.
т.е. РЬ остается в Au-Ag-остатке.
Соединения As, Sb растворяются и выделяются летучие соединения: AsH4 -токсичные.
Получают раствор и остаток. После фильтрации и промывки остатка кек обогащен в 3 - 5 раз (до 10), т.е. Сди=30 -50%;
CZn=20 - 60% | до 4 - 6%.
Сушка и прокалка
Промытый кек укладывают в протвини и ставят в электрическую полочную печь, подсушивают и затем прокаливают при t=500-700°C. При этом происхо- дит окисление ЦМ до оксидов (и Fe), которые легко могут быть ошлакованы при последующей плавке. Полученный продукт10% раствор I ^ H2SO4
Кислотное выщелачивание Пульпа | г\
Хлорирование Фильтрация
Аи- содержащий Аи" содержащий кек
раствор (AgCI)
J \ 21
J 30
I 71
Yv =От 103
Ag
-
высокой Отработанный пробы электролит
Рис. 33.
Метод позволяет получать высокой чистоты Аи и высокую степень извлечения в = 99.5н-99.8%.
А и + Cl2+ HCl —> H[AuCl4]; Ag + Cl2—> AgCI;
Си + Cl2 > CuCl2;
Zn + CI2 > Zn CI 2 и т.д.
H[AuCl4] + SO2 —> Au + HCl + H20 + H2S04.
Полученный тем или иным методом Au-Ag-сплавы поступают на аффинаж Аи и Ag
.
Растворы, шлаки и другие продукты поступают на дополнительное обезблагораживание, и в отдельных случаях на комплексное извлечение цветных металлов.
Технология сорбционного выщелачивания золотосодержащих руд
Рассмотренная выше нами схема традиционного цианирования руды с последующей фильтрацией пульп и цементацией Аи из раствора не применима для переработки отдельных типов руд (глинистых-окисленных, шламистых) и углистых. При переработке глинистых руд возникают трудности на переделе фильтрации. Скорость фильтрации низка, возникает необходимость установки большого числа фильтров. При переработке углистых руд растворенное цианировании Аи может сорбироваться углистыми сланцами, содержащимися в руде, и уходить с хвостами цианирования. При этом резко снижается извлечение Аи. Для переработки таких руд, а также чисто кварцевых руд на фабриках большой производительности разработана и внедрена в СССР в 1968 г. новая безфильтрационная технология сорбционного выщелачивания.
В настоящее время около 1 /3 фабрик работает по данной технологии.
Сущность метода сорбционного выщелачивания заключается в том, что в аппарате одновременно с цианированием происходит извлечение Аи из раствора сорбцией на смолах или активированных углях. В этом же аппарате происходит и разделение обеззолоченной руды, обеззолоченного раствора и насыщенного по Аи сорбента.
анионит
руда
NaCN—^J-^
Рис.34
Метод позволяет повысить извлечение Аи, сократить продолжительность цианирования, исключить фильтрацию. При переработке углистых руд Аи сорбируется на более сильном сорбенте, вводимом в аппарат, а не на углистых сланцах
.
Процесс сорбционного выщелачивания может вестись с использованием 2-х типов сорбентов:
- смолы (ионит);
-активированный уголь за рубежом.
Сорбционное ващелачивание с применением смол.
Свойства смол-сорбентов
Смолами, или ионитами называют твердые, высоко-молекулярные соединения, которые благодаря наличию в них ионогенных групп способны обмениваться с раствором электролитов положительно- или отрицательно заряженными ионами в эквивалентных количествах. Иониты получают путем полимеризации стирола и дивинилбензола. Макромолекула смолы может быть представлена из длинных полимерных ДВБ (сшивок) тем прочнее смола, тем меньше она растягивается при погружении ее в раствор. При синтезе на матрицу смолы вводят фиксированные ионы (ионы положительного знака). В роли таких ионов выступают производные аминов.
NH4+ — R NH3+ Е NH+
R1 -
R2 ^ NH2 — N
Для компенсации зарядов фиксированных ионов в матрицу смолы вводят противоионы в эквивалентном количестве (ОН", СГ). При погружении смолы в раствор противоионы теряют связь и переходят в раствор. А на их место из раствора заходят другие ионы того же знака.
Ионит, способный к обмену анионами, называется анионитом. Если фиксированный ион имеет отрицательный заряд, и противоион- положительный, то такие иониты называются катионитами. Условно матрицу смолы обозначают буквой R. Рисунок 35.
Рис. 35.
ROH или RC1 — анионит
HR или NaR — катионитАи в цианистом растворе находится в виде комплекса[Аи(СК)2]". Значит для его извлечения используют анионит.
Обменная реакция:
R О Н + [А и (С N ] = R [А и (С N J + О Н Свойства смол.
К смолам предъявляются следующие требования : 1. Набухаемость
-при погружении в раствор, зерна смолы увеличиваются в объеме за счет проникновения молекул воды вглубь зерна смолы;
-размер сухих зерен 0.5-3.0 мм;
-при погружении в раствор, они увеличиваются в объеме от 1,5-2,0 до 8- 10 раз. -коэффициент набухания :
V ,
тг нао
наб j г
сух
Коэффициент набухаемости играет определенную роль для диффузии ионов внутри зерна смолы.
3. Обменная емкость4. Различают:
-полная обменная емкость ПОЕ;
-равновесная обменная емкость по данному иону;
-равновесная обменная емкость.
РОЕ.(Рабочая емкость - в реальных условиях -характеризует содержание Аи в реальных условиях).
ПОЕ — такое количество ионов, которое может поглотить единица веса или единиц объема смолы; мг-экв / гсух. см.; мг-экв / мл наб. См.;мг / г, мг /■ Например, для смолы АМ-2Б ПОЕ=130 мл/г.
РОЕМе — характеристика для любого металла или иона и характеризует такое количество металла или иона данной природы, которое может поглотить смола в равновесии. Для смолы АМ-2Б РОЕАи= 8+12 мг/г (из промышленных растворов).
РОЕ — характеризует обменную емкость, достигаемую в реальном процессе. Обычно это 70 + 90% от РОЕ. 3. Селективность смолы Это отношение:
ПОЕ
4. Пористость смол
Смолы делают двух типов:
гелеобразной структуры;
макропористые.
Они различаются размером внутренних пор и удельной поверхностью. У гелеобразной структуры удельная поверхность до (0.1+0.2) 1 м /г смолы. У макропористых удельная поверхность до 30 + 70 м /г смолы.
В настоящее время синтезируют в основном макропористые сорбенты, т.к. они характеризуются большей скоростью процесса. Для АН-25 удельная поверхность 53 м2/г.
Механическая прочность;
Смолы должны иметь высокую механическую прочность к ударной нагрузке и механическому истиранию, с тем, чтобы потери их от механических нагрузок были минимальны.
Регенерируемость смолы;
Смола должна не только хорошо поглощать ионы, но также обладать способностью к регенерации с целью многократного использования в замкнутом цикле - сорбция - регенирация - сорбция.
Загруженная в процесс смола работает несколько лет.
В настоящее время широко используется смола АМ-2Б.
"А" — анионит;
"М" — макропористый;
"2"— вторая модификация;
"Б" — бифункциональный, т.е. фиксированные ионы 2-х типов:
50% — третичных аминов;
50% - четвертичных аммониевых оснований.
Формула АМ-2Б:
/ CH2HN(CH3)2C1 = NH+ R ^^(СНз)2Ы(СНЗ)2С1 — N+
CI - противоион.
Использование сорбции
Возможны следующие случаи:
1. Для извлечения золота из цианистого раствора после фильтрации (т.е. вместо цементации цинка). Данный метод гораздо дороже, чем цементация цинком, поэтому не используется;
2. Использование смолы для извлечения Аи из пульпы после завершения цианирования (искл. фильтрация). Но метод не использует возможности ускорения процессов;
5. Сорбционное выщелачивание, т.е. совмещение цианирования с сорбцией Аи в одном аппарате. При этом:
-исключается фильтрация; -сокращается время цианирования; -повышается извлечение Аи из раствора.
Закономерности сорбционного выщелачивания
При сорбционном выщелачивании протекают 2 процесса:
Цианирование;
Сорбция растворения Аи и примесей на смоле.
А и + NaCN + 02 + Н20 > Na[Au(CN)J + Н202 + NaOH
В растворе: [Au(CN)2]"; [Ag(CN)2]; [Cu(CN)3f ;[Fe(CN)6]4"; [Zn(CN)4f;
[Ni(CN)4]2"; CN"; CNS"; S02"3; S2"; S02"4 ; ОН" и т.д. При наличии смолы происходит сорбция:
RCl + [Au(CN)2]~ = R[Au(CN)2] + CI,
Аналогично: R[ Ag(CN)2 ]; R2[Cu(CN)3]; R4[ Fe(CN)6 ]; R2[Zn(CN)4];
R2[Ni(CN)4]; RCNS; ROH; R2S03; R2S; R2S04 и т.д.
Смола поглотит до 130 мг/г. Из них только 5 + 12 мг/г Аи. Термодинамическая равновесная величина описывается изотермой сорбции. Рисунок 36.
