
- •Руды и минералы Au, Ag. Формы нахождения Au, Ag в рудах
- •Iтонкое измель флотация, обжиг
- •II. Плавка золотой головки
- •III. Гидрометаллургичесие методы
- •III. Влияние температуры
- •IV. Вязкость пульп
- •I. Метод перколяции
- •II. Метод кучного выщелачивания
- •III. Цианирование перемешиван
- •Au содовый раствор
- •Сжатый |оздах
- •1 Раствор
- •Сдира,н
- •Цианирование
- •Поведение примесей Au
- •III. Цианирование перемешиван
II. Плавка золотой головки
Плавка на всркблей (Аи- РЬ сплав);
Плавка на Си - сплав;
Бесколлекторная плавка.
Использует способность РЬ растворять в себе Аи. Для ведения плавки Аи- головка смешивается с РЬО, который является основным поставщиком РЬ.
Для восстановления РЬ вводится восстановитель (коксик, крахмал,костная мука).
2РЬО + С ->2РЬ + С02 Для ошлакования основных примесей вводятся флюсы(сода, бура, стекло). Установлено, что целесообразнее всего вести плавку на Na - железистый шлак следующего состава :
24.5 % Fe (FeO); 23 -33% Na.O; 10% CaO.
Такой шлак имеет температуру плавления 950-1000°С и позволяет
вести плавку при t°=1200"C.
Вместо РЬ в качестве коллектора используется Си в виде СиО.
Недостаток: трудность переработки Аи- Си сплава. Его отправляют на
медерафинировочньш завод;
Ведется непосредственная плавка Аи- головки с флюсами. Применяется метод для богатых по Аи Аи- головок.
III. Гидрометаллургичесие методы
1 .Цианирование под давлением (ЮАР);
2.Жидкофазное хлорирование.
1. Применение повышенного давления 02 позволяет ускорить процесс растворения крупного золота. Из раствора Аи может быть выведено цементацией Zn, электролизом. У нас, в России, разрабатывается метод цианирования при атмосферном давлении в спец.аппаратах-конусах. Это позволяет избегать залегание зернистого материала и достаточно эффективно провести процесс цианирования. Выделение Аи может быть осуществлено цементацией, сорбцией.
2. Метод заключается в пропускании газообразного С1 , через раствор, содержащий золотую головку и НС1 и NaCl:
Au+3/2Cl2+HCI >Щ Аи3+С14].
Пустая порода SiC>2, AI2O3, СаО - не растворяются. Сульфиды металлов переходят в раствор. Чтобы этого избежать и снизить расход С1, проводят предварительно окислительный обжиг, переводя сульфиды в нерастворимые оксиды. Под действием S02, Na2SC>3 и др. восстановителей Аи- восстанавливается. Данный метод обеспечивает Еди>95-98% и обладает высокой селективностью.
H[AuCl4]+Na2SCh > Au+NaCl+H2S04 >99%
Вывод: Если в руде имеется крупное Аи, то оно должно быть выделено из руды в цикле измельчения путем установки отсадочных машин. Полученный гравиконцентрат доводят до Аи- головки, которая может быть переработана различными методами.
Цианирование золотосодержащих руд
Сущность цианирования заключается в выщелачивании Аи из руд слабым цианистыми растворами в присутствии СЬ воздуха. Аи при этом переходит в раствор в виде цианистого комплекса: Na[Au(CN)2] u Na[Ag(CN)2], В дальнейшем из раствора они могут быть выделены цементацией Zn или сорбцией на ионообменных смолах или активированных углях. Метод цианирования применим для извлечения мелкого золота. К настоящему времени это единственный горно - металлургический метод извлечения из руды. Химизм процесса
Растворение может быть описано различными химическими реакциями:
Эльснер: Аи и Ag
4Ме + 8NaCN + 02+ 2Н20 = 4Na[Me(CN)2] + 4NaOH (1) Бодлендер :
2Me+4NaCN+02+2H20 = 2Na[Me(CH)2]+ H202+2Na0H (2)
2Me+4NaCN+H202 = 2Na[Me(CN)2J + 2NaON (3)
(l) = (2) + (3) Au - лучше растворяется в реакции (2). Ag - лучше растворяется в реакции (1).
2 А и +4Na CN+02+2H20 = 2Na[Au(CN)2J+H202+H20+2Na0H; 4Ag +8NaCN+02+2H20 =4Na[Ag(CN)2J+4NaOH;
AuTe2+2NaCN+02+3Na0H >
Na[A и (CN) 2]+2Na2Te03+3/2H20 AgCl+2NaCN Na[Ag(CN)2]+NaCl; A g2Se+4Na CN+О 2 + NaOH 2Na[Ag(CN) 2J+Na 2Se03+II20; Ag2Se + NaCN + 02 + H20 >Na[Ag(CN)2] + NaCNSe + NaOH.
Термодинамика процесса
NaCN - комплексообразователь; 02- окислитель.
ф Au/Au+ = +1.88;
Ф°02/0н- = 0,40 В. ф 02/0Н+Н202 =-0,15В
Е = Фок - фвос^О , тогда процесс возможен. фАи/Аи(СЮ2- - по уравнению Нернста = f(aAu+). [Au(CN)2]": Kh=1.1*10"41
^au+u , 9AU/AU(CN>2-^ -0.54 B.
Процесс становится также возможен.
Аналогично для [Ag(CN)2]~: Кн = 1.8* 10 19 ; 9Ag/Ag(CN)2- =-0.31 В. Кинетика процесса
Лимитирующую стадию процесса устанавливают экспериментально по следующим факторам :
По интенсивности перемешивания ;
По влиянию температуры на процесс.
По уравнению Аррениуса рассчитывают энергию активации K=K0exp(-E/RT);
По энергии активации (до20 КДж/моль - диффузионная область;
50 КДж/моль - кинетическая);
влияние концентрации реагирующих веществ;
влияние крупности материала.
Цианирование является типичным гетерогенным процессом, где твердая фаза Au/Ag , жидкая фаза - цианистый раствор, газообразная фаза - 02.
Процесс цианирования можно представить состоящим из нескольких элементарных стадий:
1. адсорбция 02 воздуха раствором; 2. диффузия ионов циана и молекул 02к поверхности частицы;
химическая реакция;
отвод, диффузия продуктов реакции от поверхности в объем раствора.
Если медленной является (1) или (2) стадия, процесс лимитируется дифузией. Если медленной является (3) стадия, то процесс лимитируется химической кинетикой. Эксперименты, проведенные Каковским и сотрудниками показали следующее рисунок 10.
EAga,a = 3,8 - 14,97 КДж/моль; ЕДиакт = 6-15 КДж/моль.
Рис.
10.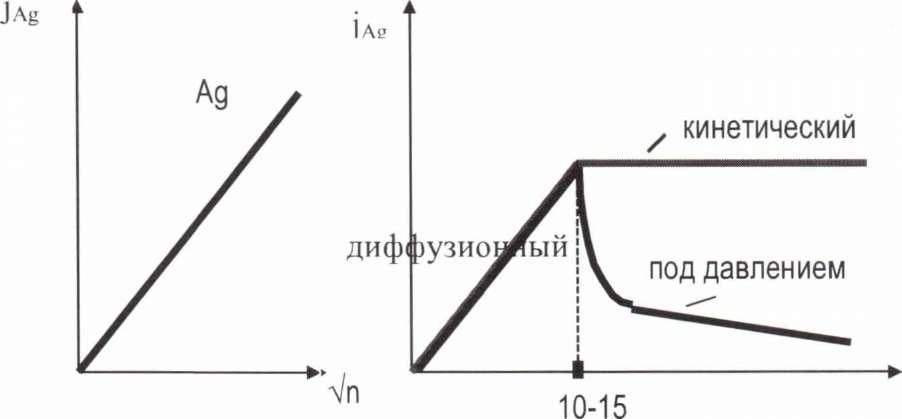
Таким образом, процесс протекает в диффузионном режиме. Лимитирующей является диффузия либо циан - иона, либо 02. Для Аи характерен переход при интенсивном перемешивании из диффузионного режима в кинетический. Считают, что при интенсивном перемешивании происходит адсорбция 02 на поверхности Аи, что затрудняет доступ цианида. Рисунок 11.
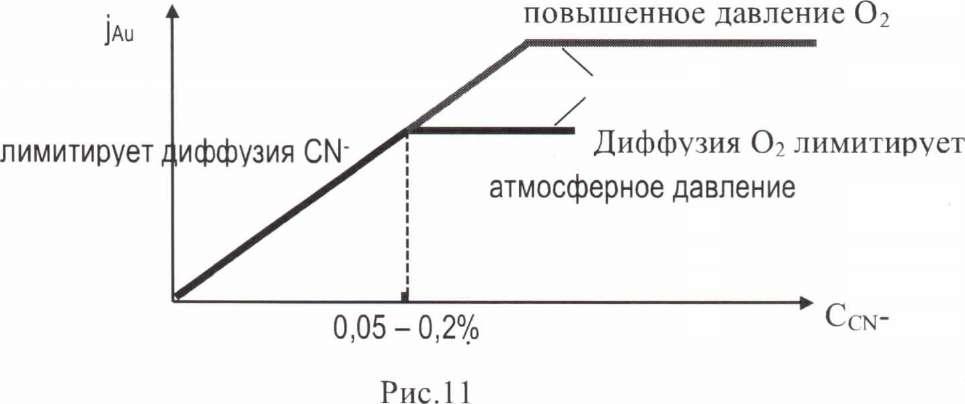
В реальных условиях, как правило, лимитирует диффузия 02. Оптимальную скорость процесса можно достичь путем подбора соответствующих концентраций цианида и 02. Рисунок 12.
Рис.
12.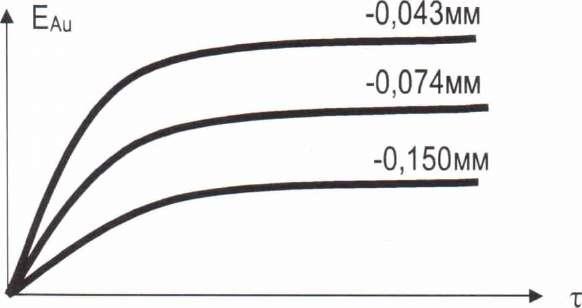
Чем больше поверхность реагирования, тем больше Е и скорость процесса.
!!! Все факторы, ускоряющие диффузию, следует рассматривать как возможные пути интенсификации процесса цианирования.
Факторы, влияющие на процесс цианирования
I. Соотношение концентраций CN" и 02.
Если процесс протекает в режиме внешней диффузии, то он
описывается 1" законом Фика : количество вещества, прошедшего в
результате молекулярной диффузии через плоскую поверхность пропор-
dm - -DS—dz
ционально величине поверхности, продолжительности диффузии и градиенту концентрации по нормали к этой поверхности :
Удельная скорость процесса :
dm _ dc J = = -D —
dr-S dx
Считаем, что изменение концентрации происходит линейно.
дА С D(Cn-Co) 8 S
Разберем на примере Ag :
4Ag + 8 NaCN + 02 + Н20 = 4Na[Ag(CN)2] + 4 NaOH
J Ag 2 ^CN~ ^°2
Выразим удельную скорость растворения CN*:
.CN' „CN~
. _ (.CnCjV -Q?L/V )
J
02
= ~D02
SOT
(iCn2 -Co0')
So,
Максимальная скорость процесса, когда скорости всех реакций равны.
а) Если CCN- » С02 , процесс лимитирует диффузия 02 . Это значит,
г^ 02 п
что
Сп
= 0 , тогда :
о,
Со
о,
б) Если С02 » CcN-, процесс лимитирует диффузия CN". Это значит,
г* 02 А
что Сп =0 , тогда:
p CN~
i =D
JСЛГ CN'
Отсюда:
rCN~ D 8 0 =8- 2 CN~
Dor So2
для Ag это отношение = 8.6; для Au это отношение = 4.3.
Вывод : На практике процесс лимитируется диффузией кислорода.
Растворимость кислорода в воде согласно закону Генри равна :
^о, ,, 1 о, Кг
Кг - постоянная Генри;
Рог - парционное давление 02 над раствором.
Со2° = 8,6-9,13 мг/л Такая растворимость соответствует Ccn- = 0.01% для Au и 0.02% для
Ag-
В этих случаях процесс лимитируется только диффузией 02 . Для поддержания концентрации 02 в растворе на уровне 8- 9мг/л проводят при практической реализации процесса постоянную аэрацию раствора. Она может быть принудительная или естественная.
II. Поскольку скорость диффузионных процессов зависит от интенсивности перемешивания, все аппараты оборудованы перемешивающим устройством :
механического типа ;
пневматического типа ;
пневмомеханического типа.
