
- •1 Платиновые металлы
- •История открытия
- •1.2 Месторождения и распространение в природе
- •1.3 Физические свойства
- •1.4 Изотопы
- •1.5 Извлечение и очистка
- •2 Строение рутения
- •2.1 Поверхность Ферми Рутения
- •2.3 Полиморфизм рутения
- •2.4 Механические свойства и пластическая деформация рутения
- •3 Тепловые свойства рутения
- •4 Электрические свойства рутения
- •5 Термоэлектрические свойства рутения
- •6 Магнитные свойства рутения
- •7 Эмиссионные свойства рутения
- •8 Оптические свойства рутения
- •9 Химические свойства рутения
- •9.1 Химические свойства металлического рутения
- •9.2 Бинарные соединения рутения
- •9.3 Комплексные соединения рутения
9.3 Комплексные соединения рутения
Комплексные соединения наиболее широко представлены в химии рутения. Практически в любых водных растворах с любыми анионами рутений образует комплексные ионы. Отличительную особенность рутения составляют: легкость перехода в высшие степени окисления (VI и VIII), склонность к образованию комплексов с лигандами π-типа, а также образование особой группы нитрозильных комплексов. Состояние окисления и стереохимия соединений Ru представлены в табл. 20.
Таблица 25 - Состояние окисления и стереохимия соединений рутения
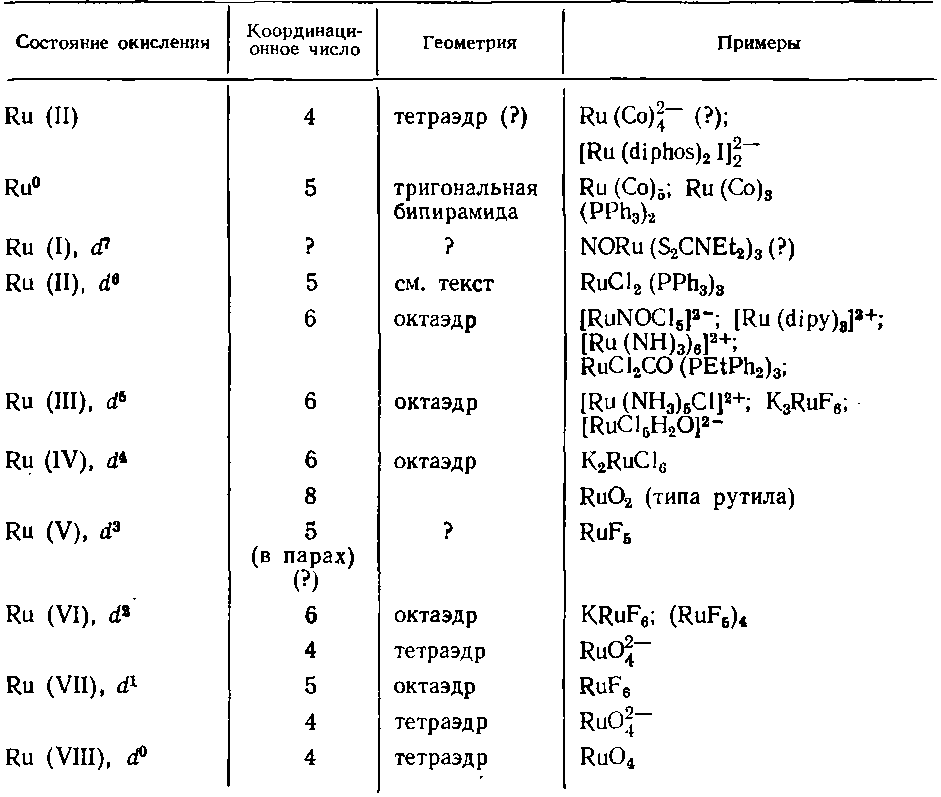
Рутений
(II) d6.
Рутений в этой степени окисления известен
лишь в комплексных соединениях, которые
обычно получают восстановлением
галогенидных комплексов Ru
(III)
или Ru
(IV) в присутствии соответствующих
лигандов.
При обработке растворов RuCl3 водородом под давлением в присутствии ионов Ti3+, а также при электролитическом восстановлении образуются синие растворы хлоридных комплексов. В растворе тетрафенилбората или
n-толуолсульфоната можно получить гексакво-ион [Ru(H2O)6]2+. В присутствии других ионов, даже трифторацетата, образуются ацидокомплексы. Потенциал пары Ru (III)/Ru (II) принят равным 0,22 В и растворы Ru (II) легко окисляются на воздухе. Синие хлоридные комплексы окисляются даже водой.
Большое место среди комплексных соединений рутения занимают аммиачные комплексы.
Простейшим из них является оранжевая кристаллическая соль [Ru(NH3)6]Cl2, которую можно выделить из раствора любого соединения рутения с минеральной кислотой после восстановления в аммиачном растворе NH4C1 цинковой пылью, а также восстановлением в присутствии комплексообразователя можно получить комплексные соединения с азотсодержащими лигандами, например: [Ru(dipy)3]Cl2, [Ru(dipy)OX]. Описан ряд комплексов Ru (II) с аммиаком и одним из серосодержащих лигандов: SO2, HSO3- или SO32-, а также, возможно, и с ионами хлора. Типичными примерами служат [Ru (NH3)5SO3]·2Н2O, [Ru(NH3)4(SO2) CI]CI и Na4[Ru(NH3)2(SO3)2(HSO3)2 6Н2O]. Их получают действием бисульфита натрия на аминные комплексы Ru (III).
Ru (II) образует очень устойчивые анионы гексацианидов, такие комплексы можно получать различными способами, например:
100˚C RuO42-
RuO42-
 K4(Ru(CN)6)
(22)
K4(Ru(CN)6)
(22)
Особо следует отметить разнообразные комплексы рутения с окисью азота, которых Ru образует значительно больше, чем любой другой переходный элемент. Группа [RuNO], содержащаяся в указанных соединениях, может входить в состав как анионных, так и катионных октаэдрических комплексов, она отличается исключительной устойчивостью и сохраняется в ходе разнообразных реакций замещения и окислительно-восстановительных реакций. Связь Ru с NO образуется во всех случаях контакта соединений рутения с окисью азота.
Группа [RuNO] способна присоединять все известные лиганды; типичными примерами могут служить K2[RuNO(OH) (NO2)4], K2[RuNOC15], K2[RuNO(CN)5]. Подобные комплексы получают самыми разнообразными методами, а исходными веществами могут служить HN03, NO, N02 или N02- [91, 92]. Комплексы [RuNOCl4(H2O)]- и [RuNOC13(H2O)2] являются слабыми кислотами, которые диссоциируют с образованием гидроксокомплексов.
Как указывалось выше, подавляющее большинство комплексов Ru с NO имеют общую формулу RuNOL5. Если постулировать, что электрон переходит от молекулы NO к Ru (III) с последующим дативным взаимодействием между NO+ и атомом металла, то рутений в таких комплексах является формально двухвалентным.
Подобно другим платиновым металлам, Ru
легко образует карбонильные соединения.
Группу СО можно ввести как непосредственно
при помощи окиси углерода, так и при
действии муравьиной кислоты или
некоторых спиртов, особенно в щелочных
растворах. В последнем случае могут
образоваться гидридные соединения.
Рутений (III), d5. Комплексные соединения трехвалентного рутения также широко представлены в химии элемента. При упаривании солянокислых растворов RuO4 в токе НС1 можно получить гидрат RuCl3·3H2O.
Продажный трихлоргидрат рутения представляет собой сложную смесь хлор- и хлоргидроксокомплексов, многие из которых полимерны и в основном содержат Ru (IV). В общем соединение Ru (III) легко окисляется в Ru (IV).
Известны различные типы комплексов Ru (III) с аммиаком. Такие комплексы можно получать окислением соответствующих соединений Ru (II). Стандартный потенциал пары [Ru(NH3)6]3+/[Ru(NH3)в]2+ равен 0,214 В.
Замещением в координационной сфере можно получить различные смешанные комплексы с С1-, Н2O и т. д.
Рутений (III) образует большое число галогенидных комплексов. При обработке RuCl3 расплавом KHF2 можно получить соль K3RuF6, которая представляет собой вещество серого цвета, инертное по отношению к воде, но растворяющееся в разбавленных кислотах. Существуют аналогичные гексахлорокомплексы, которые содержат ион [RuCl6]3-, строение остальных галоидных комплексов не установлено.
Рутений (IV), d4. Таких комплексов известно сравнительно немного; наиболее важными из них являются галогенидные.
Гексафторидные рутениевые комплексы K2RuF6 и Cs2RuFe можно получить при действии воды на соответствующие соли M(I)Ru(V)F6, а бариевую соль — непосредственным фторированием смеси RuCls и ВаС12. Указанные соединения медленно разлагаются во влажной атмосфере, и из холодных водных растворов при стоянии выпадает гидратированная окись Ru (IV). Теплые или щелочные растворы быстро разлагаются. При обработке хлористоводородной или бромистоводородной кислотами из фторидных комплексов образуются соответственно ионы [RuCl6]2- и [RuBr6]2-. Эти ионы не очень устойчивы.
Реакцией замещения можно получить гексахлорорутенаты различных элементов, причем чем крупнее катион, тем менее растворима соль. Указанные соли окрашены в темно-коричневый или пурпурный цвет. Соответствующие черные гексабромиды имеют меньшее значение, так как очень легко гидролизуются.
Система Ru (IV) - Сl
в водном растворе при малой концентрации
ионов хлора очень сложна и недостаточно
изучена. Установлено, что при добавлении
ионов хлора к перхлоратному раствору,
содержащему Ru (IV), происходит
последовательное изменение окраски,
причем как последовательность, так и
время, в течение которого сохраняется
та или иная окраска, зависят и от рН и
от концентрации ионов хлора. В области
[С1-]>0,1М и [Н+]>0,4М наблюдаются
следующие изменения окраски раствора.
Ru (IV) (красноватая) →желтая
(I) →фиолетовая→желтая.Полагают, что
растворы с желтой окраской (I) содержат
довольно лабильные и, вероятно,
многоядерные комплексы; на стадии с
фиолетовой окраской раствора предполагается
образован
[Ru(H2O)2(OH)2Cl2]; это соединение может превращаться в желтые анионные комплексы [Ru(H2O) (ОН)2С13]- и [Ru(OH)2Cl4]2-.
Характерной особенностью химии аминных комплексов рутения является образование веществ, интенсивно окрашенных в красный или коричневый цвет, которые обычно называют «рутениевые красные». Если обычный продажный «тетрахлорид» рутения, состоящий в основном из многоядерных комплексов Ru (IV), обрабатывать в течение нескольких суток аммиаком в присутствии воздуха, образуется раствор красного цвета. Из такого раствора кристаллизуется диамагнитное вещество, которое и называют «рутениевый красный». Полагают, что в его состав входят трехъядерные ионы с кислородными мостиками (по-видимому, линейными) между атомами металла
[(N Н3)5 Ru – О – Ru(NH3)4 – О – Ru (NH3)6]6+ (23)
Рутений (V), d3. Очевидно, для рутения данное состояние окисления невыгодно; за исключением фторидов, он не образует в этом состоянии ни одного простого соединения; известно всего лишь несколько комплексов
Ru (V).
Гексафторокомплексы можно получать различными путями в неводных растворах, например:
RuCl3+MCl+F2 M(RuF6);
(24)
M(RuF6);
(24)
Ru+MCl2+BrF3→M(RuF6) (25)
Рентгенографически установлено, что подобные соединения содержат октаэдрический ион [RuF6]-. Окраска фторорутенатов (V) зависит от метода получения и, по-видимому, обусловлена следами примесей. При растворении в воде ион [RuF6]- восстанавливается с выделением кислорода в [RuFe6]2- ; одновременно образуются следы RuO4.
Кислородные соединения рутения (IV, VII и VIII). В высших состояниях окисления наиболее известны оксид Ru (VIII) и оксоанионы рутения, которые относятся к числу его наиболее важных и интересных соединений. Основные соединения и ионы этого типа перечислены в таблице 21.
Таблица 26 – Кислородные соединения рутения
|
VIII |
VII |
VI |
|
RO4 |
RuO-4 |
RuO2-4 RuO2Cl2-4 |
Оксид Ru (IV) представляет собой летучее твердое кристаллическое вещество, которое ядовито и обладает характерным запахом, напоминающим озон. Ru04 получают нагреванием кислого раствора, содержащего рутений с сильными окислителями, такими как HIO4, МпO4-, ВгОз- или С12; оксид Ru (IV) можно отогнать из кипящего раствора или удалить в токе инертного газа. Его можно также получить перегонкой из раствора в концентрирован- ной хлорной кислоте, либо подкислением и окислением раствора рутената (VI) .
Было показано, что RuO4 имеет тетраэдрическое строение, очень хорошо растворим в ССl4, в разбавленной серной кислоте. При температуре выше ~180°С RuO4 взрывается с образованием RuO2 и O2, медленное разложение наблюдается также при обычных температурах на свету. Оксид Ru (IV) –
-сильный окислитель. При растворении в щелочи RuO4 прежде всего восстанавливается гидроокисью до перрутената (VII), который затем переходит в рутенат (VI)
4RuO4+4OH-
=4RuO-4+2H2O+O2
(26)
4RuO-4+4OH- =4RuO2-2+2H2O+O2 (27)
Рутенаты. При спекании Ru или его соединения со щелочью в присутствий окислителей образуется зеленый плав, содержащий перрутенат-ион RuO4-. При выщелачивании плава водой вследствие высокой концентрации щелочи обычно образуется оранжевый раствор, содержащий устойчивые ионы RuO42- Однако, если RuO4 обрабатывать охлажденным льдом одномолярным раствором КОН, можно получить устойчивые в сухом виде черные кристаллы KRuO4. Окрашенный в глубокий оранжевый цвет рутенат-ион RuO42- умеренно устойчив в щелочном растворе.
Интересно отметить, что большинство соединений рутения низшей валентности в щелочном растворе под действием КМnО4 окисляется до RuO42-, при взаимодействии с гипохлоритом образуется смесь из ионов RuO42- и RuO-4, а с Вг2 - только RuO-4.
Другие оксоанионы. При обработке RuO4 газообразными НСl и Сl2 образуются гигроскопичные кристаллы (H2O)2[RuO2Cl4], из которых можно получить рубидиевую или цезиевую соль. В воде эта соль быстро гидролизуется
2CsRuO2Cl4+2H2O=RuO4+RuO2+4CsCl+4HCl (28)
При этом могут образовываться и другие соединения рутения (VI).
Восстановление RuO4 в разбавленной H2SO4 с помощью NaNO2, Na2SO3 или FeSO4 дает растворы зеленого цвета, содержащие Ru (VI).
Состав комплексов, образующихся при этом, не изучен, вероятно, там присутствуют ионы [Ru02(S04)2]2-. Подобные зеленые растворы разлагаются в течение нескольких часов с образованием Ru (IV).
Оксохлориды и продукты присоединения лигандов к RuO-4.
При взаимодействии оксида рутения (VIII) с различными донорными лигандами образуются черные гигроскопические твердые вещества, например, RuO4PF3, (RuO4)2PF3, RuO4(NO)2. Строение таких аддуктов неизвестно.
Из оксохлоридов рутения описаны Ru2OCl4,
Ru2OCl5
и Ru2OCl6
которые были получены хлорированием
высушенного продажного «RuCl3(aq)»

1 «Химия рутения» под ред. проф. О. Е. Звягинцева, 2005 г
2 «Металловедение платиновых металлов» Е. М. Савицкого, В. П. Поляковой и др., 2008 г.
3 С.Ливингстон «Химия
Рутения Родия Палладия Осмия Иридия
Платины»,1998г.
