
- •Общее знакомство с аптечным учреждением
- •Практика на рабочем месте провизора аналитика Знакомство с работой провизора – аналитика
- •Требования к провизору, занятому контролем качества лекарственных средств изготовленных в аптеке.
- •Обязанности провизора-аналитика.
- •Приказы и нд, используемые провизором- аналитиком.
- •Результаты анализов лекарственных форм
- •Фармакопейная статья
- •4.Никотиновая кислота:
Фармакопейная статья
Aqua pro injectionibus ФС 42-2620-97
Вода для инъекций взамен ФС 42-2620-89
Настоящая фармакопейная статья распространяется на воду для инъекций, получаемую дистилляцией или обратным осмосом, применяемую в качестве растворителя для приготовления инъекционных лекарственных средств.
Вода для инъекций должна выдерживать испытания, приведенные в статье «вода очищенная», должна быть апирогенной, не содержать антимикробных веществ и других добавок.
Для инъекционных лекарственных средств, которые изготавливают в асептических условиях и не подвергают последующей стерилизации, используют стерильную воду для инъекций.
Пирогенность. Испытание проводят в соответствии со статьей «испытание на пирогенность» (ГФ XI,вып. 2, стр.183).
Использование и хранение. Используют свежеприготовленной или хранят при температуре от 50С до 100С или от 800С до 950С в закрытых емкостях, изготовленных из материалов, не изменяющих свойств воды, защищающих воду от попадания механических включений и микробиологических включений, но не более 24 часов.
На этикетке емкостей для сбора и хранения воды для инъекций должно быть обозначено, что содержимое не простерилизовано.
Дата: 26.03.12
Пропись № 1Sol.Glucosae20% - 200ml
Magnesiisulfatis2,0
Natrii bromidi 2,0
T–ae valerianae 2ml
Микстура
Описание: Раствор светло – коричневого цвета со специфическим запахом и вкусом.
Определения подлинности:
Na:окрашивает бесцветное пламя горелки в жёлтый цвет.
Br:к 0,5 мл раствора добавляем 0,5мл разведенной соляной кислоты, 1 – 2 капли раствора хлорамина, 1мл хлороформа, встряхиваем, образуется желто – бурое окрашивание хлороформного слоя.
Mg:к 0,5мл лекарственной формы добавляем 4 – 5 капель раствора хлорида аммония, фосфата натрия и аммиака, выпадает белый кристаллический осадок.
![]()
SO4:к 0,5мл лекарственной формы добавляем 1 каплю разведенной соляной кислоты и 1 каплю хлорида бария, выпадает белый осадок.
![]()
Валериана:органолептически.
Глюкоза:к 0,5мл исследуемого раствора добавляем 5мл раствора ФелингаIиIIи нагреваем, образуется красная губчатая масса.
Количественный анализ:
NaBr
Метод: аргентометрия (Мора).
К 0,5 мл лекарственной формы добавляем 1 – 2 капли хромата калия и титруем 0,1М раствором нитрата серебра.
![]()
![]() fэкв.
=1
fэкв.
=1

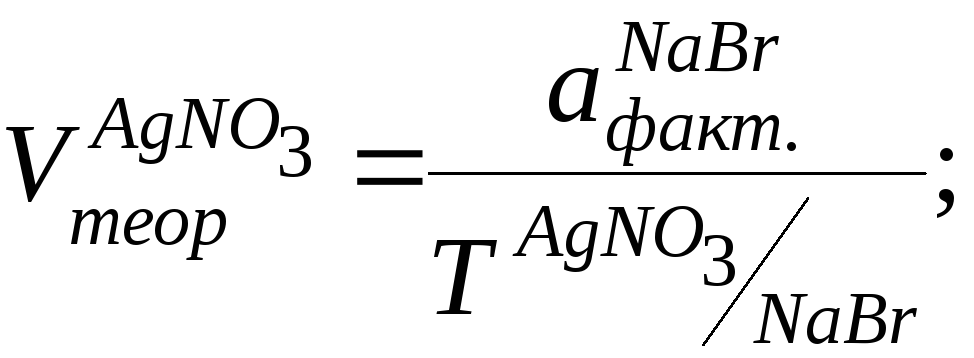
 а факт. – ?
а факт. – ?
200 – 4,0
0,5 – х х = 0,01г
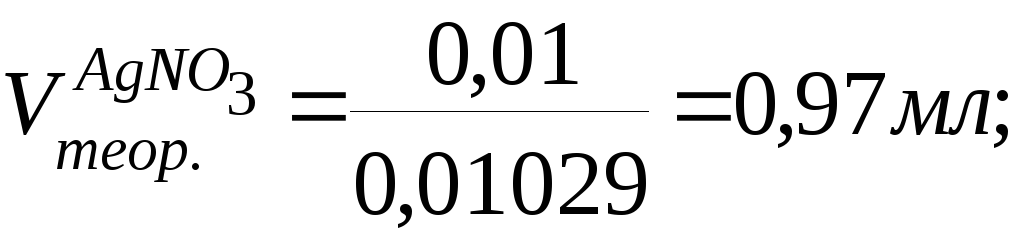 Vпр. = 0,95мл
Vпр. = 0,95мл
Q=
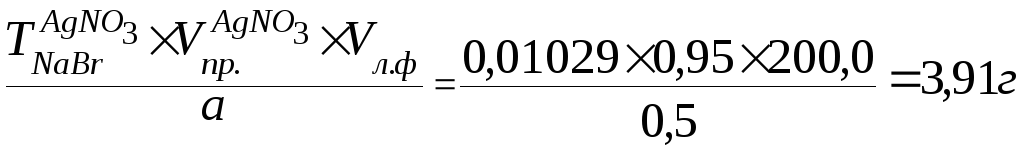
Р асчет
отклонений:
асчет
отклонений:
4,0 – 100% х = 97,76%
3,91 – х 97,76% - 100% = 2,24%
Вывод: рассчитанное отклонение ± 2,24% от прописанной массы натрия бромида не превышает допустимое ± 4% по приказу № 305.
MgSO4
Метод: комплексонометрия.
К 1мл лекарственной формы добавляем 5мл воды, 5мл аммиачного буферного раствора, индикаторной смеси кислотного хром темно – синего и титруем 0,05М раствором трилона Б до выпадения сине – фиолетого осадка.
fэкв. =1
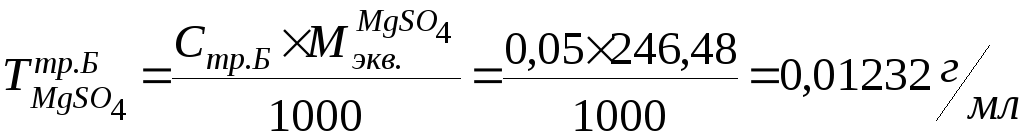
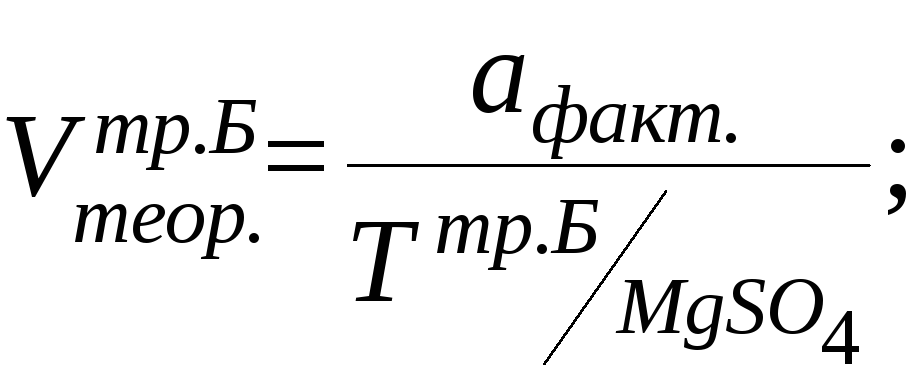
![]()
2 00
–4
00
–4
0,5– х х = 0,01г
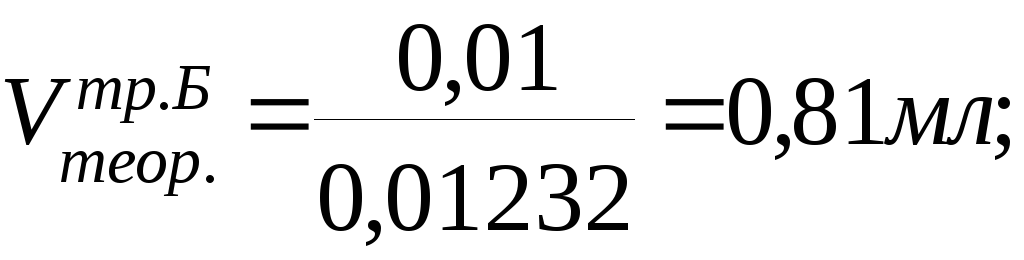 Vпр. =
0,82мл
Vпр. =
0,82мл

Р асчет
отклонений:
асчет
отклонений:
4,0 – 100% х = 101%
4,04 – х 101% - 100% = 1%
Вывод: рассчитанное отклонение ± 1% от прописанной массы магния сульфата не превышает допустимое ± 4% по приказу № 305.
Глюкоза:метод рефрактометрии.
Fгл.=0,0142
FNaBr=0,00090n= 1,3640
FMgSO=0,00130

Расчет отклонений:
2 0
– 100% х=100,47%
0
– 100% х=100,47%
20,29 – х 100,47% - 100% = 0,47%
Вывод: рассчитанное отклонение ± 0,47% от прописанной массы глюкозы не превышает допустимое ± 1% по приказу № 305.
Заключения:Лекарственная форма приготовлена удовлетворительно.
Пропись № 2 Rp: Sol. Calcii chloridi 1% – 50ml
Кальция хлорида 0,5
Воды очищенной 50 мл
Описание: Бесцветная, прозрачная жидкость, без запаха и механических примесей. Общий объем 200 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ
Хлорид-ион. К 2-3 каплям ЛФ прибавляют 1 мл воды очищенной, 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется белый творожистый осадок.
Cl-+Ag+→AgCl↓бел.
Кальций-ион. К 1 мл ЛФ прибавляют по 2 капли гидроксида аммония и хлорида аммония, 4 капли раствора аммония оксалата. Образуется белый осадок, растворимый в разведенных минеральных кислотах.

КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ
Кальция хлорид (Рефрактометрически). Метод основан на способности исследуемого вещества изменять показатель преломления света.
Испытуемый раствор и очищенную воду выдержали 30 минут рядом с рефрактометром для уравнивания температуры. После этого нанесли 3 капли воды на призму рефрактометра и определили показатель преломления. Затем призму тщательно протерли, нанесли 3 капли испытуемого раствора и определили показатель преломления.
Кальция хлорид n=1,3342
Вода очищенная n0=1,3330
![]()
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 27.03.13
Пропись № 1Rp:Furacilini1,0
Natrii chloride 45,0
Aq. purificatae ad 5000 ml
Фурациллин 1,0
Натрия хлорид 45,0
Вода очищенная до 5000 мл
Описание:Прозрачный раствор желтого цвета, солено-горького вкуса. Общий объем 5 л.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
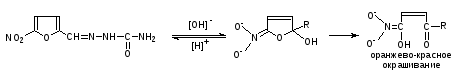
Фурациллин. К 0,5 мл раствора прибавляют 3 капли раствора натрия гидроксида. Появляется оранжево-красное окрашивание.
Натрия хлорид. К 2-3 каплям ЛФ прибавляют 1 мл воды очищенной, 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется белый творожистый осадок.
NaCl+AgNO3→AgCl↓бел.+NaNO3
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Фурацилин (фотоэлектроколориметрически). Метод основан на способности раствора вещества поглощать немонохроматическое излучение света в видимой области спектра.
К 0,5 мл раствора прибавляют точно 7,5 мл воды, 2 мл 0,1 моль/л раствора гидроксида натрия и перемешивают. Через 20 мин измеряют оптическую плотность окрашенного раствора (D1) при длине волны около 450 нм в кювете с толщиной слоя 3 мм.
Раствор сравнения – вода.
Параллельно проводят реакцию с 0,5 мл 0,02% стандартного раствора фурациллина (0,0001) и измеряют оптическую плотность (D2).
![]() ,
,
где D– оптическая плотность испытуемого раствора;
D0– оптическая плотность эталонного раствора;
0,0001 – содержание фурациллина в эталонном растворе, г;
а – объем испытуемого раствора, взятый для анализа, мл;
V– общий объем лекарственной формы, мл.
Р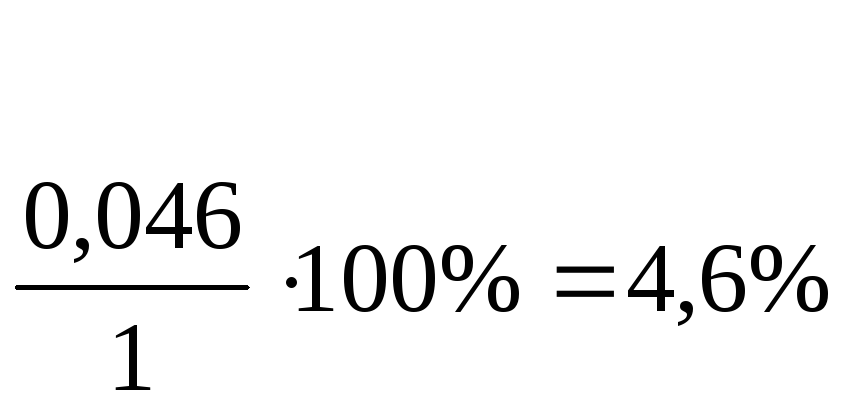 асчет
отклонения:
асчет
отклонения:
Абс.ошибка: 1,046 –1= 0,046;
Относит.ошибка: (по П №305 допустимо 5%)
Натрия хлорид (аргентометрически методом Мора). Метод основан на способности натрия хлорида реагировать с серебра нитратом с образованием серебра хлорида.
К 0,5 мл ЛФ прибавляют 1 каплю хромата калия и титруют 0,1 моль/л раствором серебра нитрата до оранжево-желтого цвета. 1мл 0,1 моль/л серебра нитрата соответствует 0,005844 г натрия хлорида.
NaCl+AgNO3→AgCl↓бел.+NaNO3
В т.к.т. 2 AgNO3+K2CrO4→Ag2CrO4↓Кирп. красн+ 2KNO3
f= 1
Т = 0,1*58,44/1000 = 0,005844
Vтеор. = 0,0045/0,005844 = 0,77
![]() (Относит.ошибка=0%)
(Относит.ошибка=0%)
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2 Rp: Sol. Magnesii sulfatis 3% - 200 ml
Магния сульфат 6,0
Вода очищенная 200 мл
Описание:Бесцветная прозрачная жидкость, без запаха, без механических примесей. Общий объем – 200 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ
Магния сульфат.
К 0,5 мл ЛФ прибавляют по 5-6 капель раствора аммония хлорида, натрия фосфата и 3-4 капли раствора аммиака. Образуется белый кристаллический осадок, растворимый в разведенной кислоте уксусной.
MgSO4 + Na2HPO4 + NH4OH → MgNH4PO4↓ + Na2SO4 + H2O
К 0,5 мл ЛФ прибавляют 5-6 капель раствора бария хлорида. Образуется белый осадок, нерастворимый в разведенных минеральных кислотах.
MgSO4+BaCl2→BaSO4↓ +MgCl2
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ
Магния сульфат (рефрактометрически). Метод основан на способности исследуемого вещества изменять показатель преломления света.
Испытуемый раствор и очищенную воду выдержали 30 минут рядом с рефрактометром для уравнивания температуры. После этого нанесли 3 капли воды на призму рефрактометра и определили показатель преломления. Затем призму тщательно протерли, нанесли 3 капли испытуемого раствора и определили показатель преломления.
Магния сульфат n=1,3359
Вода очищенная n0=1,3330
n (из таблицы) | С%
1,3340 1,05%
1,3380 5,15%
0,0040 4,1%
0,0040 – 4,1%
0,0021 – х% х=2,1525%
5,15%-2,1525%=2,9975%
Отн.ошибка: 3-2,9975=0,0025 (по П №305 допустимо 15%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 28.03.13
Пропись № 1Rp:Magniisulfatis20,0 Магния сульфат 20,0
Natriibromidi20,0 Натрия бромид 20,0
Tinct.Valerianae20mlН.Валерианы 20 мл
Sol.Citrali1% - 20mlР-р цитраля 1%-20мл
Aq.purificataead2000mlВода очищенная до 2000 мл
Описание: Мутная жидкость с запахом цитраля и валерианы. Общий объем 2040 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ
Магния сульфат.
К 0,5 мл ЛФ прибавляют по 5-6 капель раствора аммония хлорида, натрия фосфата и 3-4 капли раствора аммиака. Образуется белый кристаллический осадок, растворимый в разведенной кислоте уксусной.
MgSO4 + Na2HPO4 + NH4OH → MgNH4PO4↓ + Na2SO4 + H2O
К 0,5 мл ЛФ прибавляют 5-6 капель раствора бария хлорида. Образуется белый осадок, нерастворимый в разведенных минеральных кислотах.
MgSO4+BaCl2→BaSO4↓ +MgCl2
Натрия бромид.
К 0,5 мл ЛФ прибавляют 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется светло-желтый творожистый осадок.
NaBr+AgNO3→AgBr↓светло-желт.+NaNO3
Раствор цитраля. Определяется по характерному запаху.
Настойка валерианы. Определяется по аромату валерианы.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ
Магния сульфат (трилонометрически). Метод основан на образовании устойчивого комплекса Трилона Б с ионамиMg2+.
К 0,5 мл ЛФ прибавляют 1 мл аммиачного буферного раствора, 1 каплю раствора кислотного хром черного специального и титруют 0,1 моль/л раствором Трилона Б до синего окрашивания.

В точке эквивалентности:
f= 1
T = 0,1*123/1000 = 0,01234
Vтеор.= 0,005/0,01234 = 0,40
![]()
Расчет отклонения:
Отн.ошибка: 20 – 19,64 = 0,36;
Абс.ошибка:
![]() (по
П №305 допустимо 3%).
(по
П №305 допустимо 3%).
Натрия бромид (аргентометрически методом Мора). Метод основан на способности натрия бромида реагировать с серебра нитратом с образованием серебра хлорида.
К 0,5 мл ЛФ прибавляют 1 каплю хромата калия и титруют 0,1 моль/л р-ром серебра нитрата до оранжево-желтого цвета. 1мл 0,1 моль/л серебра нитрата соответствует 0,005844 г натрия хлорида.
NaBr+AgNO3→AgBr↓бел.+NaNO3
В т.к.т. 2 AgNO3+K2CrO4→Ag2CrO4↓Кирп. красн+ 2KNO3
f = 1
Т = 0,1*102,9/1000 = 0,01029
Vтеор. = 0,005/0,01029 = 0,48
![]()
Расчет отклонения:
Абс.ошибка: 20 – 19,73 = 0,27;
Отн.ошибка:
![]() (по
П №305 допустимо 3%)
(по
П №305 допустимо 3%)
Заключение:Данная лекарственная форма приготовлена удовлетворительно
Пропись № 2Rp:Riboflavini0,04
Natrii chloridi 1,8
Aq. purificatae ad 200 ml
Рибофлавина 0,04
Натрия хлорида 1,8
Воды очищенной до 200 мл
Описание:представляет собой прозрачную жидкость зеленовато-желтого цвета, без запаха, соленого вкуса, без механических примесей. Общий объем – 200 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Рибофлавин. Раствор имеет яркую зеленовато-желтую окраску при дневном свете и зеленую флуоресценцию при облучении ультрафиолетовым светом. Флуоресценция исчезает при добавлении растворов кислот или щелочей, а под действием натрия гидросульфита исчезает и флуоресценция, и зеленая окраска раствора.
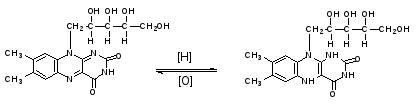
Натрия хлорид. К 2-3 каплям ЛФ прибавляют 1 мл воды очищенной, 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется белый творожистый осадок.
NaCl+AgNO3→AgCl↓бел.+NaNO3
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Рибофлавин(фотоэлектроколориметрическим методом). Метод основан на способности раствора вещества поглощать немонохроматическое излучение света в видимой области спектра.
К 0,5 мл ЛФ прибавляют 9,5 мл воды очищенной и измеряют оптическую плотность раствора на фотоэлектроколриметре при длине волны 445 нм (синий светофильтр) в кювете с толщиной поглощающего слоя 10 мм.
Параллельно измеряют оптическую плотность эталонного раствора содержащего 2,5 мл 0,0004% стандартного раствора рибофлавина (0,0001) и 7,5 мл воды.
В качестве раствора сравнения используют воду.
Содержание рибофлавина в граммах (Х) определяют по формуле:
![]() ,
,
где D– оптическая плотность испытуемого раствора;
D0– оптическая плотность эталонного раствора;
0,0001 – содержание рибофлавина в эталонном растворе, г;
а – объем испытуемого раствора, взятый для анализа, мл;
V– общий объем лекарственной формы, мл.
Расчет отклонения:
Абс.ошибка: 0,04 – 0,038 = 0,002;
Относит.ошибка:
![]() (по П №305 допустимо 15%)
(по П №305 допустимо 15%)
Натрия хлорид (аргентометрически методом Мора). Метод основан на способности натрия хлорида реагировать с серебра нитратом с образованием серебра хлорида.
К 0,5 мл ЛФ прибавляют 1 каплю хромата калия и титруют 0,1 моль/л раствором серебра нитрата до оранжево-желтого цвета.
NaCl+AgNO3→AgCl↓бел.+NaNO3
В т.к.т. 2 AgNO3+K2CrO4→Ag2CrO4↓Кирп. красн+ 2KNO3
f= 1
T= 0,1*58,44/1000 = 0,005844
1,8 – 200
х - 0,5; аф=0,0045
Vтеор.= аф/T= 0,0045/0,005844 = 0,77
Vпр=0,78
![]()
Расчет отклонения:
Абс.ошибка: 1,82 – 1,8 = 0,02;
Относит.ошибка:
![]() (по
П №305 допустимо 5%).
(по
П №305 допустимо 5%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 29.03.13
Пропись № 1Rp:Natriithiosulfatis10,0
Aq. purificatae ad 200 ml
Натрия тиосульфат 10,0
Вода очищенная до 200 мл
Описание:Бесцветная прозрачная жидкость, без запаха, без механических примесей. Общий объем – 200 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Натрия тиосульфат.
К 1 мл раствора прибавляют по каплям 0,1 моль/л раствора йода. Раствор йода обесцвечивается.
2Na2S2O3+I2→Na2S4O6+ 2NaI
К 3 каплям раствора прибавляют по 1 мл воды и раствора серебра нитрата. Образуется белый осадок, быстро переходящий в желтый, бурый и черный.
Na2S2O3 + 2 AgNO3 → Ag2S2O3↓ + 2NaNO3
Ag2S2O3 → Ag2SO3 + S↓
Ag2SO3+S+H2O→Ag2S+H2SO4
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Натрия тиосульфат (рефрактометрически). Метод основан на способности исследуемого вещества изменять показатель преломления света.
Испытуемый раствор и очищенную воду выдержали 30 минут рядом с рефрактометром для уравнивания температуры. После этого нанесли 3 капли воды на призму рефрактометра и определили показатель преломления. Затем призму тщательно протерли, нанесли 3 капли испытуемого раствора и определили показатель преломления.
Натрия тиосульфат n=1,3390
Вода очищенная n0=1,3330
![]() (Отн.ошибка=0).
(Отн.ошибка=0).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2 Rp:Sol.Hydrogeniiperoxydi3% - 5000ml
Р-р перекиси водорода 3%-5000 мл
Описание:Представляет собой бесцветную, прозрачную жидкость со слабым своеобразным запахом. Общий объем 5 литров.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
К 1 мл исследуемого раствора прибавляют 2 капли разведенной серной кислоты и по каплям раствор калия перманганата. Раствор калия перманганата обесцвечивается.
5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 +K2SO4 + 2MnSO4 + 8 H2O
1 мл препарата подкисляют 4 каплями разведенной серной кислоты, прибавляют 2 мл эфира и 4 капли раствора бихромата калия и взбалтывают, эфирный слой окрашивается в синий цвет.
K2Cr2O7 + H2SO4 → H2Cr2O7 + K2SO4
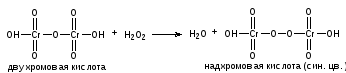
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Перманганатометрический метод – основан на восстановительных свойствах перекиси водорода.
К 0,1 мл ЛФ прибавляют 5 мл разведенной серной кислоты и титруют 0,1 моль/л раствором калия перманганата до слабо розового окрашивания.
5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 +K2SO4 + 2MnSO4 + 8 H2O
f= ½
T= 0,1*17,01/1000 = 0,001701
Vтеор.= 0,003/0,001701= 1,764
![]() (по ГФ X
допустимо отклонение 2,7-3,3%).
(по ГФ X
допустимо отклонение 2,7-3,3%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 01.04.13
Пропись № 1Rp:Sol.Papaverini3%-200ml
Папаверина гидрохлорид 6,0
Вода очищенная 200 мл
Описание:Бесцветная прозрачная жидкость, без запаха, без механических примесей. Общий объем – 200 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
К 1 мл исследуемого раствора прибавляют 2 капли концентрированной серной кислоты и концентрированной азотной кислоты. Появляется красно-оранжевое окрашивание.
К 1 мл препарата прибавляют 4 каплями разведенной азотной кислоты, прибавляют 2 мл нитрата серебра и взбалтывают, появляется белый осадок.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: (аргентометрически). Метод основан на способности папаверина гидрохлорида реагировать с серебра нитратом с образованием серебра хлорида.
0,5 мл ЛФ титруют 0,1 моль/л р-ром серебра нитрата. 1мл 0,1 моль/л серебра нитрата соответствует 0,037586 г натрия хлорида.
f= 1
Т = 0,1*375,86/1000 = 0,037586
в 200 мл – 6,0
0,5 мл - х, х=0,015
Vтеор. = 0,015/0,037586 = 0,4
![]()
Расчет отклонения:
Абс.ошибка: 6 – 5,86 = 0,14
Отн.ошибка:
![]() (по П №305 допустимо 5%)
(по П №305 допустимо 5%)
Заключение:Данная лекарственная форма приготовлена удовлетворительно
Пропись № 2 Rp: Sol. Acidi hydrochloridi 8,3% - 4,4 ml
Natrii Chloridi 5,2
Aquae purificatae ad 1000 ml
Стабилизатор Вейбеля для растворов глюкозы:
Р-р кислоты хлороводородной 8,3%-4,4 мл
Натрия хлорид 5,2
Вода очищенная до 1000 мл
Описание:на анализ поступила бесцветная прозрачная жидкость без запаха и механических включений в прозрачном бесцветном флаконе.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Натрия хлорид и хлороводородная кислота.
На
Na+: 
К 1 капле ЛФ на предметном стекле добавляют 1 каплю раствора пикриновой кислоты и выпаривают досуха. Желтые игольчатые рассматривают под микроскопом.
На Cl-:К 2-3 каплям ЛФ прибавляют 1 мл воды очищенной, 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется белый творожистый осадок.
![]() NaCl
+AgNO3AgCl+NaNO3
NaCl
+AgNO3AgCl+NaNO3
Выпадает белый творожистый осадок, который легко растворим в разбавленном растворе аммония гидроксида.
A![]() gCl
+ 2NH4OH
[Ag(NH3)]Cl
+ 2H2O
gCl
+ 2NH4OH
[Ag(NH3)]Cl
+ 2H2O
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Кислота хлористоводородная, анализ производится методом нейтрализации (алкалиметрия). Этот метод основан на образовании нейтрального продукта под действием стандартного раствора натрия гидроксида.
К 1 мл исследуемого раствора прибавляют 1 каплю метилового оранжевого и титруют 0,1 М раствором натрия гидроксида до желтой окраски.
H![]() Cl
+ NaOH NaCl + H2O,
Fэкв=1
Cl
+ NaOH NaCl + H2O,
Fэкв=1
М.м. экв.HCl = М.м.HCl . Fэкв.= 1. 36,46=36,46г/моль
Т![]() .к.
для изготовления стабилизатора Вейбеля
используется разбавленная кислота
хлористоводородная, то используют
условный титр.
.к.
для изготовления стабилизатора Вейбеля
используется разбавленная кислота
хлористоводородная, то используют
условный титр.
Расчет теоретического объема титранта на 1 мл аликвоты раствора:
В 1000 мл раствора - 4,4 мл кислоты хлороводородной
![]() 1 мл - 0,0044 мл
1 мл - 0,0044 мл
На титрование ушел 0,1мл 0,1М раствора натрия гидроксида, соответственно содержание исследуемого вещества в граммах равно:
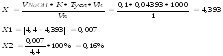

Ошибка не превышает допустимое приказом № 305 отклонение для массы навески от 2,0 до 5,0 (4%).
Натрия хлорид (аргентометрически методом Мора). Метод основан на способности натрия хлорида реагировать с серебра нитратом с образованием серебра хлорида.
К 1 мл ЛФ прибавляют 1 каплю хромата калия и титруют 0,1 моль/л раствором серебра нитрата до оранжево-желтого цвета.
NaCl+AgNO3→AgCl↓бел.+NaNO3
В т.к.т. 2 AgNO3+K2CrO4→Ag2CrO4↓Кирп. красн+ 2KNO3
f= 1
T= 0,1*58,44/1000 = 0,005844
5,2 – 1000
х - 1мл; аф=0,0052
Vтеор.= аф/T= 0,0052/0,005844 = 0,89
Vпр=0,78
На титрование ушло 0,99 мл 0,1М раствора кислоты хлористоводородной, т.е. оттитровалась сумма хлоридов. Т.к. фактор эквивалентности в обоих случаях равен 1, то соответственно содержание натрия хлорида в граммах:
Расчет отклонения:
Относит.ошибка: 0% (по П №305 допустимо 3%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно
Дата: 02.04.13
Пропись № 1Проверка на подлинность порошка норсульфазола
Norsulfazolum – Норсульфазол
![]()
Описание:Белый кристаллический порошок без запаха. Почти нерастворим в воде. Растворим в разведенных минеральных кислотах и растворах едких щелочей.
0,1 г препарата растворяют в 1 мл разведенной соляной кислоты и прибавляют 1 мл 0,1 моль/л раствора нитрита натрия; 1мл полученного раствора приливают к 1мл щелочного раствора β-нафтола. Появляется вишнево-красное окрашивание.
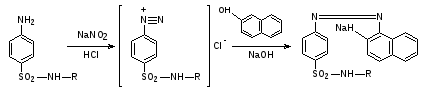
0,1 г препарата взбалтывают с 3 мл 0,1 моль/л раствора натрия гидроксида в течение 2мин и фильтруют; к фильтрату прибавляют 1 мл раствора меди сульфата; образуется осадок грязно-фиолетового цвета.
Заключение: подлинность препарата подтверждена.
Пропись № 2 Rp:Sol.Euphyllini1% – 1000ml
Описание:представляет собой бесцветную, прозрачную жидкость без запаха, без механических примесей. Общий объем – 1000 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Эуфиллин. К 0,5 мл препарата прибавляют по каплям раствор меди сульфата. Раствор окрашивается в яркий фиолетовый цвет, обусловленный образование комплекса сульфата меди с этилендиамином
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Эуфиллин (метод нейтрализации). Метод основан на способности этилендиамина, как основания, нейтрализовать соляную кислоту.
К 1 мл препарата прибавляют 1 каплю метилоранжа и титруют 0,1 моль/л раствором соляной кислоты.
f = ½
Mmэкв. =60,1*½= 30,05
Т = 0,1*30,05/1000 = 0,003005
Vтеор.=0,0016/0,003005 = 0,533
![]()
Расчет отклонения:
Абс.ошибка: 10,03 – 10 = 0,03;
Относит.ошибка:
![]() (по
П №305 допустимо 3%).
(по
П №305 допустимо 3%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 03.04.13
Пропись № 1Rp:Sol.Natriibromidi3% – 200ml
Натрия бромид 6,0
Вода очищенная 200 мл
Описание: Бесцветная, прозрачная жидкость, без запаха и механических примесей. Общий объем 200 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Натрия бромид. К 0,5 мл ЛФ прибавляют 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется светло-желтый творожистый осадок.
NaBr+AgNO3→AgBr↓светло-желт.+NaNO3
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Натрия бромид (Рефрактометрически). Метод основан на способности исследуемого вещества изменять показатель преломления света.
Испытуемый раствор и очищенную воду выдержали 30 минут рядом с рефрактометром для уравнивания температуры. После этого нанесли 3 капли воды на призму рефрактометра и определили показатель преломления. Затем призму тщательно протерли, нанесли 3 капли испытуемого раствора и определили показатель преломления.
Натрия бромид n=1,3370
Вода очищенная n0=1,3330
![]()
(Относит.ошибка=0%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2 Rp:Sol.Ringeri400,0 Раствор Рингера 400 № 28
D.t.d.N28
Состав:
Natriichloridi99,0 Натрия хлорид 99,0
Kaliichloridi2,2 Калия хлорид 2,2
Calciichloridi2,2 Кальция хлорид 2,2
Natriihydrocabonatis2,2 Натрия гидрокарбонат 2,2
Aquaepurificataead11000 мл Вода очищенная до 11000 мл
М.м. NaCl= 58,44
М.м. KCl= 74,56
М.м.CaCl2=219,08
М.м. NaHCO3= 83,99
Описание:на анализ поступила бесцветная прозрачная жидкость без механических включений во флаконе из бесцветного прозрачного стекла.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Н аNa+:
аNa+:
К 1 капле ЛФ на предметном стекле добавляют 1 каплю раствора пикриновой кислоты и выпаривают досуха. Желтые игольчатые рассматривают под микроскопом.
На Cl-:К 2-3 каплям ЛФ прибавляют 1 мл воды очищенной, 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется белый творожистый осадок.
N![]() aCl
+AgNO3AgCl+NaNO3
aCl
+AgNO3AgCl+NaNO3
Выпадает белый творожистый осадок, который легко растворим в разбавленном растворе аммония гидроксида.
A![]() gCl
+ 2NH4OH
[Ag(NH3)]Cl
+ 2H2O
gCl
+ 2NH4OH
[Ag(NH3)]Cl
+ 2H2O
На К+:
Реакция с раствором натрия (III) гексанитрокобальтата.
1-2 капли раствора, помещенного на предметное стекло, подкисляют уксусной кислотой и прибавляют 2 капли раствора натрия (III) гексанитрокобальтата Образуется желтый кристаллический осадок.
N![]() a3[Co(NO2)6]
+ 2 KСl K2Na[Co(NO2)6]
+ 2 NaCl
a3[Co(NO2)6]
+ 2 KСl K2Na[Co(NO2)6]
+ 2 NaCl
На Сa2+: реакция с аммония оксалатом
К 2 мл раствора прибавляют 3-5 капель аммония оксалата. Постепенно образуется белый осадок, нерастворимый в разведенной хлороводородной или азотной кислоте.
С![]() аCl2
+ (NH4)2С2О4
Са С2О4 + 2NH4Cl
аCl2
+ (NH4)2С2О4
Са С2О4 + 2NH4Cl
На HCO3-:
Реакция с хлористоводородной кислотой:
К 2-3 каплям раствора прибавляют 0,5 мл разведенной кислоты хлористоводородной, при этом появляются пузырьки газа.
N![]() aHCO3
+HClNaCl+CO2+H2O
aHCO3
+HClNaCl+CO2+H2O
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Определение суммы хлоридовпроизводится методом аргентометрии (метод Мора), основанном на образовании малодиссоциируемых галогенитов серебра под действием стандартного раствора серебра нитрата.
К 0,5 мл исследуемого раствора прибавляют 1 каплю калия хромата и титруют 0,1М раствором серебра нитрата до образования оранжево-коричневого окрашивания.
N![]() aCl
+ AgNO3
AgCl + NaNO3
Fэкв NaCl =1
aCl
+ AgNO3
AgCl + NaNO3
Fэкв NaCl =1
С![]() аСl2
+ 2AgNO3
2AgCl + Са(NO3)2
Fэкв СаСl2=1/2
аСl2
+ 2AgNO3
2AgCl + Са(NO3)2
Fэкв СаСl2=1/2
К![]() Cl
+ AgNO3
КCl + NaNO3
Fэкв КCl
=1Fэкв СаСl2=1/2
Cl
+ AgNO3
КCl + NaNO3
Fэкв КCl
=1Fэкв СаСl2=1/2
2![]() АgNO3+K2CrO4
2KNO3+
Ag2CrO4
АgNO3+K2CrO4
2KNO3+
Ag2CrO4
М.м. экв.NaCl = М.м. NaCl . Fэкв.= 1 . 58,44=58,44 г/моль
М.м. экв.КCl = М.м. КCl . Fэкв.= 1 . 74,56=74,56 г/моль
М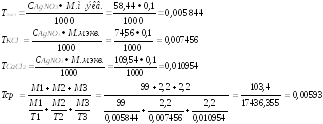 .м.
экв.СаСl2
= М.м.СаСl2
. Fэкв.=
1/2. 219,08=109,54 г/моль
.м.
экв.СаСl2
= М.м.СаСl2
. Fэкв.=
1/2. 219,08=109,54 г/моль
г/мл
Расчет теоретического объема титранта:
Т.к. 103,4 грамма суммы хлоридов содержится в 11000 мл раствора, то в 0,5 мл содержится 0,0047 грамма.
Н![]()
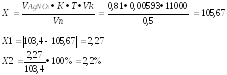 а
титрование ушло 0,81 мл 0,1М раствора
серебра нитрата, соответственно
содержание натрия хлорида в граммах:
а
титрование ушло 0,81 мл 0,1М раствора
серебра нитрата, соответственно
содержание натрия хлорида в граммах:
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески свыше 5,0 (3%).
Кальция хлоридапроизводится с помощью метода трилонометрии, основанном на образовании растворимых в воде комплексов между раствором трилона Б и ионами металлов, которые более прочные, чем окрашенные комплексы ионов металлов с индикатором.
К 5 мл исследуемого раствора прибавляют 5 мл аммиачного буферного раствора и несколько крупинок смеси кислотного хром-темно-синего и титруют 0,05М раствором Трилона Б до перехода окраски от вишнево-красной до сине-фиолетовой.
Fэкв. СаСl2 = 1/2
М.м. экв. . СаСl2= М.м. . СаСl2. Fэкв. = 1/2. 219,08 =109,54 г/моль
Р![]() асчет
теоретического объема титранта:
асчет
теоретического объема титранта:
Т.к. 2,2 грамма кальция хлорида содержится в 11000 мл раствора, то в 5 мл содержится 0,001 грамма.
![]()
На титрование ушло 0,18мл 0,05М раствора трилона Б, соответственно содержание исследуемого вещества в граммах равно:
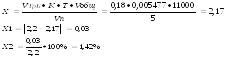
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески свыше 2 до 5 (4%).
Натрия гидрокарбонат, анализ производится с помощью метода ацидиметрии, основанном на образовании нейтральных продуктов под действием стандартного раствора хлористоводородной кислоты на вещество основного характера.
К 5 мл исследуемого раствора прибавляют 1 каплю метилового красного и титруют 0,1М раствором хлористоводородной кислоты до красного окрашивания.
N![]() aHCO3
+ HCl NaCl + CO2
+ H2O
aHCO3
+ HCl NaCl + CO2
+ H2O
Fэкв.NaHCO3= 1
М.м. экв. NaHCO3= М.м NaHCO3 . Fэкв. = 1. 83,99 =83,99 г/моль
Р![]() асчет
теоретического объема титранта:
асчет
теоретического объема титранта:
Т.к. 2,2 грамма натрия гидрокарбоната содержится в 11000 мл раствора, то в 5 мл содержится 0,001 грамма.
![]()
На титрование ушло 0,12мл 0,1М раствора хлористоводородной кислоты, соответственно содержание исследуемого вещества в граммах равно:
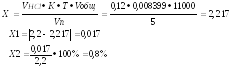
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески свыше 2 до 5 (4%).
Вывод: ЛФ приготовлена удовлетворительно.
Дата: 04.04.13
Пропись № 1Rp:Sol.Dimedroli1% - 100ml
Р-р Димедрола 1%-100 мл
Описание:представляет собой бесцветную, прозрачную жидкость без запаха, без механических примесей. Общий объем – 100 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Димедрол. К 0,5 мл препарата прибавляют по стенке концентрированную серную кислоту. Появляется желтое окрашивание, исчезающее при взбалтывании.

КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Димедрол (аргентометрически методом Фаянса). Метод основан на способности соляной кислоты (димедрола гидрохлорид) реагировать с серебра нитратом с образованием серебра хлорида.
К 1 мл препарата прибавляют 1 каплю бромфенолового синего, по каплям разведенную уксусную кислоту до зеленовато-желтого окрашивания и титруют 0,1 моль/л раствором серебра нитрата до фиолетового окрашивания.

* HCl + AgNO3 → AgCl↓ + HNO3
f = 1
T= 0,1*291,8/1000 = 0,02918 г/мл
Vтеор. = 0,01/0,02918 = 0,35
![]()
Расчет отклонения:
Абс.ошибка:1,05 – 1,0 = 0,05;
Относит.ошибка:![]() (по
П №305 допустимо 5%).
(по
П №305 допустимо 5%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2Rp:Sol. Кaliiiodidi3 % - 200,0
D.S: для электрофореза
Раствор калия йодида 3% - 200,0
Описание:на анализ поступил бесцветный прозрачный раствор без запаха и без механических включений во флаконе из темного прозрачного стекла.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
На К+: реакция с раствором натрия (III) гексанитрокобальтата.
1-2 капли раствора, помещенного на предметное стекло, подкисляют уксусной кислотой и прибавляют 2 капли раствора натрия (III) гексанитрокобальтата, образуется желтый кристаллический осадок.
N![]() a3[Co(NO2)6]
+ 2 KСl K2Na[Co(NO2)6]
+ 2 NaCl
a3[Co(NO2)6]
+ 2 KСl K2Na[Co(NO2)6]
+ 2 NaCl
На I-: Используется реакция с раствором свинца ацетата.
К 0,5 мл раствора прибавляют 2-3 капли раствора свинца ацетата. Образуется осадок желтого цвета.
KI + Pb(CH3COO)2 = PbI2 + CH3COOK
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Для определения количественного содержания используется рефрактометрия, метод основанный на измерении показателя преломления света (n) исследуемого вещества.
n= 1,337
F = 0,0013
= 0,0013
Ошибка не превышает допустимое приказом № 305 отклонение массы навески свыше 5,0 (3%)
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 05.04.13
Пропись № 1Sol.Novocaini2%-100ml
Р-р Новокаина 2%-100 мл
Описание:представляет собой бесцветную, прозрачную жидкость без запаха, без механических примесей. Общий объем – 100 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
На новокаин: реакция азосочитания. К 1 мл раствора прибавляют 5 – 6 капель разведенной кислоты хлористоводородной, 2 – 3 капли 0,1М раствора натрия нитрита, а затем 10 капель натрия гидроксида. Появляется вишнево-красное окрашивание.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: аргентометрически методом Фаянса. Метод основан на способности соляной кислоты (новокаина гидрохлорид) реагировать с серебра нитратом с образованием серебра хлорида.
К 0,5 мл препарата прибавляют 1 каплю бромфенолового синего, по каплям разведенную уксусную кислоту до зеленовато-желтого окрашивания и титруют 0,1 моль/л раствором серебра нитрата до фиолетового окрашивания.
HCl + AgNO3 → AgCl↓ + HNO3
f = 1
T= 0,1*272,8/1000 = 0,02728 г/мл
Vтеор. = 0,01/0,02728 = 0,37
![]()
Расчет отклонения:
Абс.ошибка:2,0 – 1,96 = 0,04;
Относит.ошибка:![]() (по
П №305 допустимо 5%).
(по
П №305 допустимо 5%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2 Rp: Sol. Argentii nitratis 3% -50,0 мл
D.S: для обработки.
Раствор Серебра нитрата 3% 50 мл
Описание:на анализ поступила бесцветная прозрачная жидкость без механических включений во флаконе из темного стекла.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
На Ag+: Определяют с раствором хлористоводородной кислоты. Для этого к примерно 0,5 мл исследуемого раствора добавляют 10 капель раствора хлористоводородной кислоты.
![]()
AgNO3+HCLAgCl+HNO3
Выпадает белый творожистый осадок, который легко растворим в разбавленном растворе аммония гидроксида.
A![]() gCl
+ 2NH4OH
[Ag(NH3)]Cl
+ 2H2O
gCl
+ 2NH4OH
[Ag(NH3)]Cl
+ 2H2O
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:роданометрический метод, основанный на образовании окрашенного продукта между избытком титранта и индикатором.
К 0,5 мл исследуемого раствора добавляют 1-3 капли ЖАК титруют 0,1М раствором аммония роданида до образования красно-бурого окрашивания.
A![]() gNO3
+ NH4NCS
AgNCS + NH4NO3
gNO3
+ NH4NCS
AgNCS + NH4NO3
3![]() NH4NCS
+ FeNH4(SO4)2
Fe(NCS)
3
+ 2NH4SO4
NH4NCS
+ FeNH4(SO4)2
Fe(NCS)
3
+ 2NH4SO4
F![]() экв=1
экв=1
Vтеор. = 0,015/0,016997 = 0,88
На титрование ушло 0,86мл 0,1М раствора аммония роданита, соответственно содержание исследуемого вещества в граммах равно:
![]()
Расчет отклонения:
Абс.ошибка:1,5 – 1,462 = 0,039;
Относит.ошибка:![]()
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески свыше 1 до 2 (5%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 08.04.13
Пропись № 1Rp:Fenobarbitali0,005 Фенобарбитал 0,005
Glucosi0,2 Глюкоза 0,2
D.t.d.N10
S: по одному порошку на ночь.
М.м.(глюкозы) =198,17 г/моль.
М.м. (фенобарбитала) = 232 г/моль.
Описание:на анализ поступил мелкокристаллический порошок белого цвета без запаха, завернутый в капсулу.
Т.к. согласно приказу № 214 физический контроль проводится с каждой серией фасовки в количестве не менее 3 упаковок. Для этого взвешивают 3 порошка, и определяют отклонение каждого от прописанной массы одного порошка.
M1=0,210
M2=0,200
M3=0,200
Mср=(0,21+0,2+0,2):3=0,203
Отклонение.ср= (0,203-0,200):0,200. 100%=1,67%
Отклонение не превышает допустимое приказом № 305 отклонение для массы отдельных доз порошков от 0,1 до 0,3 (10%).
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Фенобарбитал:используют реакцию комплексообразования с кобальта нитратом.
К ОЛИЧЕСТВЕННОЕ
ОПРЕДЕЛЕНИЕ:Количественное содержание
фенобарбитала в растворе определяют
методом нейтрализации (алкалиметрии)
в неводном растворителе. Этот метод
основан на образовании нейтрального
продукта под действием стандартного
раствора натрия гидроксида.
ОЛИЧЕСТВЕННОЕ
ОПРЕДЕЛЕНИЕ:Количественное содержание
фенобарбитала в растворе определяют
методом нейтрализации (алкалиметрии)
в неводном растворителе. Этот метод
основан на образовании нейтрального
продукта под действием стандартного
раствора натрия гидроксида.
На ручных весах отвешивают 0,2 навеску порошка и растворяют ее в 1 мл воды, прибавляют 1 мл этанола и 2 капли тимолфталеина и титруют 0,1М раствором натрия гидроксида до голубого окрашивания.

Fэкв=1
Расчет теоретического объема титранта:
![]()
На титрование ушло 0,22мл 0,1М раствора натрия гидроксида, соответственно содержание исследуемого вещества в граммах равно:

Ошибка не превышает допустимое приказом № 305 отклонение для массы навески до 0,02 (20%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2 Trituratio Dibazoli 1:10 cum glucozo 3,0
Тритурация Дибазола 1:10 с глюкозой 3,0
Состав:
Dibazoli0,3 М.м.(глюкозы) =198,17 г/моль.
Glucosi2,7 М.м. (дибазола) = 244,7 г/моль.
Описание:на анализ поступил мелкокристаллический порошок белого цвета без запаха в бесцветном, прозрачном штангалассе.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Дибазол:в тритурации определяют, действуя на слабокислый раствор препарата в хлористоводородной кислоте 0,1н раствором йода.
Т .е.
примерно 0,01-0,02 дибазола помещают в
колбу, добавляют 4-5 капель разбавленного
раствора хлористоводородной кислоты,
тщательно перемешивают и медленно
наслаивают 3-5 капель 0,1н раствор йода.
При этом на поверхности раствора
образуются зеркальные красноватые
чешуйки.
.е.
примерно 0,01-0,02 дибазола помещают в
колбу, добавляют 4-5 капель разбавленного
раствора хлористоводородной кислоты,
тщательно перемешивают и медленно
наслаивают 3-5 капель 0,1н раствор йода.
При этом на поверхности раствора
образуются зеркальные красноватые
чешуйки.
Глюкоза:определяют с реактивом Фелинга на альдегидную группу глюкозы. Для этого к приблизительно 0,5 мл ЛФ прибавляют 1-2 мл реактива Фелинга и нагревают до кипения. Образуется кирпично-красный осадок.
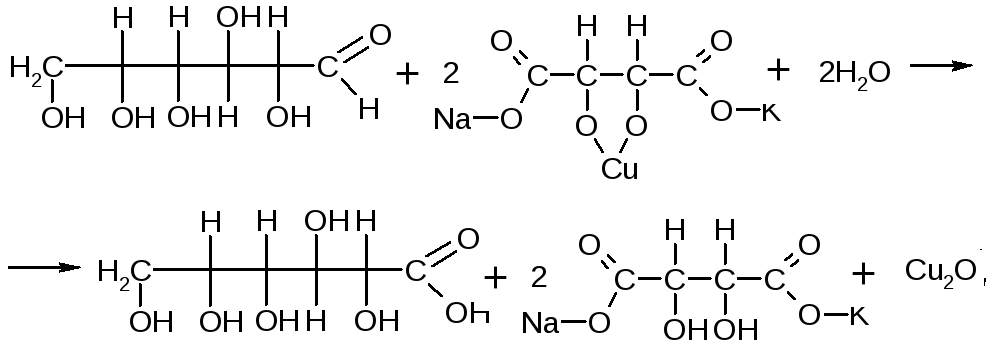
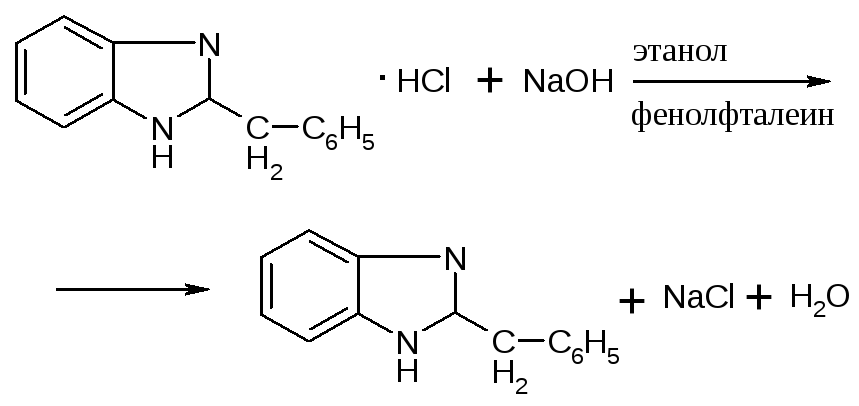
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:метод нейтрализации (алкалиметрии) по связанной хлористоводородной кислоте. Этот метод основан на образовании нейтрального продукта под действием стандартного раствора натрия гидроксида.
На ручных весах отвешивают 0,1 навеску порошка и растворяют ее в примерно 10 мл воды, прибавляют 3 капли этанола и 1 каплю фенолфталеина и титруют 0,1М раствором натрия гидроксида до розового окрашивания.
Fэкв=1
Р![]() асчет
теоретического объема титранта:
асчет
теоретического объема титранта:
Т.к. в 3,0 порошка содержится 0,3 дибазола, то
![]() в 0,1 - 0,01
в 0,1 - 0,01
На титрование ушло 0,42мл 0,1М раствора натрия гидроксида, соответственно содержание исследуемого вещества в граммах равно:

Ошибка не превышает допустимое приказом № 305 отклонение для массы навески 0,2 до 0,5 (8%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно
Дата: 09.04.13
Пропись № 1Rp:Sol.Glucosi20% - 1000,0 Раствор глюкозы 20% - 1000
Состав:
Glucosi 200,0
Sol. Acidi hydrochloridi 8,3% - 4,4 ml
Natrii Chloridi 5,2
Aquae purificatae ad 1000 ml
Описание:на анализ поступила бесцветная прозрачная жидкость без запаха, сладковатого вкуса без механических включений в прозрачном бесцветном флаконе.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Глюкоза:см 14.05.08 пропись № 2.
Кислота хлороводородная: Синяя лакмусовая бумага, смоченная исследуемым раствором, краснеет.
На
Na+: 
К 1 капле ЛФ на предметном стекле добавляют 1 каплю раствора пикриновой кислоты и выпаривают досуха. Желтые игольчатые рассматривают под микроскопом.
На Cl-:
N![]() aCl
+AgNO3AgCl+NaNO3
aCl
+AgNO3AgCl+NaNO3
Выпадает белый творожистый осадок, который легко растворим в разбавленном растворе аммония гидроксида.
A![]() gCl
+ 2NH4OH
[Ag(NH3)]Cl
+ 2H2O
gCl
+ 2NH4OH
[Ag(NH3)]Cl
+ 2H2O
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: Количественное содержаниеглюкозыв исследуемом растворе определяется методом рефрактометрии, основанном на измерении показателя преломления света (n) исследуемого вещества..
n= 1,3614
n0 = 1,333
F![]() = 0,00142
= 0,00142
О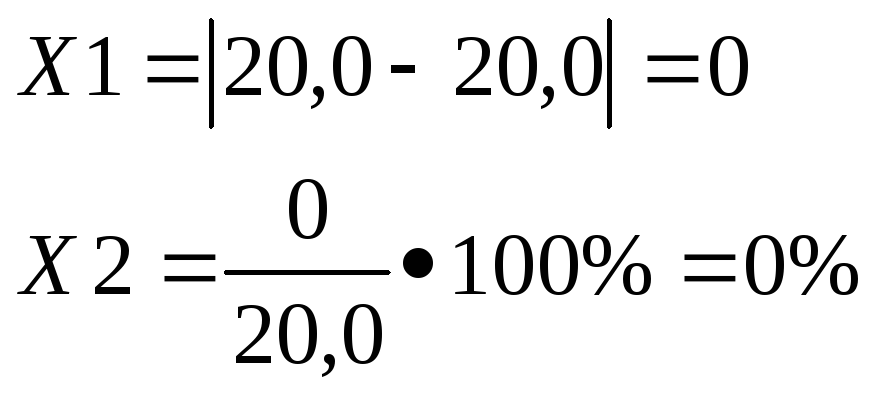 шибка
не превышает допустимое приказом № 305
(1%).
шибка
не превышает допустимое приказом № 305
(1%).
Количественное определение компонентов стабилизатора в растворе глюкозы:
Раздельное титрование:кислота хлороводородная, метод нейтрализации (алкалиметрия). Этот метод основан на образовании нейтрального продукта под действием стандартного раствора натрия гидроксида.
К 1 мл исследуемого раствора прибавляют 2 капли бромфенолового-синего и титруют 0,1 М раствором натрия гидроксида от желтой до фиолетово-синей окраски.
H![]() Cl
+ NaOH NaCl + H2O
Cl
+ NaOH NaCl + H2O
Fэкв=1
Т.к. для изготовления стабилизатора Вейбеля используется разбавленная кислота хлористоводородная, то используют условный титр.
Р![]() асчет
теоретического объема титранта на 1 мл
аликвоты раствора:
асчет
теоретического объема титранта на 1 мл
аликвоты раствора:
В 1000 мл раствора - 4,4 мл кислоты хлороводородной
![]() 2 мл - 0,0044 мл
2 мл - 0,0044 мл
На титрование ушел 0,1мл 0,1М раствора натрия гидроксида, соответственно содержание исследуемого вещества в граммах равно:
![]()
Расчет отклонения:
Абс.ошибка:4,4 – 4,393 = 0,007;
Относит.ошибка:![]()
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески от 2,0 до 5,0 (4%).
Суммарное титрование: сумма хлоридов. Метод аргентометрии (метод Мора), основанном на образовании малодиссоциируемых галогенитов серебра под действием стандартного раствора серебра нитрата.
К 1 мл исследуемого раствора прибавляют 1 каплю калия хромата и титруют 0,1М раствором серебра нитрата до образования оранжево-коричневого окрашивания.
N![]() aCl
+ AgNO3
AgCl + NaNO3
aCl
+ AgNO3
AgCl + NaNO3
Н![]() Сl
+ AgNO3
AgCl + HNO3
Сl
+ AgNO3
AgCl + HNO3
2![]() АgNO3+K2CrO4
2KNO3+
Ag2CrO4
АgNO3+K2CrO4
2KNO3+
Ag2CrO4
Fэкв=1
![]()
Расчет теоретического объема титранта:
Т![]() .к.
5,2 грамма натрия хлорида содержится в
1000мл раствора, то в 1мл содержится 0,0052г
.к.
5,2 грамма натрия хлорида содержится в
1000мл раствора, то в 1мл содержится 0,0052г
На титрование ушло 0,99 мл 0,1М раствора кислоты хлористоводородной, т.е. оттитровалась сумма хлоридов. Т.к. фактор эквивалентности в обоих случаях равен 1, то соответственно содержание натрия хлорида в граммах:
Абс.ошибка:5,2 – 5,2 = 0;
Относит.ошибка:![]() 0%
0%
О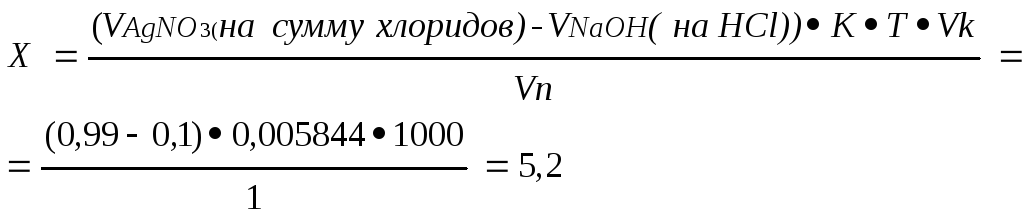 шибка
не превышает допустимое приказом № 305
отклонение для массы навески свыше 5,0
(3%).
шибка
не превышает допустимое приказом № 305
отклонение для массы навески свыше 5,0
(3%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2Sol.Ac.ascorbinici1%-30ml
Раствор кислоты аскорбиновой 1%-30 мл.
Описание: Бесцветная, прозрачная жидкость, без запаха и механических примесей. Общий объем 30 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
К 3мл исследуемого раствора прибавляют 0,5мл аммиачного раствора серебра, выпадает темный осадок.
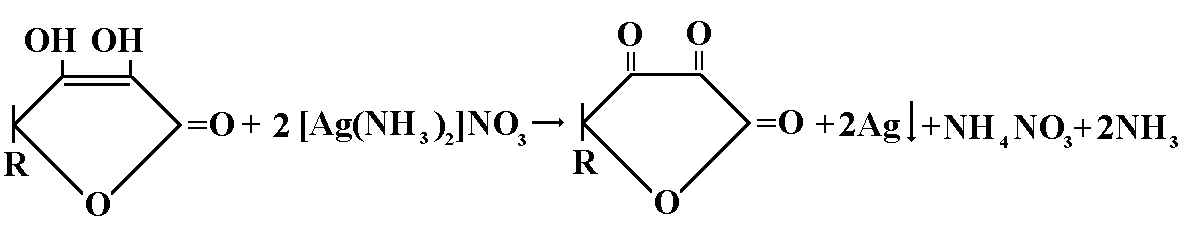
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:кислота аскорбиновая, определяется йодометрическим методом.
5 мл исследуемого раствора титруют 0,1 М раствором йода до синего окрашивания (индикатор крахмал).
Fэкв=1/2
Р![]() асчет
теоретического объема титранта:
асчет
теоретического объема титранта:
Т.к. в 30 мл ЛФ содержится 0,3 г аскорбиновой кислоты, то
![]() 1 мл - 0,01 г
1 мл - 0,01 г
На титрование ушло 1,15 мл 0,1М раствора йода, соответственно содержание исследуемого вещества в граммах равно:
![]()
Расчет отклонения:
Абс.ошибка:0,303– 0,3= 0,003;
Относит.ошибка:![]()
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески 0,2 до 0,5 (8%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 10.04.13
Пропись № 1Rp:Calciichloridi3,0 Кальция хлорид 3,0
Kaliiiodidi2,0 Калия йодид 2,0
Aquaepurificatae150mlВоды очищенной 150 мл
Описание: Бесцветная, прозрачная жидкость, без запаха и механических примесей. Общий объем 150 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
На Cl-: К 2-3 каплям ЛФ прибавляют 1 мл воды очищенной, 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется белый творожистый осадок.
N![]() aCl
+AgNO3AgCl+NaNO3
aCl
+AgNO3AgCl+NaNO3
Выпадает белый творожистый осадок, который легко растворим в разбавленном растворе аммония гидроксида.
A![]() gCl
+ 2NH4OH
[Ag(NH3)]Cl
+ 2H2O
gCl
+ 2NH4OH
[Ag(NH3)]Cl
+ 2H2O
Кальций-ион. К 1 мл ЛФ прибавляют по 2 капли гидроксида аммония и хлорида аммония, 4 капли раствора аммония оксалата. Образуется белый осадок, растворимый в разведенных минеральных кислотах.
На К+: реакция с раствором натрия (III) гексанитрокобальтата.
1-2 капли раствора, помещенного на предметное стекло, подкисляют уксусной кислотой и прибавляют 2 капли раствора натрия (III) гексанитрокобальтата, образуется желтый кристаллический осадок.
N![]() a3[Co(NO2)6]
+ 2 KСl K2Na[Co(NO2)6]
+ 2 NaCl
a3[Co(NO2)6]
+ 2 KСl K2Na[Co(NO2)6]
+ 2 NaCl
На I-: Используется реакция с раствором свинца ацетата.
К 0,5 мл раствора прибавляют 2-3 капли раствора свинца ацетата. Образуется осадок желтого цвета.
KI + Pb(CH3COO)2 = PbI2 + CH3COOK
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: сначала проводим трилонометрическое определение кальция хлорида, а затем определяем калия йодид методом перманганатометрии.
Кальция хлорид (трилонометрически). Метод основан на образовании устойчивого комплекса Трилона Б с ионами Ca2+.
К 0,5 мл ЛФ прибавляют 1 мл аммиачного буферного раствора, 1 каплю раствора кислотного хром черного специального и титруют 0,05 моль/л раствором Трилона Б до синего окрашивания.
В точке эквивалентности:
f=1
T= 0,05*219/1000 = 0,01095 г/мл
Vтеор. = 0,01/0,01095 = 0,91 мл
![]()
Абс.ошибка:3,0– 2,99= 0,01;
Относит.ошибка:![]()
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески 2 до 5г (4%).
Калия йодид: К 2 мл ЛФ прибавляют 5 мл раствора кислоты хлороводородной и титруют 0,1н раствором калия перманганата до появления светло-бурой окраски раствора. Затем прибавляют 1 мл раствора крахмала и снова титруют по каплям до перехода окраски в лимонно желтую.
2KMnO4+ 5KY+16HCl= 5YCl+7KCl+ 2MnCl2+ 8HCl
Т=0,0083005г/мл
Vтеор. = 0,023/0,0083005 = 3,21 мл
![]()
Абс.ошибка:2,0– 1,99= 0,01;
Относит.ошибка:![]()
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески 1 до 2г (5%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2Rp:Sol.Calciichloridi10% – 400mlКальция хлорида 40,0
Воды очищенной 400 мл
Описание: Бесцветная, прозрачная жидкость, без запаха и механических примесей. Общий объем 50 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ: см.предыдущую пропись.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: методику и химизм см. предыдущую пропись.
f=1
T= 0,05*219/1000 = 0,01095 г/мл
Vтеор. = 0,05/0,01095 = 4,56 мл
![]()
Абс.ошибка:40,29– 40,0= 0,29;
Относит.ошибка:![]()
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески 20 до 50г (5%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 11.04.13
Пропись № 1 Sol. Acidi aminocapronici 5%-400 ml
Раствор кислоты аминокапроновой 5%-400 мл
Описание:Бесцветная прозрачная жидкость, без запаха, без механических примесей. Общий объем – 400 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:К 2-3 мл исследуемого раствора прибавляют натрия гидроксид до розового окрашивания по фенолфталеину. После добавления к этому раствору формальдегида окрашивание исчезает.

КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Кислота аминокапроновая (кислотно-основное титрование в лед.CH3COOH). Титрант 0,1М раствор кислоты хлорной, приготовленной на ледяной уксусной кислоте. Индикатор – кристаллический фиолетовый.
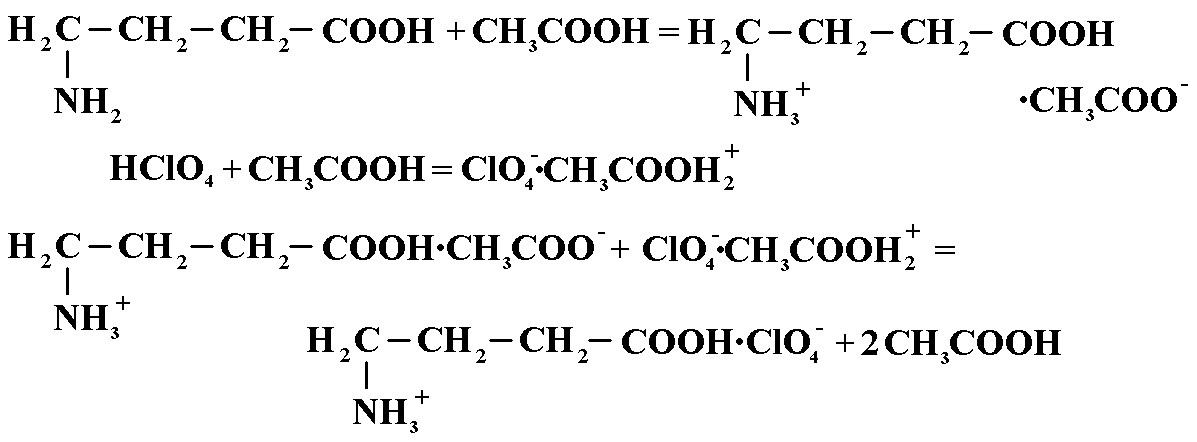
f=1
T= 0,1*103/1000 = 0,0103 г/мл
Vтеор. = 0,05/0,0103 = 4,85 мл
![]()
Абс.ошибка:20,0– 19,776= 0,224;
Относит.ошибка:![]()
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески 10 до 20г (8%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2 Rp: Sol. Cupri sulfatis 3% - 500 ml
D.Sнаружное для ФТК
Раствор меди сульфата 3%-500 мл
Описание:Голубая прозрачная жидкость, без запаха, без механических примесей. Общий объем – 500 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Меди сульфат.
SO42-К 0,5 г порошка прибавляют 1 мл воды, затем 5-6 капель раствора бария хлорида. Образуется белый осадок, нерастворимый в разведенных минеральных кислотах.
CuSO4+BaCl2→BaSO4↓ +CuCl2
Cu2+ К 0,5 г порошка прибавляют 1 мл воды, затем по каплям раствор аммиак. Образуется голубой осадок. После добавления избытка раствора аммиака осадок растворяется и появляется темно-синее окрашивание.
2CuSO4 + 2NH4OH → Cu2(OH)2SO4↓ + (NH4)2SO4
Cu2(OH)2SO4 + (NH4)2SO4 + 6NH4OH → 2[Cu(NH3)4]SO4 + 8 H2O
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Меди сульфат (трилонометрически). Метод основан на образовании устойчивого комплекса Трилона Б с ионамиCu2+.
К 0,5 мл ЛФ прибавляют 1 мл аммиачного буферного раствора, 1 каплю раствора кислотного хром черного специального и титруют 0,05 моль/л раствором Трилона Б до синего окрашивания.
Химизм смотри в прописи №1 за 16.04.08г
f=1
T= 0,05*249,68/1000 = 0,012484 г/мл
Vтеор. = 0,015/0,012484 = 1,20 мл
![]()
Абс.ошибка:15,0– 14,86= 0,14;
Относит.ошибка:![]()
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески 10 до 20г (8%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно
Дата: 12.04.13
Пропись № 1Rp:Sol.Zincisulfatis3% - 500ml
D.Sнаружное для ФТК
Раствор цинка сульфата 3%-500 мл
Описание:Бесцветная прозрачная жидкость, без запаха, без механических примесей. Общий объем – 500 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Цинка сульфат.
SO42-К 0,5 г порошка прибавляют 1 мл воды, затем 5-6 капель раствора бария хлорида. Образуется белый осадок, нерастворимый в разведенных минеральных кислотах.
ZnSO4+BaCl2→BaSO4↓ +CuCl2
Zn2+ К 1 мл исследуемого раствора добавляют 2-3 мл цинка-калия гексацианоферрата (II), образуется студенистый осадок, нерастворимый в кислоте хлороводордной.
3Zn2+ + 2K+ + 2[Fe(CN)6]4- → K2Zn3[Fe(CN)6]2 ↓
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Цинка сульфат (трилонометрически). Метод основан на образовании устойчивого комплекса Трилона Б с ионамиZn2+.
К 5 мл ЛФ прибавляют гексаметилентетрамина до рН 5-6; 1-2 капли ксиленового-оранжевого и титруют 0,05 моль/л раствором Трилона Б.
f=1
T= 0,05*287,4/1000 = 0,01437 г/мл
Vтеор. = 0,15/0,01437 = 10,44 мл
![]()
Абс.ошибка:15,09– 15,0= 0,09;
Относит.ошибка:![]()
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески 10 до 20г (8%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2 Rp.:NatriibromidiНатрия бромид 6,0
Kaliibromidiāā 6,0 Калия бромид 6,0
Aquaepurificatae150mlВода очищенная 150 мл
M.D.S.: по 1 столовой ложке 3 раза в день
Описание:Бесцветная прозрачная жидкость, без запаха, без механических примесей. Общий объем – 500 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
На бромид. К 0,5 мл ЛФ прибавляют 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется светло-желтый творожистый осадок.
NaBr(КBr) +AgNO3→AgBr↓светло-желт.+NaNO3 (КNO3)
Na+:
К 5 каплям раствора прибавляют 5 капель разведенной уксусной кислоты и 6-8 капель раствора цинк-уранил ацетата. Постепенно образуется желтый кристаллический осадок.
Пламя горелки окрашивается в желтый цвет.
К+: Реакция с раствором натрия (III) гексанитрокобальтата.
1-2 капли раствора, помещенного на предметное стекло, подкисляют уксусной кислотой и прибавляют 2 капли раствора натрия (III) гексанитрокобальтата Образуется желтый кристаллический осадок.
N![]() a3[Co(NO2)6]
+ 2 KСl K2Na[Co(NO2)6]
+ 2 NaCl
a3[Co(NO2)6]
+ 2 KСl K2Na[Co(NO2)6]
+ 2 NaCl
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Натрия бромид и калия бромид. Определяются совместно аргентометрическим методом Фаянса по сумме бромидов.
К 1 мл исследуемого раствора прибавляют 5-7 капель раствора калия хромата и титруют 0,1н раствором нитрата серебра до оранжево-желтого окрашивания.
NaBr(КBr) +AgNO3→AgBr↓светло-желт.+ NaNO3 (КNO3)
T AgNO3/NaBr = 0,1*102,88/1000 = 0,010288 г/мл
TAgNO3/KBr= 0,1*109,99/1000 = 0,010999 г/мл
Расчет фактических навесок:
NaBr: КBr:
В 150 мл ЛФ – 6,0г натрия бромида В 150 мл ЛФ – 6,0г калия бромида
В 1 мл (навеска) – х г В 1 мл (навеска) – х г
х= 0,04 г х= 0,04г

Vтеор. = 0,08/0,0106316 = 7,52 мл
![]()
Абс.ошибка: 12,0 – 11,96 = 0,04;
Отн.ошибка:
![]() (по
П №305 допустимо 8%).
(по
П №305 допустимо 8%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 15.04.13
Пропись № 1Rp:Novocaini3,5 Новокаин 3,5
NatriiChloridi0,25 Натрия хлорид 0,25
Aquaepurificatae100mlВода очищенная 100 мл
Описание: представляет собой бесцветную, прозрачную жидкость без запаха, без механических примесей. Общий объем – 100 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
На новокаин: реакция азосочитания. К 1 мл раствора прибавляют 5 – 6 капель разведенной кислоты хлористоводородной, 2 – 3 капли 0,1М раствора натрия нитрита, а затем 10 капель натрия гидроксида. Появляется вишнево-красное окрашивание.
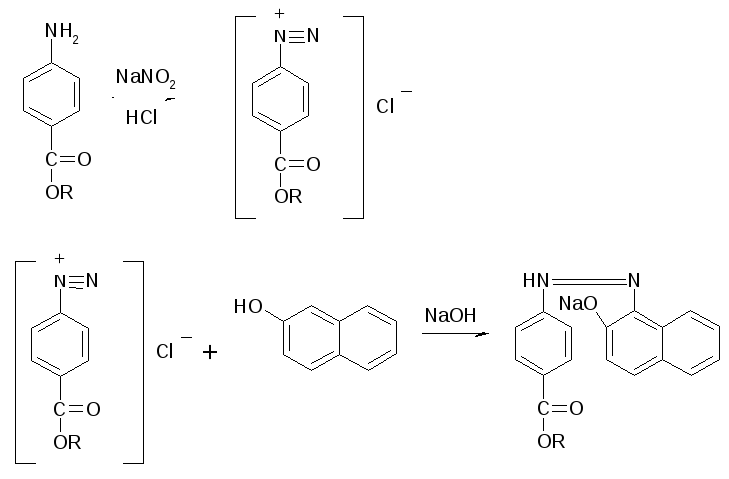
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: Определяются совместно аргентометрическим методом Фаянса по сумме бромидов.
К 1 мл ЛФ прибавляют 1 каплю бромфенолового синего, по каплям разведенную уксусную кислоту до зеленовато-желтого окрашивания и титруют 0,1 моль/л раствором серебра нитрата до фиолетового окрашивания.
HCl + AgNO3 → AgCl↓ + HNO3
f = 1
TAgNO3/Новок= 0,1*272,8/1000 = 0,02728 г/мл
TAgNO3/NaCl= 0,1*58,44/1000 = 0,005844 г/мл
Расчет фактических навесок:
Новокаин: NaCL:
В 100 мл ЛФ – 3,5г новокаина В 100 мл ЛФ – 0,25г NaCl
В 1 мл (навеска) – х г В 1 мл (навеска) – х г
х= 0,035 г х= 0,0025г
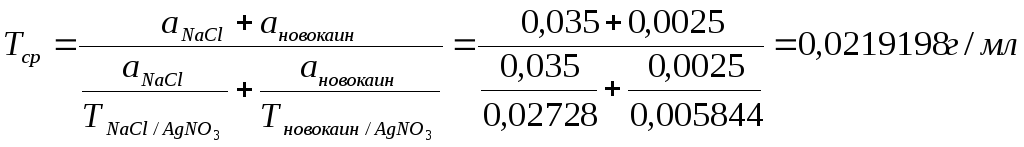
Vтеор. = 0,0375/0,0219198 = 1,71 мл
А![]() бс.ошибка:
3,75 – 3,73 = 0,02;
бс.ошибка:
3,75 – 3,73 = 0,02;
Отн.ошибка:
![]() (по
П №305 допустимо 4%).
(по
П №305 допустимо 4%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2Sol.Acidiglutaminici5% - 400ml
Раствор кислоты глутаминовой 5%-400 мл
Описание: Бесцветная прозрачная жидкость, без запаха, без механических примесей. Общий объем – 400 мл.
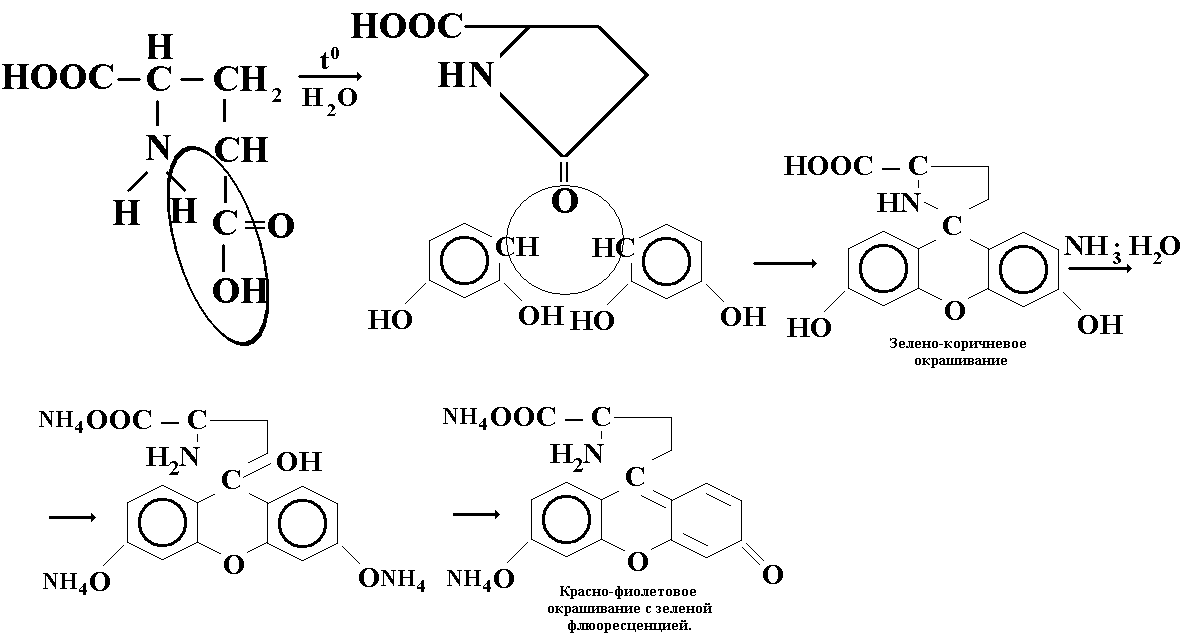
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ: 2-3 мл исследуемого раствора нагревают, образуется пирролидонкарбоновая кислота. Добавляем несколько кристаллов резорцина, образуется красно-фиолетовое окрашивание с зеленой флюоресценцией.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Кислота глутаминовая (алкалиметрия). К 1 мл ЛФ добавляют 2 капли нейтрального красного и титруют 0,1 н раствором гидроксида натрия до желтого окрашивания.

f=1T= 0,1*147,1/1000 = 0,01471 г/млVтеор. = 0,05/0,01471 = 3,39 мл
![]()
Абс.ошибка:20,01– 20,0= 0,01;
Относит.ошибка:![]()
Ошибка не превышает допустимое приказом № 305 (8%).
Заключение: Данная лекарственная форма приготовлена удовлетворительно.
Дата: 16.04.13
Пропись № 1Rp:Laevomycetini0,03
NatriiChloridi0,09
Aquaepurificatae10ml
Описание:на анализ поступил бесцветный прозрачный раствор с очень слабым зеленоватым оттенком без запаха, очень горького вкуса и без механических включений во флаконе из бесцветного прозрачного стекла.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
На Na+:реакция с цинк-уранил ацетатом (см.выше).
На Cl-:реакция с серебра нитратом (см.выше).
На левомицетин: Реакция с натрия гидроксидом при нагревании.
К 1 мл раствора прибавляют 0,5 мл раствора натрия гидроксида и нагревают 1-2 минуты. При этом образуется желтое окрашивание, переходящее в красно-оранжевое, при дальнейшем нагревании образуется кирпично-красный осадок и ощущается запах аммиака.
К оличественное
определение.
оличественное
определение.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Натрия хлорид: методом аргентометрии (метод Мора), основанном на образовании малодиссоциируемых галогенитов серебра под действием стандартного раствора серебра нитрата.
К 0,5 мл исследуемого раствора прибавляют 1 каплю калия хромата и титруют 0,1М раствором серебра нитрата до образования оранжево-коричневого окрашивания.
N![]()
![]() aCl
+ AgNO3
AgCl + NaNO3
aCl
+ AgNO3
AgCl + NaNO3
2![]() АgNO3+K2CrO4
2KNO3+
Ag2CrO4
АgNO3+K2CrO4
2KNO3+
Ag2CrO4
Fэкв=1
Р![]() асчет
теоретического объема титранта:
асчет
теоретического объема титранта:
Т![]() .к.
0,09 грамма натрия хлорида - в 10 мл раствора
.к.
0,09 грамма натрия хлорида - в 10 мл раствора
в 0,5 мл - х; х= 0,0045 грамма.
На титрование ушло 0,8 мл 0,1М раствора серебра нитрата, соответственно содержание натрия хлорида в граммах:
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески свыше 1 до 2 (5%).
Левомицетин:метод куприметрии, который основан на образовании комплексного соединения солей меди.
К 2 мл раствора прибавляют 2-3 капли 10%
натрия гидроксида и несколько крупинок
сухой мурексидной смеси и титруют 0,1М
раствором меди сульфата до перехода
окраски от фиолетового до кирпично-красного.
2 мл раствора прибавляют 2-3 капли 10%
натрия гидроксида и несколько крупинок
сухой мурексидной смеси и титруют 0,1М
раствором меди сульфата до перехода
окраски от фиолетового до кирпично-красного.
Fэкв=2
М.м. экв.левомицетина = М.м. левомицетина . Fэкв.= 2. 323,13=646,26 г/моль
Р![]() асчет
теоретического объема титранта:
асчет
теоретического объема титранта:
0![]() ,03
г левомицетина - в 10 мл раствора
,03
г левомицетина - в 10 мл раствора
в 2 мл - х; х=0,006 г.
На титрование ушло 0,1 мл 0,1М раствора меди сульфата, соответственно содержание левомицетина в граммах:
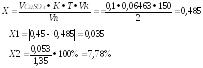
Ошибка не превышает допустимое приказом № 305 отклонение для массы навески свыше 0,2 до 0,5 (8%).
Заключение:ЛФ приготовлена удовлетворительно.
Пропись № 2Rp:Calciichloridi20%-10ml
Dimedroli 2,0
М.D.S: Глазные капли
Описание:представляет собой бесцветную, прозрачную жидкость без запаха, без механических примесей. Общий объем – 10 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
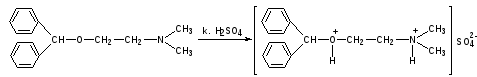
Димедрол. К 0,5 мл препарата прибавляют по стенке концентрированную серную кислоту. Появляется желтое окрашивание, исчезающее при взбалтывании.
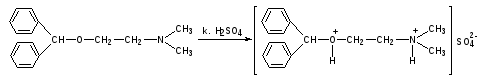
Кальция хлорид: см.пропись №2 за 10.04.13г.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: Определяются совместно аргентометрическим методом Фаянса по сумме бромидов.
К 0,5 мл ЛФ прибавляют 1 каплю бромфенолового синего, по каплям разведенную уксусную кислоту до зеленовато-желтого окрашивания и титруют 0,1 моль/л раствором серебра нитрата до фиолетового окрашивания.
* HCl + AgNO3 → AgCl↓ + HNO3 f = 1
HCl + AgNO3 → AgCl↓ + HNO3 f = 1
TAgNO3/димедрол= 0,1*291,8/1000 = 0,02918 г/мл
TAgNO3/СаCl2= 0,1*219,18/1000 = 0,021918 г/мл
Расчет фактических навесок:
Димедрол: СаCl2:
В 10 мл ЛФ – 2,0 г новокаина В 10 мл ЛФ – 2,0 г СаCl2
В 0,5 мл (навеска) – х г В 0,5 мл (навеска) – х г
х= 0,1 г х= 0,1г
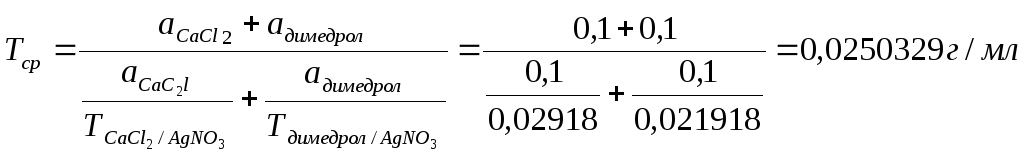
Vтеор. = 0,2/0,0250329 = 7,99 мл
![]()
Абс.ошибка: 4,01 – 4,0 = 0,01;
Отн.ошибка:
![]() (по
П №305 допустимо 4%).
(по
П №305 допустимо 4%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 17.04.13
Пропись № 1Rp: Sol. Ac. borici 2% – 70 ml
Раствор кислоты борной 2%-70 мл
Описание:Бесцветная прозрачная жидкость, без запаха, без механических примесей. Общий объем – 70 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Кислота борная. Выпаривают 5 капель раствора на водяной бане. К сухому остатку прибавляют 2 мл 96% этанола и поджигают. Наблюдают пламя с зеленой каймой.
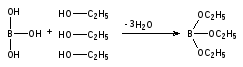
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Кислота борная (методом нейтрализации в присутствии глицерина). Метод основан на реакции нейтрализации борной кислоты раствором натрия гидроксида.
К 0,5 мл раствора прибавляют 1 каплю фенолфталеина, 1 мл глицерина, титруют 0,1 моль/л раствором натрия гидроксида.
F=1
ТК.борной/NaOH=0,1*61,84/1000=0,006184г/мл
Vтеор. = 0,01/0,006184 = 1,62 мл
![]()
Абс.ошибка: 1,42 – 1,40= 0,02;
Отн.ошибка:
![]() (по
П №305 допустимо 5%).
(по
П №305 допустимо 5%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2Rp:Sol.Protargoli2%-80ml
D.S. для инстилляций.
Раствор протаргола 2%-80 мл
Описание:Коричнево-желтый раствор, без запаха. В склянке из темного стекла. Общий объем – 80 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ: Серебро в данном соединении находится в недиссоциированном состоянии. Сначала проводят минерализацию полным озолением. Полученный серовато-белый остаток обрабатывают азотной кислотой. Далее проводят реакции на ион серебра.
С хлорид ионом образует белый творожистый осадок серебра хлорида.
Ag++Cl-→AgCl↓
AgCl↓+2NH3*H2O→[Ag(NH3)2]Cl+2H2O
AgCl+(NH4)2CO3→ [Ag(NH3)2]Cl=CO2+H2O
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: тиационатометрия.
1 мл исследуемого раствора титруют 0,1 н раствором тиоцианата аммония.
Протаргол + HNO3→AgNO3+CO2+H2O
AgNO3+NH4SCN→AgSCN+NH4NO3
л.к. NH4SCN+FeNH4(SO4)2→Fe(SCN)3+2(NH4)2SO4
Fэкв=1
![]()
![]()
Расчет теоретического объема:
В 80 мл раствора - 1,6 г кислоты хлороводородной
![]() 1 мл - 0,02 г
1 мл - 0,02 г
На титрование ушел 0,15 мл 0,1 н раствором тиоцианата аммония, соответственно содержание исследуемого вещества в граммах равно:
![]()
Абс.ошибка: 1,62 – 1,60= 0,02;
Отн.ошибка:
![]() (по
П №305 допустимо 5%).
(по
П №305 допустимо 5%).
Заключение:Данная лекарственная форма приготовлена удовлетворительно.
Дата: 18.04.13
Пропись № 1Rp.:Ac.Ascorbinici 0,2
Pyridoxini Pyridoxini
шку 3 раза в деньпробкой войной слой марли в отпускной флакон, в последнюю очередь прибавляем эфирин растворяем в спhydrochloride 0,05
Ac. Nicotinici 0,02
Sacchari 0,05
M.f.pulv.
D.t.d. №30
S.: по 1 порошку 3 раза в день
Кислоты аскорбиновой 0,2
Пиридоксина гидрохлорида 0,05
Кислоты никотиновой 0,02
Сахар 0,5 Мпор=0,32 г
Дай таких доз № 30 Мобщ=9,60 г
Описание:Белый мелкокристаллический порошок со специфическим запахом. Масса одного порошка 0,32 г, общая масса 9,60 г.
Т.к. согласно приказу № 214 физический контроль проводится с каждой серией фасовки в количестве не менее 3 упаковок. Для этого взвешивают 3 порошка, и определяют отклонение каждого от прописанной массы одного порошка.
M1=0,310
M2=0,320
M3=0,320
Mср=(0,31+0,32+0,32):3=0,316г
Отклонение.ср= (0,32-0,316):0,32* 100%=1,25%
Отклонение не превышает допустимое приказом № 305 отклонение для массы отдельных доз порошков от 0,3 до 1,0 (5%).
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
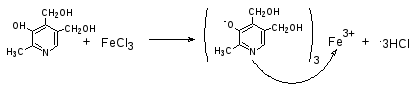
Пиридоксина гидрохлорид. К 0,01 г порошка прибавляют 1 мл железа (III) хлорида, появляется красное окрашивание, исчезающее при прибавлении разведенной кислоты серной.
Хлорид-ион. К 0,01 г порошка прибавляют 1 мл воды очищенной, 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется белый творожистый осадок.
HCl+AgNO3→AgCl↓бел.+HNO3
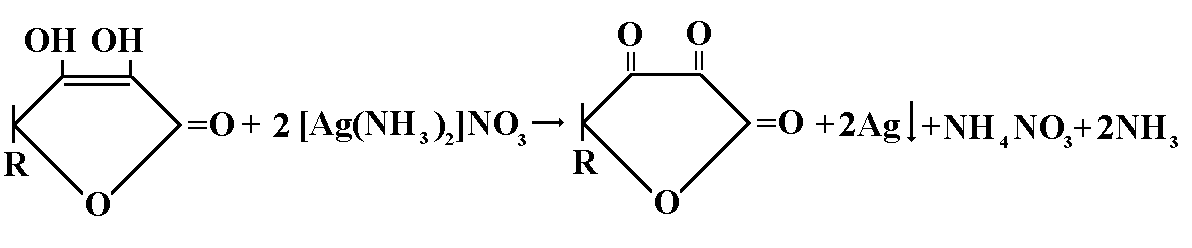
Кислота аскорбиновая:К 3мл исследуемого раствора прибавляют 0,5мл аммиачного раствора серебра, выпадает темный осадок.
Кислота никотиновая: Реакция комплексообразования с сульфатом меди.
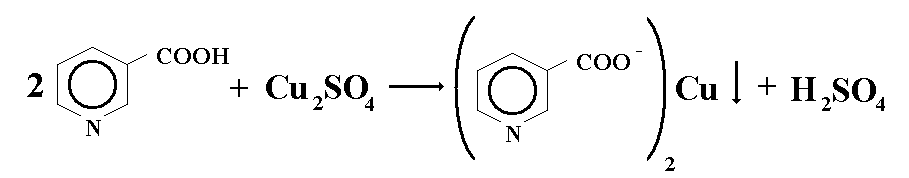
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
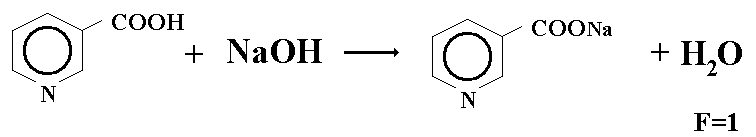
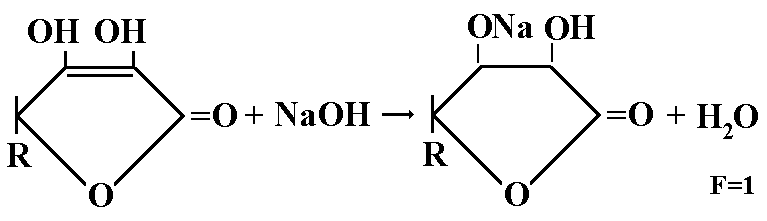
1.Сумму 3 кислотаскорбиновой, никотиновой и хлороводордной (пиридоксина гидрохлорид) определяют алкалиметрически.
Берем навеску порошка 0,1г добавляем 1 мл воды, добавляем 1-2 капли нейтрального-красного и титруют 0,1 н раствором натрия гидроксида до желтого окрашивания.
HCl+AgNO3→AgCl↓бел.+HNO3F=1
![]()
![]()
![]()
Расчет теоретического объема титранта:
Т![]() .к.
в 0,32 г ЛФ содержится 0,05 г пиридоксина
г/хл, то
.к.
в 0,32 г ЛФ содержится 0,05 г пиридоксина
г/хл, то
0,1 г - 0,016 г
![]()
Т.к. в 0,32 г ЛФ содержится 0,2г аскорбин.к-ты, то
0,1 г - 0,063 г
![]()
Т.к. в 0,32 г ЛФ содержится 0,02г никотин.к-ты, то
0,1 г - 0,0063г
Суммарный объем NaOH=0,77+3,58+0,51=4,86мл
2.Кислота аскорбиновая: определяется йодометрическим методом.
Берем навеску 0,1г и растворяем ее в 5мл воды, титруют 0,1 М раствором йода до синего окрашивания (индикатор крахмал).
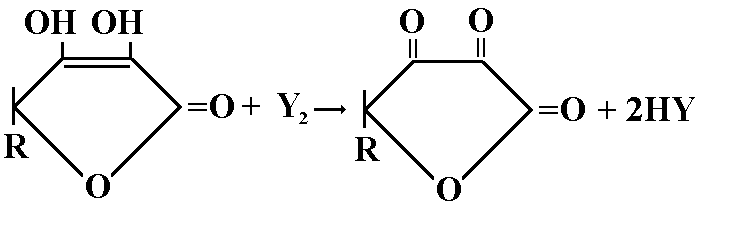
Fэкв=1/2
Р![]()
![]() асчет
теоретического объема титранта:
асчет
теоретического объема титранта:
Т.к. в 0,32 г ЛФ содержится 0,2г аскорбин.к-ты, то
0,1 г - 0,063 г
На титрование ушло 0,71 мл 0,1М раствора йода, соответственно содержание исследуемого вещества в граммах равно:
![]()
Расчет отклонения:
Относит.ошибка: 0%
3.Пиридоксина гидрохлорид: Берем навеску 0,1г и растворяем ее в 5мл воды, добавляем 2-3 капли бромфенолового-синего, по каплям уксусную кислоту до получения зеленовато-желтого окрашивания, и титруют 0,1 н раствором нитрата серебра.
![]()
![]()
Т.к. в 0,32 г ЛФ содержится 0,05 г пиридоксина г/хл, то
0,1 г - 0,016 г
![]()
Расчет отклонения:
Отн.ошибка: 0% (по П №305 допустимо 15%).
