
- •1.Структурные уровни организации материи
- •1.1.Квантовомеханическое описание микромира
- •1.1.1. Квантово-механическая концепция
- •1.1.2. Атомно - молекулярное учение.
- •1.1.3.Химическая связь
- •1.2.Cостав и строение твердых тел
- •1.2.1.Кристаллические и аморфные тела
- •1.2.2.Кристаллическая решетка
- •1.2.3.Анизотропия кристаллов
- •1.2.4.Классификация кристаллов по типам сил связи
- •Атомные кристаллы
- •Металлические кристаллы
- •Молекулярные кристаллы
- •1.2.5.. Дефекты кристаллов
- •1.3.Космологические модели Вселенной
- •1.3.1.Теория стационарного состояния Вселенной
- •1.3..3. Происхождение и эволюция Вселенной
- •1.3.4.Начало и конец времени существования Вселенной?
- •1.3.6.Структура Вселенной
- •1.4. Вопросы для самоконтроля
- •1.5. Литература
1.2.4.Классификация кристаллов по типам сил связи
Классификация кристаллов по кристаллическим системам дает представление о геометрических характеристиках кристалла, но не затрагивает вопроса о природе сил, удерживающих атомы (молекулы или ионы) в определенных местах друг относительно друга — в узлах кристаллической решетки.
Можно произвести классификацию кристаллов в зависимости от физической природы сил, действующих между частицами .кристалла. Тогда мы получим четыре типа кристаллов (и кристаллических решеток):ионные, атомные, металлические и молекулярные.
ИОННЫЕ КРИСТАЛЛЫ
В .узлах кристаллической решетки ионных кристаллов находятся ионы. Ионы располагаются так, что силыкулоновскогопритяжения между ионами противоположного знака больше, чем'силы отталкивания между ионами одного знака. Таким образом, ионная связь обусловлена, в основном, электростатическим взаимодействием противоположно заряженных ионов. Ионная связь является. типичной для неорганических соединений.
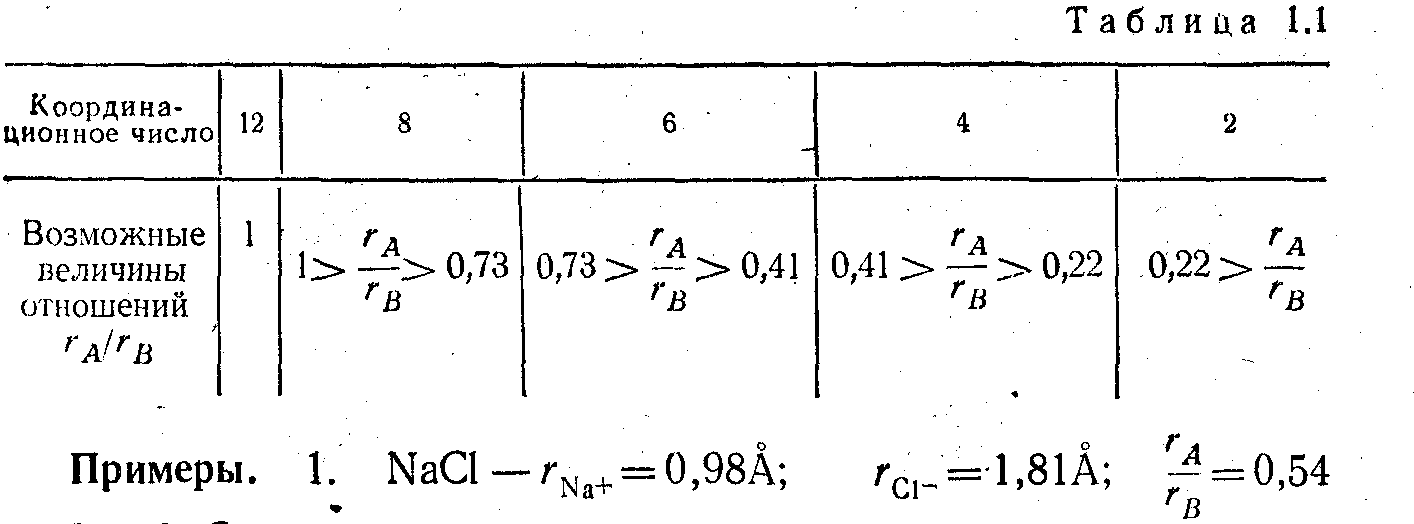
Число ионов противоположного знака,
которое составляет ближайшее окружение
данного иона в кристалле, называется
координационным числом (К.)
ЗначениеК определяется
величиной отношения радиусов ионов
противоположного знака![]()
Чем ближе это отношение к единице, тем большеК (табл.1.1)
и K =6.ото соответствуетгранецентрированнойкубическойрешетке.На рис. 1.18,а показано расположение узлов решеткиNаСl,

причем черные кружки обозначают![]() Из
рисунка а белые —
Из
рисунка а белые —![]() видно,
что центральный ион хлора имеет шесть
ближайших соседей (ионы натрия), с
которыми он соединен пунктиром.
Кристаллическая структура хлористого
натрия может быть представлена как
совокупность двух кубическихгранецентрированныхрешетокБравеиз ионов
натрия и хлора, смещенных друг относительно
друга на половину ребра куба.
видно,
что центральный ион хлора имеет шесть
ближайших соседей (ионы натрия), с
которыми он соединен пунктиром.
Кристаллическая структура хлористого
натрия может быть представлена как
совокупность двух кубическихгранецентрированныхрешетокБравеиз ионов
натрия и хлора, смещенных друг относительно
друга на половину ребра куба.
На рис. 1.18, б решетка NаСlпредставлена в виде модели, в которой соблюдены масштабы ионных радиусов.
![]()
Структура хлористого цезия представляет собой совокупность двух примитивных кубических решеток Бравеиз ионов цезия и хлора, вдвинутых одна в другую по направлению пространственной диагонали на половину ее длины. В этом кристалле можно выделить ячейку в виде центрированного куба, в которой каждый положительный ион це^1я окружен восемью отрицательными ионами хлора (рис. 1.19, а). Эта ячейка не будет являться элементарной ячейкой решетки Браве, но выбор ее удобен для расчета периода решетки(см. §7). На рис. 1.19, б изображена модель кристалла хлористого цезия с учетом относительного размера ионных радиусов .
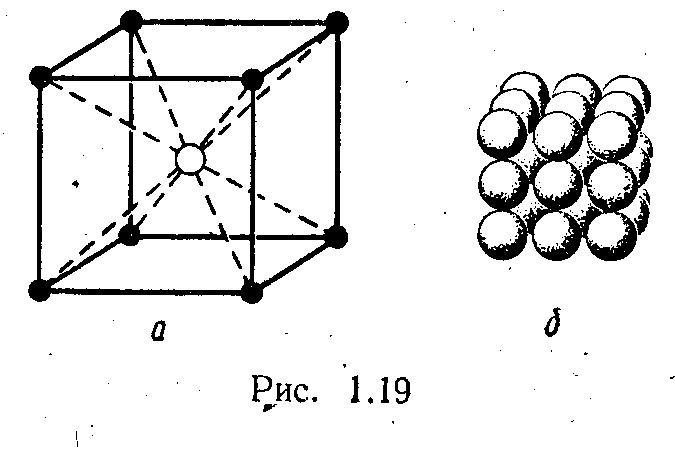
Ионные кристаллы обладают малой электропроводностью при низких температурах, хорошей ионной проводимостью при высоких температурах и сильным инфракрасным поглощением.
В ионных кристаллах одинаковой структуры силы взаимодействия между положительными и отрицательными ионами тем больше, чем больше их валентность и чем меньше сумма их радиусов. А чем больше сила взаимодействия между ионами, тем выше твердость, температура плавления кристалла и тем меньше его растворимость.
