
- •Лекция n 20-23. Растворы электролитов
- •1. Растворы электролитов. Слабые электролиты. Закон разбавления Оствальда
- •Растворы слабых электролитов
- •2. Сильные электролиты. Активность. Ионная сила раствора
- •3. Электролитическая диссоциация воды, рН раствора. Расчет рН растворов сильных и слабых электролитов..
- •Расчет рН растворов сильных и слабых электролитов.
- •4. Буферные растворы. Буферные системы живых организмов.
- •Типы буферных систем.
- •Расчет рН буферных растворов.
- •Механизм действия буферных систем
- •Буферные системы живого организма
- •3.Белковые буферные системы.
- •5. Гидролиз солей
- •Влияние различных факторов на гидролиз.
- •6. Равновесие в системе осадок – раствор электролита
- •Условия растворения и осаждения труднорастворимых электролитов
- •7. Равновесия в растворах комплексных соединений
- •Токсичность солей тяжелых металлов
Буферные системы живого организма
Организм человека поддерживает постоянство внутренней среды – гомеостаз. Кислотно-основной гомеостаз означает постоянное значение рН биологических жидкостей: плазма крови – 7,40,05; эритроциты – 7,25; желудочный сок – 0,91,1; поджелудочная железа – 7,57,8. Постоянное значение рН необходимо для функционирования ферментов и гормонов, которые проявляют активность только в узком интервале рН (пепсин рН 1, амилаза рН 6,7, трипсин 7,58), для поддержания осмотического гомеостаза, для обеспечения каталитического действия ионов Н+.
Особенно важно поддержание постоянства рН крови. Отклонение рН плазмы крови на 0,4 ед. может за собой летальный исход. Отклонение рН в кислотную область называют ацидозом, в щелочную –алкалозом.
Поддержание постоянного уровня рН в крови и тканевых жидкостях достигается с помощью регуляторных механизмов, включающих несколько буферных систем. Основными буферными системами крови являются следующие.
1. Гидрокарбонатная буферная система, характеризующаяся равновесием молекул слабой угольной кислоты с образующимися при ее диссоциации гидрокарбонат-ионами:
H2CO3=H++HCO3-
В организме угольная кислота возникает в результате гидратации диокида углерода – продукта окисления углеводов, белков и жиров.
![]()
При ацидозе это равновесие смещается влево и избыток СО2 через легкие выводится из организма. Ацидоз может быть вызван, например, образованием в мышцах избытка молочной кислоты при интенсивной физической нагрузке.
![]()
Ацидоз возникает также в душных помещениях при избытке в воздухе СО2.
рН гидрокарбонатного буфера определяется уравнением:
рН
= pKa1(H2CO3) + lg![]()
Для
поддержания нормального значения рН
плазмы крови 7,4, соотношение
![]() должно быть равно11,2. Так как концентрация
гидрокарбонат-ионов в крови существенно
выше, буферная емкость гидрокарбонатного
буфера в крови по кислоте ( 40 ммоль/л)
значительно больше, чем по щелочи
(1-2ммоль/л).
должно быть равно11,2. Так как концентрация
гидрокарбонат-ионов в крови существенно
выше, буферная емкость гидрокарбонатного
буфера в крови по кислоте ( 40 ммоль/л)
значительно больше, чем по щелочи
(1-2ммоль/л).
1. Фосфатная буферная система характеризуется равновесием между гидрофосфат- и дигидрофосфат-ионами:
H2PO4- = HPO42- + H+
и обусловлена присутствием в основном неорганических фосфатов.
Эта буферная система играет важную роль в поддержании постоянства рН крови, особенно внутриклеточной жидкости эритроцитов. рН фосфатного буфера рассчитывается по формуле:
рН
= pKa2(H3PO4)
+ lg
и
соотношение
 в
плазме крови (рН 7,4) составляет 1,6.
в
плазме крови (рН 7,4) составляет 1,6.
Буферная емкость фосфатной буферной системы ниже, чем гидрокарбонатной: по кислоте – 1-2 ммоль/л, по щелочи – 0,5 ммоль/л.
3.Белковые буферные системы.
Основными белками крови являются гемоглобин, оксигемоглобин, альбумин. Значение изоэлектрической точки этих белков лежит в интервале 4,96,3, т.е. при физиологическом значении рН они представляют собой анионы, а их буферное действие обеспечивается существованием равновесия:
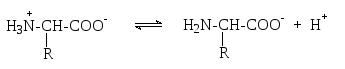
Это равновесие между ионами гемоглобина Hb- и самим гемоглобином HHb, являющимся очень слабой кислотой (KHHb = 6,310-9, pKHHb = 8,2), а также равновесие между ионами оксигемоглобина HbO2- и самим оксигемоглобином HhbO2, который является несколько более сильной кислотой, чем гемоглобин (KHHbO2 = 1,1210-7, pKHHbO2 = 6,95).
В эритроцитах белковая система гемоглобин-оксигемоглобин тесно связана с гидрокарбонатной буферной системой.
Мощность буферных систем плазмы крови уменьшается в направлении:
гидрокарбонатная (40 ммоль/л) > белковая (310 ммоль/л) > фосфатная (12ммоль/л)
