
- •Лекция № 25-28. Окислительно-восстановительные и электрохимические процессы
- •1. Окислители и восстановители
- •Элементы в низших степенях окисления (Na2s-2,ki-1) проявляют только восстановительные свойства, так как не способны присоединять электроны.
- •2. Составление уравнений окислительно-восстановительных реакций. Метод электронно-ионного баланса
- •3. Типы окислительно-восстановительных реакций
- •4. Электрохимические процессы. Механизм возникновения электродного потенциала
- •5. Гальванический элемент Даниэля-Якоби
- •6. Электродвижущая сила (эдс) гальванического элемента
- •7. Измерение электродных потенциалов. Стандартный водородный электрод
- •8. Потенциалы металлических и газовых электродов. Уравнение Нернста
- •9. Окислительно-восстановительные электроды. Направление самопроизвольного протекания окислительно-восстановительных реакций
- •10. Значение окислительно-восстановительных процессов в биологии и медицине
- •11. Потенциометрические методы анализа
8. Потенциалы металлических и газовых электродов. Уравнение Нернста
В гальваническом элементе, составленном из металлического и водородного электродов
Pt, H2 | H+ || Men+| Me
![]()
![]()
протекает токообразующая реакция:
Men++n/2Н2= Ме +nH+
Так
как по условию
![]() и
и![]()
![]() ,
то для данного электрода уравнение (3)
имеет вид:
,
то для данного электрода уравнение (3)
имеет вид:
![]() (4)
(4)
Уравнение (4) называют уравнением Нернста. Переходя от натуральных логарифмов к десятичным и подставляя в уравнение (4) Т = 298К и значенияRиF, получаем:
![]() (5)
(5)
Величина
![]()
![]() -
стандартный электродный потенциал
металла.
-
стандартный электродный потенциал
металла.
Стандартным электродным потенциалом называют потенциал металлического электрода в растворе собственных ионов с концентрацией 1 моль/л.
На основе стандартных электродных потенциалов построен ряд напряжений металлов. Стандартный электродный потенциал является мерой восстановительной способности металла и окислительной способности его ионов. Чем меньше алгебраическое значение потенциала металла, тем сильнее его восстановительные свойства и тем слабее окислительная способность его ионов.
Для
водородного электрода при
![]() уравнение
Нернста имеет вид:
уравнение
Нернста имеет вид:
![]()
Учитывая, что рН = -lg[H+], получаем:
![]()
9. Окислительно-восстановительные электроды. Направление самопроизвольного протекания окислительно-восстановительных реакций
Окислительно-восстановительный электрод представляет собой пластину из инертного материала (Pt), которая контактирует с раствором, содержащим окисленную (Ox) и восстановленную (Red) формы вещества.
Pt|Ox,Red
На электроде устанавливается равновесие:
Ox+ne=Red
Материал электрода не участвует в окислительно-восстановительном процессе, а является лишь проводником электронов. Разность потенциалов между пластиной и раствором возникает за счет обмена электронами.
Уравнение Нернста для окислительно-восстановительного электрода имеет вид:
![]()
где
![]() -стандартный окислительно-восстановительный
потенциал, измеренный при концентрациях
всех участников электродной реакции,
равных 1.
-стандартный окислительно-восстановительный
потенциал, измеренный при концентрациях
всех участников электродной реакции,
равных 1.
Например, для окислительно-восстановительной системы
Fe3++e=Fe2+
уравнение Нернста имеет вид:
![]()
В более сложных системах потенциал зависит от рН среды. Например, для системы
MnO4–+ 8H++ 5e=Mn2++ 4H2O
![]() = E°
+
= E°
+
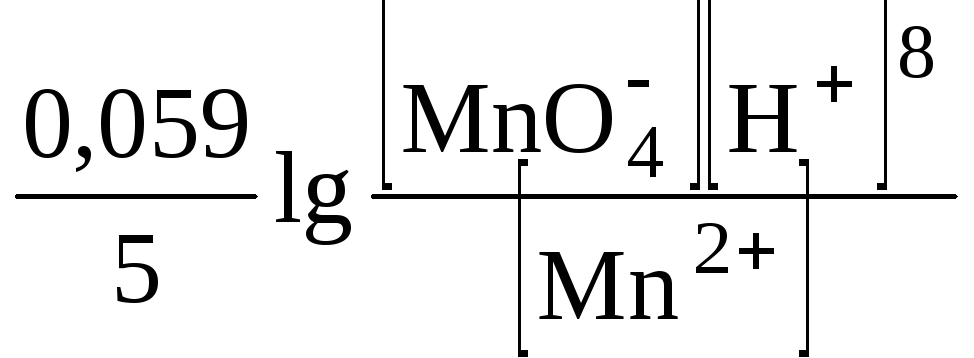
Стандартные окислительно-восстановительные потенциалы (редокс-потенциалы) приводятся в таблицах и являются мерой окислительной и восстановительной способности системы.
Окислительная способность системы возрастает со сдвигом потенциала в сторону положительных значений. Например, стандартный потенциал систем:
Hal2+ 2e= 2Hal-
уменьшается
в ряду фтор, хлор, бром, иод. Это означает,
что наиболее сильным окислителем в этом
ряду является фтор (![]() ),
а наиболее слабым окислителем – иод
(
),
а наиболее слабым окислителем – иод
(![]() ).
).
Восстановительная способность системы, напротив, растет со сдвигом потенциала в сторону отрицательных значений. Так, ряду галогенид-анионов наилучшим восстановителем является иодид-ион, в то время как фторид-анион восстановительных свойств практически не проявляет.
Значение окислительно-восстановительных потенциалов можно использовать для определения направления самопроизвольного протекания окислительно-восстановительных процессов. Согласно IIзакону термодинамики условием самопроизвольности процесса при изобарно-изотермических условиях является убыль энергии Гиббса системы (G<0). С другой стороныG = - nFE и, следовательно, самопроизвольно будут протекать процессы, для которыхE >0 или
Е окислителя > Е восстановителя.
Таким образом, система с высоким окислительно-восстановительным потенциалом будет окислителем по отношению к системе с низким потенциалом.
Задача:
Какая реакция будет протекать в системе
FeCl2,
FeCl3,
SnCl2,
SnCl4 при
стандартном состоянии, если
![]() ,
а
,
а![]()
Система Fe3+/Fe2+обладает более высоким значением потенциала и, следовательно, будет окислителем по отношению к системеSn4+/Sn2+. Таким образом, в данной системе будет протекать реакция окисления олова (II) соединением железа (III):
2FeCl3 + SnCl2 = 2FeCl2 + SnCl4
Использование стандартных потенциалов характеризует направление реакции при концентрациях всех участников реакции равных 1 моль/л. Как следует из уравнения Нернста, изменение концентраций окисленной и восстановленной форм, а в некоторых случаях и рН среды влияет на значение электродного потенциала и, следовательно, может влиять на направление протекания процесса.
Значительное влияние на редокс-потенциал системы оказывает комплексообразование и осаждение.
Рассмотрим влияние комплексообразования на редокс-потенциална примере взаимодействия ртути с иодоводородной кислотой. Как известно, ртуть не растворяется в разбавленных кислотах, так как редокс-потенциал системы
Hg2++2e=Hg
![]() E0=0,85B
E0=0,85B
значительно превышает потенциал водородного электрода:
2H++ 2e=H2Е0= 0 В
Однако в ртуть растворяется в иодоводородной кислоте, так как при избытке иодид-ионов образует устойчивый комплексный ион HgI42-с константой нестойкости Кн=10-30.
Уменьшение концентрации свободных ионов Hg2+за счет комплесообразования приводит к значительному снижению редокс-потенциала, который может быть рассчитан с учетом величины Кн.
[HgI4]2- = Hg2+ + 4I-
![]()
При стандартном состоянии [HgI42-]=1 моль/л и [I-]=1 моль/л, а [Hg2+]=Кн. Отсюда
![]()
![]()
Снижение редокс-потенциала до отрицательных значений делает процесс растворения ртути в иодоводородной кислоте термодинамических возможным.
Hg+ 4HI=H2[HgI4] +H2
