
- •Лекция № 25-28. Окислительно-восстановительные и электрохимические процессы
- •1. Окислители и восстановители
- •Элементы в низших степенях окисления (Na2s-2,ki-1) проявляют только восстановительные свойства, так как не способны присоединять электроны.
- •2. Составление уравнений окислительно-восстановительных реакций. Метод электронно-ионного баланса
- •3. Типы окислительно-восстановительных реакций
- •4. Электрохимические процессы. Механизм возникновения электродного потенциала
- •5. Гальванический элемент Даниэля-Якоби
- •6. Электродвижущая сила (эдс) гальванического элемента
- •7. Измерение электродных потенциалов. Стандартный водородный электрод
- •8. Потенциалы металлических и газовых электродов. Уравнение Нернста
- •9. Окислительно-восстановительные электроды. Направление самопроизвольного протекания окислительно-восстановительных реакций
- •10. Значение окислительно-восстановительных процессов в биологии и медицине
- •11. Потенциометрические методы анализа
6. Электродвижущая сила (эдс) гальванического элемента
В гальваническом элементе совершается электрическая работа, которая может быть рассчитана как произведение количества электричества на разность потенциалов:
Amax = nFE,
где n – число молей эквивалентов вещества, которое превращается на электродах;
F = 96500 Кл/моль – число Фарадея;
nF – количество прошедшего электричества;
E – электродвижущая сила гальванического элемента (ЭДС).
ЭДС - это максимальная разность потенциалов гальванического элемента (разность равновесных электродных потенциалов катода и анода).
E= Екатода- Еанода
С другой стороны, максимальная полезная работа, которую может совершить система, равна убыли энергии Гиббса. Отсюда
G= -Amax
G= -nFE (1)
Работа гальванического элемента - процесс самопроизвольный (G<0). Следовательно, величина ЭДС должна быть положительной E>0, а Екатода>Еанода.
Уравнение (1) позволяет при известном значении G рассчитатьE и, наоборот, измерение ЭДС гальванического элемента является способом экспериментального определения изменения энергии Гиббса в ходе токообразующей реакции.
Согласно уравнению изотермы химической реакции для процесса
mA + nB =pC + qD
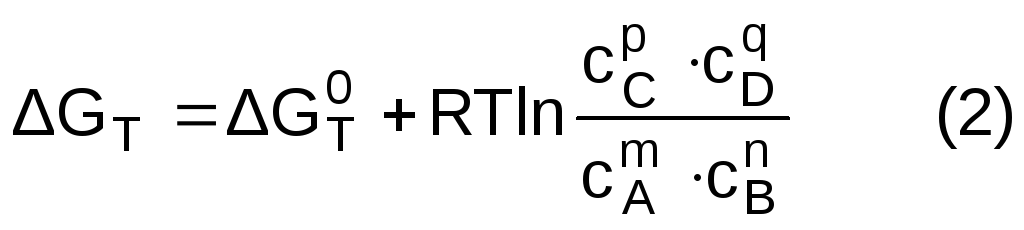
Подставляя уравнение (2) в уравнение (1) и решая полученное уравнение относительно E, получаем:
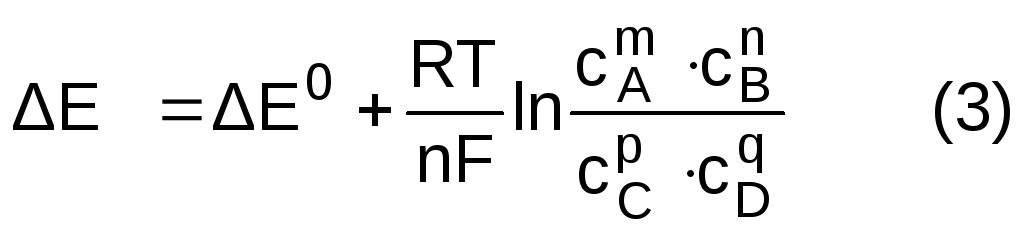
где
![]() - стандартная ЭДС гальванического
элемента при концентрация всех участников
электродной реакции, равных 1.
- стандартная ЭДС гальванического
элемента при концентрация всех участников
электродной реакции, равных 1.
Например, для гальванического элемента Даниэля-Якоби:
![]()
7. Измерение электродных потенциалов. Стандартный водородный электрод
В настоящее время не существует методов измерения абсолютных значений электродных потенциалов. Поэтому для характеристики электродов используют относительные величины. Для этого определяют разность потенциалов измеряемого электрода и стандартного электрода, потенциал которого условно принимают равным нулю. В настоящее время за ноль принят потенциал стандартного водородного электрода.
Водородный электрод относится к газовым электродам. Газовые электроды состоят из инертного металлического проводника (Pt), который контактирует одновременно с газом и раствором, содержащим ионы этого газа. Водородный электрод состоит из платиновой пластины, покрытой мелкодисперсной платиной, контактирующей с газообразным водородом и опущенной в раствор, содержащий ионы Н+.
Pt,H2|H+
При контакте платины с газообразным водородом последний адсорбируется на пластине и, контактируя с молекулами воды, переходит в раствор в виде ионов Н+, оставляя электроны на пластине. Одновременно происходит обратный процесс восстановления ионов Н+из раствора с образованием газообразного водорода. Таким образом, на водородном электроде устанавливается равновесие:
2H+ + 2e = H2
За
ноль принят потенциал стандартного
водородного электрода, в котором
парциальное давление газообразного
водорода
![]() (101 кПа), а концентрация ионов водорода
(101 кПа), а концентрация ионов водорода![]() моль/л.
моль/л.
![]()
Для определения потенциалов электродов по водородной шкале собирают гальванический элемент, состоящий и измеряемого электрода и стандартного водородного электрода и измеряют его ЭДС.
Например, для цинкового электрода собирают цепь:
Zn|ZnSO4||H2SO4|Pt,H2
ЭДС цепи будет равна потенциалу цинкового электрода, взятого с обратным знаком.
Е
=
![]()
![]() =
-
=
-![]()
Для медного электрода собирают цепь:
Pt,H2|H2SO4||CuSO4|Cu
ЭДС цепи будет равна потенциалу медного электрода:
Е
=
![]() -
-![]() =
=![]()
