
- •Дайте определение понятий «атом», «молекула», «атомная масса», «молекулярная масса». Приведите пример.
- •2. Дайте определение понятия «молярная масса эквивалента вещества». Приведите пример.
- •3. Дайте определение понятия «количество вещества». Приведите пример.
- •Сформулируйте правило Вант-Гоффа. Запишите его математическое выражение.
- •Температурный коэффициент, его физический смысл.
- •Дайте определение понятий «валентность», «степень окисления». Ответ подтвердите примерами.
- •Стандартный электродный потенциал, его физический смысл.
- •Дайте определение понятия «коррозия металлов». Приведите пример.
- •Квантово-механическая модель атома. Квантовые числа, как характеристики состояния электрона в атоме.
- •Порядок заполнения орбиталей электронами. Принцип Паули. Правило Хунда, Клечковского.
- •Периодический закон Менделеева. Структура периодической системы д.И.Менделеева: периоды, группы, подгруппы с позиции теории строения атома.
- •Энергия ионизации, электроотрицательность, энергия сродства к электрону.
- •Ковалентная связь. Насыщаемость и направленность связи.
- •Ионная связь. Металлическая связь.
- •Δ, σ и π связи. Длина связи. Энергия связи.
- •Водородная связь. Механизм образования водородной связи.
- •Основные положения теории валентных связей. Гибридизация.
- •Влияние концентрации реагирующих веществ на скорость химической реакции. Закон действующих масс. Константа скорости химической реакции.
- •Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации, ее физический смысл.
- •Катализ. Гомогенный и гетерогенный катализ. Влияние катализатора на скорость химической реакции.
- •Химическое равновесие. Константа химического равновесия. Принцип Ле-Шателье.
- •Сильные и слабые электролиты. Факторы влияющие на степень электролитической диссоциации.
- •Ионное произведение воды. Водородный показатель среды.
- •Растворы. Способы выражения концентрации растворов.
- •Гидролиз солей. Степень и константа гидролиза.
- •Овр, основные понятия. Важнейшие окислители и воостановители.
- •Концентрационная и электрохимическая поляризация.
- •Электрохимические процессы, их классификация. Понятие об электродном потенциале. Стандартный электродный потенциал. Уравнение Нернста.
- •Газовые электроды. Уравнение Нернста для расчета потенциалов газовых электродов.
- •Гальванический элемент. Общие положения о гальвоническом элементе.Эдс гальванического элемента.
- •Напишите электронную конфигурацию атома хлора. Приведите его возможные валентные состояния.
- •Электролиз с нерастворимым и растворимым анодами(в расплаве в растворе). Практическое применение.
- •Электролиз. Законы Фарадея.
- •Химическая коррозия. Скорость химической коррозии.
- •Электрохимическая коррозия. Скорость электрохимической коррозии.
- •Коррозия под действием блуждающих токов.
- •Методы защиты металлов от коррозии. Ингибиторы коррозии.
-
Гидролиз солей. Степень и константа гидролиза.
Гидролиз солей - это реакция обменного взаимодействия соли с водой, в результате которой образуется слабая кислота или слабое основание, кислая или основная соль.
А) соль, образованная слабой кислотой и сильным основанием.
Na2CO3 + H2O = NaHCO3+NaOH
Слабая кислота сильное основание
2Na++CO32-+HOH=Na++HCO3-+Na++OH-
CO32-+HOH=HCO3-+OH-
Гидролиз протекает по аниону, так как образуется избыток OH- ионов и раствора Ph будет больше 7.
Кг=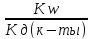
Б) соль, образованная слабым основанием и сильной кислотой.
Гидролиз протекает по катиону, так как образуется избыток H+ ионов и pH раствора будет меньше 7.
CuCl2
 Cu2+
+ 2Cl-
Cu2+
+ 2Cl-
(Cu(OH)2) (HCl)
CuCl2+HOH
 CuOHCl
+ HCl
(дописать полное и сокращенное ионное
ур-ия);
CuOHCl
+ HCl
(дописать полное и сокращенное ионное
ур-ия);
2
ст. не протекает; Кд=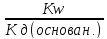
В) соль, образованная слабым основанием и слабой кислотой
В данном случае образуется слабая кислота и слабое основание, гидролиз протекает как по аниону, так и по катиону, pH>7
CH3COONH4 CH3COO-
+ NH4+
CH3COO-
+ NH4+
(CH3COOH) (NH4OH)
CH3COONH4
+ HOH
 NH4OH;
(допис.
Полную
ионную
рек-ию)
NH4OH;
(допис.
Полную
ионную
рек-ию)
Кд=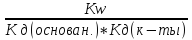
Г) соль, образованная сильной кислотой и сильным основанием.
Гидролизу не подвергается, так как в данном случае слабый электролит не образуется, pH=7
-
Овр, основные понятия. Важнейшие окислители и воостановители.
ОВР - реакции, сопровождающиеся переходом электронов от одних частиц к другим, т.е. с изменением степеней окисления атомов элементов входящих в состав реагирующих молекул. Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями. Атомы или ионы, которые в данной реакции отдают электроны являются восстановителями. Процесс отдачи электронов – окисление, а процесс присоединения электронов – восстановление. Важнейшие окислители: O2, галогены: F2, Cl2, I2, Br2; катионы металлов в максимальной степени окисления: SnCl4, FeCl3; сложные ионы и молекулы, в которых содержится элемент максимальной степени окисления: KMnO4, KNO3. Важнейшие восстановители: Ме и некоторые неМе: Zn, Al, C, N2; отрицательные ионы неМе: HCl, H2S, NH3; катионы Ме в низшей степени окисления: FeCl2, SnCl2.
-
Концентрационная и электрохимическая поляризация.
Конценртационная поляризация - изменение потенциала электрода вследствие изменения концентрации реагентов в приэлектродном слое при прохождении тока.
Электрохимическая поляризация – изменение потенциала обусловленное замедленностью собственно-электрохимических стадий реакции.
-
Электрохимические процессы, их классификация. Понятие об электродном потенциале. Стандартный электродный потенциал. Уравнение Нернста.
Электрохимические процессы - процессы взаимного превращения химической и электрической форм энергии. Делятся на: процессы превращения химической энергии в электрическую (гальванический элемент) и процессы превращения электрической энергии в химическую (электролиз). Электродный потенциал –то разность(скачок) потенциалов Ме и раствора его соли , стандартный электродный потенциал- это разность потенциалов между Ме опущенным в раствор его соли с концентрацией 1 моль/л и стандартным водородным электродом при р=101,3 кПа и Т=298К.
.
