
- •Дайте определение понятий «атом», «молекула», «атомная масса», «молекулярная масса». Приведите пример.
- •2. Дайте определение понятия «молярная масса эквивалента вещества». Приведите пример.
- •3. Дайте определение понятия «количество вещества». Приведите пример.
- •Сформулируйте правило Вант-Гоффа. Запишите его математическое выражение.
- •Температурный коэффициент, его физический смысл.
- •Дайте определение понятий «валентность», «степень окисления». Ответ подтвердите примерами.
- •Стандартный электродный потенциал, его физический смысл.
- •Дайте определение понятия «коррозия металлов». Приведите пример.
- •Квантово-механическая модель атома. Квантовые числа, как характеристики состояния электрона в атоме.
- •Порядок заполнения орбиталей электронами. Принцип Паули. Правило Хунда, Клечковского.
- •Периодический закон Менделеева. Структура периодической системы д.И.Менделеева: периоды, группы, подгруппы с позиции теории строения атома.
- •Энергия ионизации, электроотрицательность, энергия сродства к электрону.
- •Ковалентная связь. Насыщаемость и направленность связи.
- •Ионная связь. Металлическая связь.
- •Δ, σ и π связи. Длина связи. Энергия связи.
- •Водородная связь. Механизм образования водородной связи.
- •Основные положения теории валентных связей. Гибридизация.
- •Влияние концентрации реагирующих веществ на скорость химической реакции. Закон действующих масс. Константа скорости химической реакции.
- •Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации, ее физический смысл.
- •Катализ. Гомогенный и гетерогенный катализ. Влияние катализатора на скорость химической реакции.
- •Химическое равновесие. Константа химического равновесия. Принцип Ле-Шателье.
- •Сильные и слабые электролиты. Факторы влияющие на степень электролитической диссоциации.
- •Ионное произведение воды. Водородный показатель среды.
- •Растворы. Способы выражения концентрации растворов.
- •Гидролиз солей. Степень и константа гидролиза.
- •Овр, основные понятия. Важнейшие окислители и воостановители.
- •Концентрационная и электрохимическая поляризация.
- •Электрохимические процессы, их классификация. Понятие об электродном потенциале. Стандартный электродный потенциал. Уравнение Нернста.
- •Газовые электроды. Уравнение Нернста для расчета потенциалов газовых электродов.
- •Гальванический элемент. Общие положения о гальвоническом элементе.Эдс гальванического элемента.
- •Напишите электронную конфигурацию атома хлора. Приведите его возможные валентные состояния.
- •Электролиз с нерастворимым и растворимым анодами(в расплаве в растворе). Практическое применение.
- •Электролиз. Законы Фарадея.
- •Химическая коррозия. Скорость химической коррозии.
- •Электрохимическая коррозия. Скорость электрохимической коррозии.
- •Коррозия под действием блуждающих токов.
- •Методы защиты металлов от коррозии. Ингибиторы коррозии.
-
Дайте определение понятий «атом», «молекула», «атомная масса», «молекулярная масса». Приведите пример.
Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы.
Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
Атомное ядро - центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов.
Заряд ядра - положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A = Z + N.
Относительная атомная масса (Ar) - безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C.
А= =
=
Относительная молекулярная масса (Mr)-это величина равная отношению средней массы молекулы к 1 а.е.м. численно равна сумме атома масс элементов, составляющих молекулу.
Mг = mг / (1/12 mа(12C))
Mг(B2O3) = 2 • Ar(B) + 3 • Ar(O) = 2 • 11 + 3 • 16 = 70
-
2. Дайте определение понятия «молярная масса эквивалента вещества». Приведите пример.
Молярная масса показывает массу 1 моля вещества (обозначается M).
Молярная
масса эквивалента вещества масса
одного моль эквивалента вещества.(г/моль)
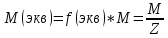
Z- основность вещества;
Для кислот = числу катионов водорода;
Для основании = числу гидроксогрупп;
Для оксидов и солей равна произведению заряда элемента на число атомов элемента;
-
3. Дайте определение понятия «количество вещества». Приведите пример.
Количество вещества - это число структурных единиц (атомов, молекул, ионов) в системе. (моль)
Молекулярная масса серы равна 32 г /моль. Определяем количество г/моль вещества в 6,4 г серы
n(s) = m(s) / M(s) = 6,4г / 32 г/моль = 0,2 моль
-
Дайте определение понятий «моль», «молярная масса». Приведите пример.
Моль – это количество вещества системы, содержащее столько структурных элементов(молекул,атомов,ионов,электронов), сколько их содержится в 0,012 кг изотопа углерода 12C. M = m / n[г/моль]
Моля́рная ма́сса вещества — масса одного моля вещества
Численно равна молекулярной массе.
MH2O = 2 MH +MO = 2·1+16 = 18 (г/моль) Молярная масса вещества равна отношению массы вещества к соответствующему количеству вещества.
-
Дайте определение понятия «молярный объем газа».
Молярный объем газа - это отношение объема вещ-ва кколичеству этого вещ-ва. Vmгаза(н.у.)=22,4 л/моль.
-
Дайте определение понятия «относительная плотность газа». Приведите пример.
Относительная плотность газов отношение масс равных объемов сухого газа и сухого воздуха при одинаковых условиях по температуре и давлению.
D=
-
Сформулируйте закон сохранения массы и энергии. Формула Эйнштейна. Приведите пример подтверждения закона.
Сумма массы вещества системы и массы, эквивалентной энергии отданной или принятой системой постоянна.
E=m – формула Эйнштейна;
– формула Эйнштейна;
NaOH
+ HCl
 NaCl
+ H2O
NaCl
+ H2O
40г 36,5г = 58,5г 18г
76,5 76,5
-
Сформулируйте закон Авогадро, запишите математическое выражение.
В равных объемах различных газов измеренных при одинаковых условиях содержится одинаковое число молекул.

1 следствие: при н.у. 1 моль любого газа содержит число молекул равное числу Авогадро;
2 следствие: при н.у. 1 моль любого газа занимает объем равный 22,4, называемый молярным объемом;
3 следствие: массы различных газов занимаемых одинаковый объем относятся между собой как их молекулярные массы;
-
Сформулируйте закон эквивалентов. Запишите его математическое выражение.
Массы реагирующих веществ относятся между собой как молярные массы их эквивалентов.
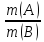 =
=
Эквивалент
-
это реальная или условная частица
вещества, которая в данной кислотно-основной
реакции эквивалентна одному протону
 ил одному электрону в данной
окислительно-восстановительной реакции.
ил одному электрону в данной
окислительно-восстановительной реакции.
-
Сформулируйте закон действующих масс для скорости химической реакции. Запишите его математическое выражение.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
aA + bB + .cC+dD
V=kCaa Cbb
-
Сформулируйте закон действующих масс для химического равновесия. Запишите его математическое выражение.
Действующих масс закон, один из основных законов физической химии; устанавливает зависимость скорости химической реакции от концентраций реагирующих веществ и соотношение между концентрациями (или активностями) продуктов реакции и исходных веществ в состоянии химического равновесия.
![]()
-
Константа скорости реакции, ее физический смысл.
Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от значения концентраций реагентов.
Физический смысл константы скорости заключается в том, что она равна скорости реакции при единичных концентрациях реагирующих веществ.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.
