
Методичк Рязановой
.pdfПрибавьте 1–2 капли фенолфталеина. Что наблюдается? Подтвердилось ли Ваше предположение? Нагрейте раствор на водяной бане. Если произошли какие-либо изменения, объясните их. Сделайте вывод.
2. Влияние разбавления на гидролиз.
К 4 каплям раствора хлорида сурьмы по каплям прибавляйте воду. Что наблюдается? Составьте уравнение гидролиза SbCl3 по первой ступени. Какая соль, основная или кислая, является промежуточным продуктом гидролиза?
Вопросы и упражнения
1.Объясните, в чем различие в свойствах атомов и ионов меди (Cu0 и Cu+2).
2.Составьте уравнение диссоциации: 1) H2SO4, 2) Ca(OH)2, 3) Al2(SO4)3, 4) H3PO4,
5)ZnOHCl, 6) FeOHCl2, 7) NaHCO3, 8) NaH2PO4, 9) H2CO3, 10) Na3PO4.
3.Дайте определения: 1) электролитической диссоциации, 2) степени гидролиза,
3)константы диссоциации.
4.Укажите среди перечисленных веществ наиболее сильное с точки зрения элек-
тролитической диссоциации основание: 1) Ni(OH)2, 2) Fe(OH)2, 3) Ni(OH)3, 4) Fe(OH)3.
5.Укажите среди перечисленных веществ наиболее сильную с точки зрения электролитической диссоциации кислоту: 1) HСlO2, 2) HBrO2, 3) HClO3, 4) HBrO3.
6.Составьте молекулярные и молекулярно-ионные (полные и сокращенные) уравнения реакций, протекающих между 1) сульфатом алюминия и хлоридом бария,
2)карбонатом натрия и хлоридом кальция.
7.Составьте молекулярные уравнения реакций, которые выражаются следующими ионными уравнениями:
1)Cu+2 + 2OH − = Cu(OH)2
2)CO 32− + 2H+ = CO2 + H2O
8.Составьте уравнение реакции гидролиза соли 1) хлорида цинка, 2) хлорида железа, 3) сульфата меди, 4) карбоната натрия, 5) фосфата натрия, 6) сульфида алюминия.
9.Рассчитайте концентрацию гидроксид-ионов в растворе, рН которого равен 5.
10.Во сколько раз надо изменить концентрацию ионов водорода, чтобы рН раствора увеличился на единицу?
11.Вычислите концентрацию гидроксид-ионов в растворе (моль/л), если рН раствора равен 9.
12.Какая соль не подвергается гидролизу: 1) NaCl, 2) Na2SO3, 3) ZnSO4?
13.Какая соль подвергается гидролизу: 1) KCl, 2) Na2SO4, 3) FeCl3?
14.Какая соль гидролизуется полностью: 1) FeCl3, 2) Na3PO4, 3) Al2S3?
15.Какая соль подвергается гидролизу в большей степени: 1) Na3PO4 или
Na3AsO4, 2) FeCl2 или FeCl3, 3) Al2(SO4)3 или Al2S3?
16. Раствор какой соли имеет рН больше 7: 1) Na2CO3, 2) Mg(NO3)2,
3)NaCl?
17.При гидролизе какой соли на первой стадии будет образовываться гидроксо-
соль: 1) FeCl3, 2) Na2CO3?
18.При гидролизе какой соли на первой стадии будет образовываться гидросоль:
1)AlCl3, 2) Na3PO4?
19.Какие факторы усиливают гидролиз соли?
20.При внесении каких солей в почву в качестве удобрений может измениться рН почвы: 1) KNO3, 2) Ca(H2PO4)2, 3) CuSO4, 4) KNO3 и Co(NO3)2, 5) KNO3 и MnSO4?
141

|
|
|
|
|
« |
|
» |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
1. |
|
|
1. |
|
|
|
|
? |
|
|
|
|
|
|
|
|
|
|
|
2. |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
2. |
|
|
- |
1. H2SO3, H2S, H2CO3 |
|||
? |
|
|
|
2. H2SO4, HCl, HNO3 |
|||
|
|
|
|
3. |
Cu(OH)2, Zn(OH)2, Al(OH)3 |
||
|
|
|
|
|
|
|
|
3. |
|
|
- |
1. NaOH, KOH, Ca(OH)2 |
|||
? |
|
|
|
2. Fe(OH)3, NH4OH, Pb(OH)2 |
|||
|
|
|
|
3. HCl, HClO4, HNO3 |
|||
|
|
|
- |
|
K2CO3, ZnCl2 |
|
|
4. |
|
|
1. |
|
|||
? |
|
|
|
2. NaCl, K2SO4 |
|
||
|
|
|
|
3. CuSO4, Na3PO4 |
|
||
|
|
|
|
|
( |
< 7) |
|
5. |
|
|
|
1. |
|||
ZnCl2? |
|
|
|
2. |
|
( |
> 7) |
|
|
|
|
3. |
|
( |
= 7) |
|
|
|
|
|
|
|
|
|
|
|
|
|
Al(OH)3 |
HCl |
|
6. |
|
|
|
1. |
|
||
AlCl3 ( |
)? |
|
|
2. AlOHCl2 |
HCl |
|
|
|
|
|
|
3. Al(OH)2Cl |
HCl |
||
|
|
|
|
|
2 |
3 |
|
7. |
|
|
|
1. |
|
||
2 3 ( |
)? |
|
|
2. |
|
3 |
|
|
|
, |
- |
|
AlCl3 |
|
|
8. |
|
1. |
|
|
|||
|
|
|
|
2. |
Al2S3 |
|
|
|
|
? |
|
3. |
Na2S |
|
|
|
|
|
|
|
|
|
|
9. |
|
Al2(SO4)3? |
|
1. |
|
|
l2(SO4)3 |
|
|
|
|
2. |
|
|
Al2(SO4)3 |
|
|
|
|
3. |
|
|
|
|
|
|
|
4. |
|
|
|
|
|
|
|
5. |
|
|
|
|
|
|
|
|
Al2(SO4)3 |
||
|
|
|
- |
|
|
|
|
10. |
|
|
1. |
|
|
|
|
|
|
NH4Cl |
- |
2. |
|
|
|
|
... |
|
|
3. |
|
|
|
|
|
|
|
|
|
|
|
|
Na2CO3 |
- |
|
|
|
|
|
11. |
|
1. |
|
|
|
||
, |
|
|
... |
2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
KNO3 |
|
|
|
|
12. |
|
|
1. |
|
|
|
|
|
... |
|
|
2. |
|
|
|
|
|
|
|
3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
CuSO4, ZnSO4, |
|
|
|
, |
|
13. |
|
1. |
|
|
|||
MnSO4, |
|
|
- |
2. |
|
, |
|
, |
|
|
? |
3. |
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
? |
|
|
|
|
14. |
|
|
1. |
|
|
|
|
|
|
|
|
2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
Ca3(PO4)2 |
|
|
15. |
|
|
1. |
|
|
||
, |
, |
|
- |
2. |
CaHPO4 |
|
|
|
|
|
|
3. Ca(H2PO4)2 |
|
||
142

3



 V A
V A 



|
|
|
V |
, |
, |
, |
. |
||
- |
|
, |
|
|
...s2p3 |
|
|
. |
|
|
|
|
|
|
|
|
: |
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
P |
|
As |
|
Sb |
|
|
Bi |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|








 VA
VA 












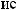


 ,
, 


 3,
3, 

 -
-






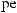









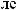
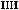

 +1
+1  +5.
+5.









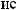



















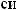


 .
.

















 ,
, 










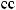









 .
. 
















 ,
, 
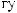






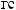



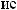

 -
-


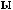







 ,
, 









 .
.



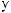

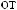












 ,
, 


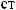











 -
-

 ,
, 




 ,
, 







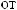
 ,
, 









 ,
, 

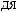













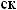


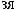
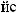

 .
. 










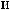

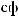






 ,
,






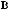










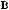


 ,
, 











 .
. 



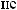


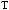
















 .
. 






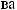




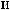

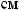










 ,
, 










 .
.








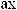























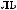
 -
-



 .
.

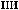























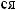


 NH3.
NH3. 
 -
-






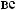
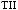
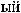







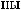




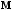 ,
, 
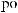






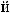


 .
.
















 .
. 







 3
3



 NH3
NH3 

 N ,
N , 





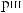











 8
8 



 .
.  -
-






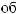



















 ,
, 







 -
-


















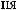
 .
.




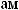

 ,
, 

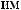
 ,
, 





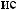









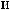




 :
:
3 |
0 |
|
2 |
2 |
2 |
4 N 3 |
5 |
2 |
4 N O 6H 2O |
||
|
3 |
|
2 |
|
|
|
|
|
|
||
N |
5 |
N |
|
4 |
|
0 |
|
|
2 |
|
5 |
O2 |
4 |
|
2 O |
|
|
|
|
143 |
|
|
|


Азотная кислота HNO3, бесцветная жидкость с плотностью, равной 1,5 г/мл, является сильной кислотой, легко диссоциирует в водном растворе.
Азотная кислота в любой концентрации, и разбавленная, и концентрированная, характеризуется окислительными свойствами. Она окисляет металлы и неметаллы, сама при этом восстанавливается в различные вещества, в зависимости от активности восстановителя и концентрации раствора – в NO2, N2, NH3. Концентрированная азотная кислота при взаимодействии с металлами восстанавливается обычно до NO2.
+5 |
0 |
+2 |
|
|
+4 |
|
4H N O3 |
+Cu = Cu(NO3 )2 |
+ |
2 N O2 |
+ 2H2 O |
||
конц. |
|
|
|
|
|
|
0 |
|
+2 |
|
1 |
|
|
|
|
|
|
|||
Cu − 2е− = Cu |
|
|
|
|||
|
+5 |
+4 |
|
2 |
|
|
|
N |
+ е− = N |
|
|
|
|
Концентрированная азотная кислота пассивирует железо Fe, алюминий Al, хром Cr:
HNO3 + Fe → Fe2O3 + NO2 + H2O
конц. пленка
Смесь концентрированной азотной кислоты и концентрированной соляной кислоты (1:3), известная под названием «царская водка», используется для растворения самых малоактивных металлов – платины Pt и золота Au:
Au + HNO3 + 3HCl = AuCl3 + NO + 2H2O
AuCl3 + HCl = H[AuCl4]
Разбавленная азотная кислота восстанавливается, в зависимости от активности металла, до различных продуктов (см. схему).
Зависимость продукта восстановления азотной кислоты от активности металла
+5
HNO3
разбавленная
мало |
|
|
|
|
|
|
|
|
металлы |
|
|
очень |
|
активные |
|
|
|
|
|
|
|
средней |
|
|
|
активные |
|
металлы |
|
|
|
|
|
|
|
|
активности |
|
|
металлы |
|
(Pb, Cu, Hg) |
|
|
|
|
|
|
|
(Mg, Zn) |
|
|
(Na, K, Ca) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+2 |
|
|
|
+ |
|
|
|
|
0 |
|
|
−3 |
−3 |
NO |
|
|
|
N2 O |
|
|
|
|
N 2 |
|
|
N H3 или N H4 NO3 |
|
|
|
|
|
или |
|
|
|
||||||
+5 |
+2 |
+5 |
+4е− |
+ |
|
|
|
+5 |
0 |
+5 |
−3 |
||
(N +3е− |
= N) |
|
(N |
= N) |
(N +5е− |
= N) |
|
(N |
+8е− = N) |
||||
Из приведенной схемы видно, что более активный металл вызывает более глубокое восстановление азотной кислоты за счет присоединения азотом большего количества электронов.
145
Однако следует иметь в виду, что иногда кинетические факторы могут тормозить образование одних продуктов и способствовать более активному образованию веществ, менее соответствующих активности данного металла. Поэтому при взаимодействии данного металла с азотной кислотой возможно образование нескольких продуктов с преимущественным образованием одного из них. Например:
+5 |
|
0 |
+2 |
|
+2 |
|
|
8H N O3 |
+3Cu = 3Cu(NO3 )2 + 2 N О+ 4H2O |
||||||
разб. |
|
|
|
|
|
|
|
|
0 |
|
+2 |
|
3 |
|
|
|
|
|
|
|
|||
|
Cu |
−2е− = Cu |
|
|
|||
|
+5 |
|
+2 |
|
2 |
|
|
|
N + 3е− |
= N |
|
|
|||
+5 |
|
0 |
+2 |
|
|
0 |
|
12H N O3 +5Mg = |
5Mg(NO3 )2 + N2 |
+6H2 O |
|||||
разб. |
|
|
|
|
|
|
|
|
0 |
|
+2 |
|
|
|
|
|
|
|
|
|
|
||
|
Mg |
− 2е− = Mg |
5 |
|
|
||
|
+5 |
+10е− |
0 |
|
1 |
|
|
|
2N |
= N2 |
|
|
|||
+5 |
|
0 |
+2 |
|
−3 |
|
|
9H N O3 |
+8 Na = 8 Na NO3 + NH3 |
+3H2 O |
|||||
разб. |
|
|
|
|
|
|
|
|
0 |
−е− = |
+ |
|
8 |
|
|
|
|
|
|
||||
|
Na |
Na |
|
|
|
||
|
+5 |
+8е− = N |
|
1 |
|
|
|
|
N |
|
|
|
|||
Азотная кислота используется как окислитель, нитрующий агент, растворитель металлов. Соли азотной кислоты (нитраты) применяются в сельском хозяйстве как удобрения (NaNO3, KNO3, Ca(NO3)2, NH4NO3).
Cоединения фосфора
Фосфор, так же как и азот, может находиться в различных степенях окисления (−3, +3, +5). Наиболее устойчивым является состояние со степенью окисления +5. Все соединения фосфора, в которых фосфор имеет любую степень окисления, кроме +5, являются восстановителями. Из этих состояний фосфор, отдавая электроны, переходит в устойчивое состояние со степенью окисления +5.
Если фосфор сгорает при недостаточном доступе кислорода, то образуется фосфористый ангидрид Р2О3, которому соответствует слабая фосфористая кислота Н3РО3 .
Оба вещества являются сильными восстановителями.
Если фосфор сгорает при достаточном количестве кислорода, то образуется фосфорный ангидрид Р2О5, которому соответствует фосфорная кислота. Она образуется при растворении в воде Р2О5 и может существовать в нескольких формах:
Р2О5 + Н2О = 2НРО3 (метафосфорная кислота)
Р2О5 + 2Н2О = Н4Р2О7 (пирофосфорная кислота)
Р2О5 + 3Н2О = 2Н3РО4 (ортофосфорная кислота)
146

Важнейшая из фосфорных кислот, ортофосфорная кислота Н3РО4, представляет собой твердое вещество (бесцветные прозрачные кристаллы, хорошо растворимые в воде).
Фосфорная кислота является кислотой средней силы, диссоциирует в три ступени:
Н3РО4 |
Н+ + Н2РО4− |
Н2РО4− |
Н+ + НРО42− |
НРО42− |
Н+ + РО34− |
В природе фосфор содержится в фосфоритах и апатитах в виде труднорастворимого фосфата кальция Са3(РО4)2, который не может быть усвоен растениями вследствие плохой растворимости. Переводя средний фосфат кальция Са3(РО4)2 в кислые соли, получают фосфорные удобрения, усваиваемые растениями, − простой суперфосфат Са(Н2РО4)2 + СаSO4, двойной суперфосфат Са(Н2РО4)2, преципитат СаНРО4.
Получение простого суперфосфата:
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
Получение двойного суперфосфата:
Ca3(PO4)2 + 4H3РO4 = Ca(H2PO4)2
Получение преципитата:
Са(ОН)2 + Н3РО4 = СаНРО4 · 2Н2О
К сложным минеральным удобрениям относятся аммофосы NH4H2PO4, (NH4)3PO4, содержащие азот и фосфор; нитрофоска (NH4)2HPO4, NH4NO3, KCl, содержащая азот, фосфор и калий – сразу три необходимых для питания растений элемента.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1. Получение аммиака
В пробирку налейте 1 см3 раствора нашатыря NH4Cl, прибавьте туда же 1 см3 раствора гидроксида натрия и нагрейте.
Определите по запаху и при помощи лакмусовой бумаги, смоченной водой и поднесенной к отверстию пробирки, природу выделяющегося газа.
Напишите уравнение происходящей реакции.
Опыт 2. Основные свойства раствора аммиака
Налейте в три пробирки по 1 см3 растворов солей сульфата алюминия, хлорида магния, хлорида железа (III). В каждую пробирку добавьте по 1 см3 раствора аммиака NH4OH, укажите цвета осадков. Составьте молекулярные и ионные уравнения реакций.
147




 3.
3.
1 |
3 |
CuSO4. |
|















 .
. 





 ?
?

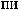










 .
.









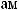








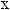










 ?
?



 4.
4. 













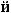



 (
(












 )
)
1. 



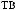























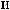 .
.
|
2 |
3 |
. |
|
|
||
? |
|
? |
- |








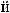

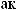

 .
.
2. 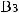


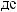



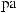









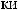








 .
. 


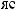

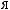









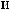

 1,
1, 







( |
(HNO ) = 2 |
/ 3). |
|
3 |
|



 5.
5. 






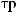









 1
1  3 0,5
3 0,5 








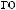




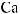 Cl2
Cl2 

 -
-
























 :
: 










 ,
,













 ,
, 













 .
.





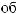
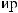



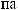



 ?
? 




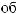













 ?
?





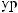




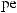


 .
. 




















 -
- 





 ,
, 











 .
.
1. 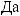

























 V
V 

 . 2.
. 2. 




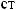




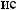






 NH3, HNO3, HNO2, Ca(NO3)2.
NH3, HNO3, HNO2, Ca(NO3)2.
3. 

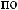









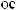
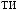







 ? 4.
? 4. 







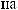
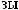







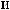 ?
? 



 ?
?
5. 








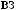






















 . 6.
. 6. 
















 .
.
7. 
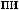














 ,
, 






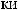


 (
(


 -
- 











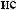

 ,
, 







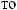
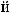




 ).
).
8. 





















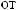
 (
(




 ).
).
9. 




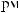









 ,
, 
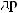







 ,
, 







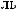

 .
. 








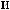

 ?
?
10. 























 ?
?
11. 










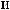











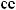










 -
-
|
? |
|
12. |
|
. |
13. |
|
? |
14. |
, |
. |
15. |
: |
|
1)HNO3 + Na  NH3 + NaNO3 + H2O
NH3 + NaNO3 + H2O

 .
.
148

2)HNO3 + Fe  Fe2O3 + NO2 + H2O
Fe2O3 + NO2 + H2O

 .
.
16. 














 ,
, 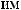
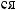




 ?
?
17. 
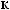
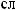








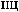








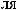





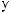






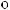 -
- 








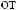




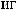




 «
«





 »?
»?
18. 






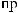









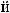





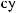




 ?
?
19. 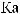






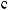










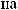





 :
:  3(
3( 4)2,
4)2,


 4,
4,  (
( 2
2 4)2?
4)2?
20. 


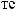







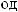


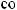



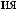



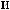



 .
.




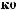





 «
«


 VA
VA 







 »
»
1. |
? |
1. |
|
|
|
2. |
|
|
|
3. |
|
|
|
|
|
|
HNO3? |
|
|
2. |
1. |
|
|
|
|
2. |
|
|
|
3. |
, |
|
|
|
|
|
|
|
|
3.



















 ? 1. NaNO3
? 1. NaNO3
2.NaNO2
4. |
? |
|
5 |
2 |
|
|
|
1. |
N |
N |
|
|
|
|
2 |
5 |
|
|
|
2. |
N |
N |
|
|
|
|
5 |
3 |
|
|
|
3. |
N |
N |
|
|
|
|
|
|
|
|
- |
|
u+HNO3 |
Cu(NO3)2+NO+H2O |
|
5. |
1. |
||||
|
2. |
u+HNO3 |
Cu(NO3)2+NO2+H2O |
||
|
? |
|
|
|
|
|
|
|
|
|
|
|
- |
|
NH3 |
|
|
6. |
1. |
|
|
||
|
? |
2. |
PH3 |
|
|
|
|
3. AsH3 |
|
|
|
|
- |
|
|
|
|
7. |
1. |
|
|
|
|
|
? |
2. |
|
|
|
|
|
3. |
|
|
|
|
|
|
|
|
|
|
- |
|
HNO3 + S |
|
|
8. |
1. |
|
|||
|
? |
|
. |
|
|
|
|
2. |
HNO3 + Au |
|
|
|
|
|
. |
|
|
|
|
3. |
HNO3 + Fe |
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
- |
|
NH4Cl |
|
|
9. |
1. |
|
|||
|
? |
2. |
NH4NO3 |
|
|
|
|
3. |
Na3AsO4 |
|
|
|
? |
|
|
|
|
10. |
1. |
|
|
|
|
|
|
2. |
|
|
|
|
|
3. |
|
|
|
|
|
|
|
|
|
149
Работа 4 Титриметрический анализ. Метод кислотно-основного титрования.
Сущность титриметрического анализа
Титриметрический анализ – это метод количественного анализа, заключающийся в нахождении массы определяемого компонента с помощью установления концентрации его раствора.
Титриметрический анализ основан на законе эквивалентов.
Втитриметрическом анализе применяется метод измерения объема раствора реагента (титранта) известной концентрации, затраченного на реакцию с определенным объемом раствора исследуемого вещества.
Чтобы установить концентрацию раствора определяемого компонента, нужно провести титрование.
Титрование – это процесс постепенного приливания раствора титранта к раствору анализируемого вещества до момента окончания реакции между ними.
Момент, при котором количество титранта эквивалентно количеству определяемого компонента, называют точкой эквивалентности.
Точка эквивалентности – это теоретическое понятие. На практике фиксируют не точку эквивалентности, а конечную точку титрования. Это значит, что момент окончания реакции фиксируется не точно, а с допустимой погрешностью.
Для определения конечной точки титрования используют индикаторный и инструментальный методы.
Виндикаторном методе конечную точку титрования устанавливают с помощью индикатора.
Индикаторы – это вещества, которые изменяют окраску вблизи точки эквивалентности.
Винструментальном методе применяют приборы – иономеры, рН-метры.
Требования, предъявляемые к реакциям, применяемым в титриметрическом анализе
Реакция должна протекать в нужном направлении и быть практически необратимой. Реакция должна протекать с достаточной скоростью.
Должна существовать возможность для фиксирования момента окончания реакции.
Стандартные растворы
Стандартным, или титрированным, раствором (титрантом) называется раствор с известной концентрацией.
По способу приготовления стандартные растворы делят на первичные (приготовленные) и вторичные (стандартизированные, или установленные).
1. Первичный стандартный раствор готовят растворением точной навески вещества в мерной колбе определенного объема.
Стандартное вещество должно: быть химически чистым;
иметь состав, строго соответствующий определенной формуле; быть устойчивым при хранении, как в твердом виде, так и в растворе (например,
щавелевая кислота Н2С2О4·2Н2О, тетраборат натрия (бура) Na2B4O7·10H2O).
150




































 -
-










 .
.




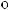




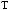









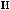 ,
, 






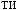






 -
- 








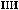
 NH
NH

 -
-


























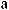




 :
:











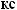



 NH
NH





 ,
, 


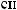


 -
-





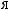












 .
.


















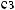









 :
:

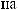





 :
:





 :
: 2
2 3
3 4
4 5
5