
Методичк Рязановой
.pdf
Решение
1.Комплексообразователь – Zn2+. Степень окисления его равна +2, поэтому координационное число равно 4.
2.Выберем в качестве лигандов молекулы NH3.
3.Составим комплексный ион (внутреннюю координационную сферу комплексного соединения), определим его степень окисления:
[Zn+2(NH3) 04 ]2+
4. Определим состав внешней сферы, напишем формулу комплексного соединения, проверим электронейтральность молекулы.
[Zn(NH3 )4 ]2+ SO24−
внутренняя |
внешняя |
сфера |
сфера |
5.Составим уравнения процесса диссоциации:
1) [Zn(NH3)4]SO4  [Zn(NH3)4]2+ + SO24− 2) [Zn(NH3)4]2+
[Zn(NH3)4]2+ + SO24− 2) [Zn(NH3)4]2+ 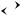 Zn2+ + 4NH3
Zn2+ + 4NH3
6.Составим выражение для константы диссоциации:
К= [Zn2+ ] [NH3 ]4
н[Zn(NH3 )4 ]2+
7.Напишем уравнение обменной реакции с участием комплексного соединения, например:
[Zn(NH3)4]SO4 + BaCl2 = [Zn(NH3)4]Cl2 + BaSO4↓.
131

ЛАБОРАТОРНЫЕ ЗАНЯТИЯ
Нужно знать: правила поведения в химической лаборатории, меры предосторожности, правила обращения с реактивами, ведение лабораторной тетради.
Нужно уметь: проводить химические эксперименты, описывать наблюдения, делать выводы, применять теоретические знания к решению вопросов профессиональной направленности и экологии.
Методические указания к лабораторным занятиям
Лабораторные работы приносят пользу студенту лишь при условии сознательного, а не механического их выполнения. Поэтому работать в лаборатории следует только после основательной подготовки, когда ясны цель работы и план ее выполнения.
Опыты должны выполняться в соответствии с указаниями преподавателя и с их описанием в руководстве.
Нельзя проводить никаких опытов, не предусмотренных планом. Все работы выполняются студентом индивидуально. Необходимые для работы реактивы находятся на лабораторных столах. Концентрированные кислоты и вещества с резким запахом хранятся в вытяжных шкафах.
Обращение с реактивами
Реактивы общего пользования нельзя уносить на свои рабочие места. Сухие реактивы необходимо брать чистым шпателем или специальной ложечкой.
Сухое вещество следует брать в количестве, закрывающем дно пробирки, объем раствора должен составлять примерно 1 мл.
Реактив, оставшийся неиспользованным, нельзя выливать обратно в склянку, из которой он был взят.
Все работы с концентрированными растворами и резко пахнущими веществами надо проводить в вытяжном шкафу.
Рабочее место студент должен держать в чистоте и порядке. На рабочем столе должны находиться только предметы, нужные в данное время для работы.
По окончании занятия студент должен привести рабочее место в порядок. Дежурные организуют порядок во время работы, контролируют чистоту рабочих мест и сдают лабораторию лаборанту.
Лабораторная тетрадь
Все наблюдения и выводы заносятся в лабораторную тетрадь, которая является документом, отражающим работу студента. На обложке тетради должны быть написаны название практикума, фамилия студента, его инициалы, номер группы.
Результаты наблюдений записываются в лабораторную тетрадь сразу же после проведения опыта. Записи должны быть аккуратными, краткими и четкими. Рекомендуется следующая схема записи:
1.Дата.
2.Наименование темы.
132
3.Название опыта.
4.Наблюдения (образование осадка, образование газа, выделение или поглощение теплоты, изменение цвета осадка или раствора).
5.Уравнения реакций, таблицы и графики.
6.Расчеты.
7.Выводы.
По окончании лабораторной работы студент должен представить преподавателю тетрадь для проверки и подписи.
Необходимо отчитаться за проведенную работу.
Меры предосторожности при работе в лаборатории
Работая в лаборатории, студент должен соблюдать следующие правила предосторожности:
1.Все опыты с резко пахнущими веществами и концентрированными кислотами следует проводить в вытяжном шкафу.
2.Опыты с легковоспламеняющимися веществами проводить вдали от огня.
3.При работе внимательно следить, чтобы реактивы, особенно кислоты и щелочи, не попадали на лицо, руки и одежду.
4.Наливая раствор, держать пробирку и склянку на некотором расстоянии во избежание попадания жидкости на одежду и обувь.
5.При нагревании жидкости держать пробирку отверстием от себя и от людей, находящихся рядом.
6.Не приближать лицо к сосуду, в котором нагревается жидкость, так как при кипении жидкости может произойти ее разбрызгивание.
7.Не следует вдыхать выделяющиеся газы, близко наклоняясь к сосуду с ними. Необходимо легким движением руки направить струю воздуха от отверстия сосуда к себе и осторожно вдохнуть.
8.При разбавлении концентрированных кислот следует вливать кислоту в воду, а не наоборот.
Оказание первой помощи в лаборатории
1.При попадании на кожу концентрированных кислот следует немедленно промывать сильной струей воды обожженное место в течение 3–5 минут, после чего наложить повязку из ваты, смоченной 3 % раствором перманганата калия.
2.При ожоге кожи растворами щелочей промывать водой обожженный участок кожи до тех пор, пока она не перестанет быть скользкой на ощупь, после чего наложить повязку из ваты, смоченной 3 % раствором перманганата калия.
3.При попадании брызг кислоты или щелочи в глаза немедленно промыть поврежденный глаз большим количеством воды комнатной температуры, после чего сейчас же обратиться к врачу.
4.При ожоге кожи горячими предметами (стекло, металлы и т.д.) наложить сначала повязку из спиртового раствора таннина или раствора перманганата калия, а затем жирную повязку (мазь от ожогов).
5.При ожогах фосфором необходимо наложить на обожженное место повязку, смоченную 2 % раствором сернокислой меди.
6.При отравлении хлором, бромом, сероводородом, окисью углерода немедленно вывести пострадавшего на воздух.
133
Работа 1 Проявление периодического закона в кислотно-основных свойствах
неорганических соединений
Из периодического закона следует, что свойства сложных соединений зависят от свойств элементов, из которых они образовались.
Умение видеть это, предвидеть свойства сложных соединений, исходя из свойств образующих их элементов, видеть общее и особенное в свойствах однотипных соединений имеет большое значение для правильного понимания химических процессов.
Проверьте свое умение предвидеть свойства данного химического соединения, сравнивать свойства веществ данного класса, отличающихся каким-либо качеством, применять периодический закон и периодическую систему для решения учебных задач.
Опыт 1. Испытание растворов щелочей и кислот индикаторами
Экспериментально установите, какую окраску имеют индикаторы: лакмус, метилоранж и фенолфталеин – в кислой, щелочной и нейтральной среде. Для этого примените кислоты различной природы (растворы НCl и Н2SO4) и щелочи различной приро-
ды (растворы NaOH и KOH).
Исходя из наблюдений, сделайте вывод о том, влияет ли природа кислоты или щелочи на окраску индикатора. Для этого:
1.Налейте в две пробирки растворы хлороводородной (соляной) кислоты HCl и серной кислоты и прибавьте 2 капли раствора лакмуса. Что наблюдается?
2.Повторите опыт, прибавив 2 капли раствора метилоранжа.
3.Повторите опыт, прибавив 2 капли раствора фенолфталеина.
4.Налейте в две пробирки растворы гидроксида натрия NaOH и гидроксида калия КОН. Прибавьте 2 капли раствора лакмуса. Что наблюдается?
5.Повторите опыт, прибавив 2 капли раствора метилоранжа.
6.Повторите опыт, прибавив 2 капли раствора фенолфталеина. Что наблюдается?
7.Налейте в 3 пробирки по 1 мл дистиллированной воды и прибавьте в каждую по 2 капли: а) лакмуса; б) метилоранжа; в) фенолфталеина. Что наблюдается?
Результаты наблюдений изменения окраски индикаторов в нейтральной, кислой и щелочной среде сведите в таблицу:
Индикаторы |
Окраска раствора в зависимости от реакции среды |
|||
|
|
|
||
кислая |
щелочная |
нейтральная |
||
|
||||
|
|
|
|
|
Лакмус |
|
|
|
|
|
|
|
|
|
Метилоранж |
|
|
|
|
Фенолфталеин |
|
|
|
|
Обобщите Ваши наблюдения.
Влияет ли природа кислоты или щелочи на окраску индикатора?
Опыт 2. Получение оснований
Знаете ли Вы:
Для получения какого основания, сильного или слабого, можно применить реакцию оксида с водой?
134

|
, |
, |
|
|
? |
|
|
1. |
|
( |
)2 |
|
|
|
. |
( |
, |
). |
|
|
2 3 |
. |
? |
|
. |
. |
|
|
|
|
? |
2. 
















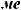
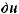 Cu(OH)2
Cu(OH)2















 Cu(OH)2
Cu(OH)2 





 ,
, 


 (
( )2.
)2. 














 CuO
CuO 



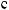





 2
2 3
3 




 -
-


 .
. 





 ?
? 






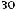


 Cu(OH)2?
Cu(OH)2?








 1
1 
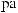


 CuSO4
CuSO4 











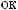




 NaOH.
NaOH. 






 ?
? 








 ?
?












 .
.








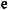 :
:


















 CuSO4, MnSO4, FeSO4
CuSO4, MnSO4, FeSO4 


 -
-





 ?
?







 ,
, 













 .
.



 3.
3.







 Mg(OH)2
Mg(OH)2  Zn(OH)2.
Zn(OH)2. 


 :
:










 ,
, 







































 NH4OH.
NH4OH.












 Mg(OH)2
Mg(OH)2  Zn(OH)2
Zn(OH)2 

















 .
. 






 ?
? 









 Mg(OH)2
Mg(OH)2  Zn(OH)2?
Zn(OH)2?





















 .
.








 :
:
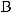



























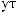





 -
-















 ?
? 
 ?
? 













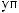











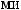 ?
?



 4.
4.











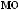

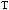



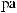





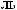




 ,
, 





 .
.



















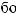




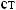




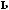


 ?
? 
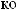











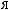



 ?
?
Ca3(PO4)2


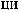
 Ca(H2PO4)2.
Ca(H2PO4)2.








 1
1 
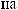
















 Ca(OH)2
Ca(OH)2 

 -
-


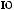























 .
. 












 ,
, 













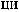
 .
. 

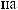




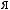 ?
? 





 -
-






 .
.


 :
:








 ,
, 



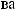








 ?
?






 ,
, 



















 .
.
135
Опыт 5. Взаимодействие кислот с металлами
Испытайте отношение разбавленной соляной кислоты к цинку и меди. Испытайте отношение разбавленной и концентрированной азотной кислоты к ме-
ди. Что наблюдается? Составьте уравнения соответствующих реакций.
В чем общность и в чем различие соляной и азотной кислот по отношению к металлам?
Опыт 6. Свойства солей
Имеется набор следующих реактивов: NaCl, HCl, AgNO3, FeCl3, CuSO4, BaCl2, NaOH, Fe, H2SO4, Na2SO4.
Осуществите несколько реакций, отражающих свойства солей, являющихся необратимыми и сопровождающихся внешними эффектами.
Опыт 7. Осуществление заданных химических превращений
Как осуществить превращения:
Cu → Cu(NO3)2 → Cu(OH)2 → CuCl2 → Cu?
Проведите необходимые реакции.
Вопросы и упражнения
1.Рассмотрите генетическую схему классов неорганических соединений на основе закона единства и борьбы противоположностей.
2.Каким образом наличие различных классов неорганических соединений подтверждает развитие неорганической природы?
3.Применяя метод аналогии, составьте формулы: а) селеновой кислоты; б) мышьяковой кислоты; в) хромовой кислоты.
4.Перечислите правила составления и проверки формул сложных химических соединений. Приведите примеры.
5.Свойства основных оксидов.
6.Свойства кислотных оксидов.
7.Свойства оснований (сильных, слабых, амфотерных).
8.Свойства кислот.
9.Свойства солей.
10.Напишите формулы: 1) оксида алюминия, 2) карбоната алюминия, 3) гидроксида радия, 4) оксида натрия, 5) фосфата кальция, 6) хлорида алюминия, 7) оксида калия, 8) оксида кальция, 9) фосфата натрия, 10) сульфата натрия, 11) хлорида натрия,
12)сульфита натрия, 13) сульфида калия, 14) оксида хрома (VI), 15) сульфата железа (III), 16) гидрофосфата натрия, 17) дигидрофосфата кальция, 18) гидрофосфата кальция,
19)гидроксохлорида алюминия, 20) дигидроксохлорида алюминия, 21) гидроксосульфата алюминия.
11.Особенности взаимодействия металлов с кислотами.
12.На основании периодического закона сравните: 1) гидроксид магния и гидроксид бериллия, 2) гидроксид кальция и гидроксид бария, 3) угольную и кремниевую кислоту, 4) серную и сернистую кислоту.
13.Закончите уравнения реакций:
Pb(OH)2 |
+ NaOH |
врастворе |
→ |
||
Pb(OH)2 |
+ NaOH |
врасплаве |
→ |
136

Cu  HNO3
HNO3 

 .
.
Zn  H 2SO 4
H 2SO 4 

 .
.
14.











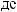




 : Fe2O3 + H2O
: Fe2O3 + H2O  ?
?
CaO + H2O  ? Ag + HCl
? Ag + HCl  ?
?
Zn(OH)2 + NaOH  ? Na2O + H2O
? Na2O + H2O  ? ZnO + H2O
? ZnO + H2O  ? Al(OH)3 + NaOH
? Al(OH)3 + NaOH  ? Ca(OH)2 + H3PO4
? Ca(OH)2 + H3PO4  ?
?
15.




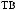







 : Cu
: Cu  Cu(OH)2
Cu(OH)2  CuCl2
CuCl2  Cu?
Cu?
Zn  ZnSO4
ZnSO4  Na2ZnO2
Na2ZnO2  ZnCl2
ZnCl2  Zn? Cu
Zn? Cu  CuO
CuO  Cu(OH)2
Cu(OH)2  CuO
CuO  Cu? Zn
Cu? Zn  Zn(OH)2
Zn(OH)2  ZnOHCl?
ZnOHCl?
CuSO4  Cu(OH)2
Cu(OH)2  CuO
CuO  Cu(NO3)2
Cu(NO3)2  Cu?
Cu?
«












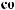



 »
»
1. |
|
- |
1. Ca3(PO4)2 |
|
|
|
? |
|
2. |
Ca(H2PO4)2 |
|
|
|
|
3. |
FeCl3 |
|
|
|
|
4. |
Fe(OH)3 |
|
|
|
- |
|
, |
- |
2. |
|
1. |
|||
|
MnSO4 |
- |
|
|
|
|
NH4OH? |
|
2. |
, |
|
|
|
|
|
|
|
|
|
- |
|
|
|
3. |
|
|
|
|
|
|
Ca(H2PO4)2 |
? |
|
|
|
|
K2SiO3 |
- |
|
, |
- |
4. |
1. |
||||
|
CaHPO4? |
2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
1. HCl |
|
|
5. |
|
|
|||
|
? |
|
2. H2SO4 |
|
|
|
|
|
3. HNO3 |
|
|
|
|
|
4. HNO2 |
|
|
|
|
- |
1. NaOH |
|
|
6. |
|
|
|||
|
? |
|
2. Ca(OH)2 |
|
|
|
|
|
3. Fe(OH)3 |
|
|
|
|
|
4. Mn(OH)2 |
|
|
|
|
- |
1. CaSO4 |
|
|
7. |
|
|
|||
|
? |
|
2. CaCO3 |
|
|
|
|
|
3. |
Ca3(PO4)2 |
|
|
|
137 |
|
|
|

Работа 2 Растворы электролитов
Большинство химических реакций проходит в водных растворах. В этих условиях химические вещества подвергаются превращениям, от которых зависят их свойства. Важнейшими процессами, идущими под действием воды, являются электролитическая диссоциация на ионы кислот, оснований и солей и гидролиз солей.
Электролитическая диссоциация веществ и гидролиз солей идут в почве, от них зависят растворимость соединений, кислотность почвы, возможность усвоения растениями питательных элементов. Глубокое понимание этих процессов способствует возможности обеспечения благоприятных для растений условий существования.
Опыт 1. Сравнение химической активности (силы) растворов кислот
Вдве пробирки налейте по 3 см3 (примерно ¼ часть пробирки) растворов HCl и CH3COOH (Cэкв.кислоты = 2 моль/л).
Вкаждую пробирку опустите по одинаковому кусочку цинка.
Вкакой пробирке идет более энергичное выделение водорода? Напишите уравнения происходящих реакций. Сделайте вывод о зависимости химической активности кислоты от степени ее диссоциации.
Опыт 2. Реакции в растворах электролитов
Налейте в пробирку 1 см3 раствора CuSO4 или FeSO4. Прибавьте раствор NaOH. Что наблюдается?
Составьте уравнения реакций в молекулярной, полной ионной и сокращенной ионной форме.
А теперь подумайте:
Какое отношение к сельскому хозяйству имеют эти реакции? Эффективно ли применение микроудобрений на щелочных почвах?
Опыт 3. Установите, эффективно ли применение суперфосфата на щелочных почвах
Налейте в пробирку 1 см3 раствора дигидрофосфата кальция (суперфосфата) Ca(H2PO4)2. Прибавьте насыщенный раствор Ca(OH)2. Что наблюдается?
Составьте уравнения реакций в молекулярной, полной ионной и сокращенной ионной форме.
Сделайте вывод, разрешающий поставленную в опыте проблему.
Опыт 4. Определение характера среды растворов солей микроэлементов
Для внекорневой подкормки древесных растений используются растворы солей различных металлов. Определите характер среды и рН применяемых растворов с помощью универсального индикатора, если для подкормки березы используется сульфат цинка, а для подкормки сосны – сульфат меди. Составьте уравнения гидролиза.
Опыт 5. Определение характера среды растворов солей макроэлементов
С помощью универсального индикатора установите характер среды раствора нитрата аммония NH4NO3. Составьте уравнения гидролиза.
139
Объясните, почему при систематическом применении этого макроудобрения необходимо проводить известкование почвы в качестве химической мелиорации.
Опыт 6. Определение характера среды раствора соды Na2CO3 (карбоната натрия)
С помощью универсального индикатора установите характер среды раствора карбоната натрия Na2CO3.
Какая среда характерна для почв содового засоления?
Почему для химической мелиорации таких почв применяется гипсование?
Опыт 7. Управление процессом диссоциации
Можно ли управлять процессом диссоциации? Например, если электролит является слабым и диссоциация его идет частично, можно ли ее уменьшить, изменяя условия? Выскажите Вашу точку зрения. А теперь проверьте ее экспериментально.
Проведите следующий опыт.
Вдве пробирки налейте по 1 см3 раствора гидроксида аммония NH4OH и добавьте
вкаждую по капле фенолфталеина. В одну из пробирок добавьте немного сухого хло-
рида аммония NH4Cl, раствор перемешайте. Сравните окраску растворов в обеих пробирках.
О каком процессе – усилении диссоциации или уменьшении диссоциации – говорит изменение окраски раствора?
Объясните причину изменения окраски раствора на основании 1) принципа ЛеШателье, 2) свойств константы диссоциации.
Опыт 8. Необратимый гидролиз
Большинство солей гидролизуется лишь в некоторой степени, и гидролиз их до конца не проходит. Образуются промежуточные продукты гидролиза (кислые соли или основные соли).
Однако гидролиз некоторых солей идет до конца, с образованием основания или кислоты в качестве конечных продуктов гидролиза. Какой состав должна иметь соль, чтобы ее гидролиз проходил до конца? Можно ли приготовить раствор такой соли? Есть ли среди имеющихся в лаборатории реактивов раствор такой соли? Объясните, почему для наблюдения гидролиза такого типа предлагаются следующие реакции:
1.К 2 см3 раствора нитрата свинца прибавьте равный объем раствора карбоната
натрия Na2CO3 (соды). Объясните наблюдения. Составьте уравнения соответствующих реакций (реакции обмена и реакции гидролиза).
2.К 2 см3 раствора сульфата алюминия прилейте равный объем раствора карбоната натрия. Объясните наблюдения. Составьте уравнения соответствующих реакций (реакции обмена и реакции гидролиза).
Можно ли было для наблюдения за реакцией гидролиза, идущей до конца, обойтись без реакции обмена, взяв раствор соответствующей соли?
Опыт 9. Факторы, усиливающие гидролиз солей
1. Влияние температуры на гидролиз.
В пробирку налейте 1 см3 (примерно) раствора ацетата натрия. Предположите сначала теоретически, какая среда будет возникать за счет гидролиза этой соли.
140

 ?
?