
Методичк Рязановой
.pdf



 37
37
1. |
. |
|
, |
. |
|
AlCl3 = Al3+ + 3Cl |
|
Na3PO4 = 3Na+ + PO 34 |
|
||
2. 








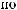






 -
-

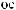




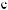






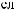
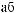

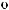
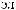




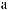 .
.
Al3+ + HOH |
AlOH2+ + H+ |
PO 34 + HOH HPO 42 + OH |









 (
(












 )
) 

















 (
(

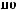










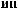



 )
)
|
|
|
|
: |
|
3 |
)2+ |
|
|
3 )2 |
|
|
|
|
|||
( Al |
|
( H |
|
||
|
|
|
|
4 |
|
3. |
, |
|
|
|
. |
|
+. |
|
|
|
- |
. |
|
|
|
|
|
Al3+ + HOH |
AlOH2+ + H+ |
|
PO 34 |
+ HOH |
HPO 42 + OH |
|
|||||
|
< 7 |
|
|
|
> 7 |
|
|
|
|
4. 



















 ,
, 







 ,
, 
















 .
.
|
- |
|
- |
|
|
- |
|
- |
|
|
|
|
|
|
AlCl3 + |
= AlOHCl2 + HCl |
|
Na3PO4 + HOH = Na2HPO4 + NaOH |
|
111

Таблица 38
ГИДРОЛИЗ СОЛЕЙ С ОБРАЗОВАНИЕМ КОНЕЧНЫХ ПРОДУКТОВ ГИДРОЛИЗА
Конечными продуктами гидролиза соли являются основание и кислота
Они образуются, если
соль образована катионом слабого основания и анионом слабой кислоты и продукты гидролиза уходят из сферы реакции
1) Al2S3 = 2Al3+ + 3S2−
слаб. слаб.
2)2Al3 + 3S2– + 6H2O = 2Al(OH)3 + 3H2S
3)Al2S3 + 6H2O = 2Al(OH)3 ↓ + 3H2S↑
Таблица 39
ЗНАЧЕНИЕ ГИДРОЛИЗА ДЛЯ ПОЧВЫ
Систематическое внесение в почву |
|
Накопление в почве |
||
минеральных удобрений |
|
ионов Al3+ |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Гидролиз |
|
|
|
|
|
|
|
|
NH 4+ + HOH |
NH4OH + H+ |
Al3+ + HOH |
AlOH2+ + H+ |
||
Zn2+ + HOH |
ZnOH+ + H+ |
|
|
|
|
Накопление ионов Н+, подкисление почвы
Необходимо известкование (химическая мелиорация)
112

|
|
|
. |
|
|
|
|
|
|
10 4 |
|
|
, |
|
|
|
- |
|
|
/ . |
|
|
|
|
|
|
|
||
|
|
|
+ |
|
|
- |
|
|
/ . |
|
|
|
+ |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
+ ( |
/ ), |
= lg [H+]. |
|
|
|
|
|
||
pOH |
|
|
|
|
|
|
, |
||
= |
lg[ |
]. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
- |
|
|
|
|
25 : |
|
|
|
|
|
|
|
|
|
[H+] [ |
] = 10 14 |
|
|
(1) |
||
|
|
|
( |
|
|
), |
: |
|
|
|
|
|
lg[H+] + lg[ |
] = 14 |
|
|
(2) |
||
|
|
|
: |
|
|
|
|
|
|
|
|
|
+ |
|
= 14 |
|
|
(3) |
|
|
|
|
: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H+ |
|
|
|
|
|
|
|
|
|
10 |
7 |
|
7 |
|
|
|
|
|
|
> 10 7 |
|
|
||
|
|
|
|
|
|
< 7 |
|
||
|
|
|
|
|
< 10 7 |
|
|
||
|
|
|
|
|
|
> 7 |
|
||



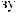







 :
:
[ ] = 10 4; |
= lg[ ] = 4; pH + pH = 14; |
pH = 14 |
pOH = 14 4 = 10. |
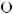


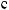
 :
:  = 10,
= 10, 





 .
.



















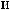 ,
, 


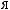

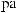








 -
- 



 -
-





 :
:
Fe3+ + 3
 = Fe(OH)3
= Fe(OH)3
113
Решение
Присутствие в растворе ионов Fe3+ и ОН– свидетельствует о реакции между хорошо растворимыми, хорошо диссоциирующими веществами (сильными электролитами), содержащими указанные ионы. Такими веществами могут быть хлорид железа (III) FeCl3 и гидроксид натрия NaOH:
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
Гидролиз солей
Задача
Изменится ли рН почвы при внесении в нее нитрата аммония NH4NO3? Решение
Проанализируем процессы, проходящие в почве при внесении NH4NO3:
1. В водной среде NH4NO3, являясь хорошо растворимой солью, сильным электролитом, диссоциирует:
NH4NO3  NH+4 + NO 3−
NH+4 + NO 3−
слаб.
2. Нитрат аммония образован катионами слабого основания и анионами сильной кислоты, поэтому эта соль подвергается гидролизу (по катиону)
NH 4+ + HOH |
NH4OH + Н+ , |
|
кислая |
|
среда |
то есть NH4NO3 – гидролитически кислое удобрение.
3.Катион аммония усваивается растениями, включается в состав белков.
4.Анион NO 3− содержит азот, являющийся питательным элементом, и тоже ус-
ваивается растениями, хотя подвергается превращениям в растительном организме, восстанавливаясь до аммиака.
5.Так как и катион, и анион соли усваиваются растениями, изменение рН почвы
при внесении в нее NH4NO3 не происходит при условии полного усвоения удобрения растениями.
6.Если в почве содержится избыток NH4NO3, она становится более кислой.
Раздел 6. Окислительно-восстановительные реакции
Нужно знать: современную теорию окислительно-восстановительных процессов; важнейшие окислители и восстановители; алгоритм составления уравнений окислительно-восстанови- тельных реакций; роль окислительно-восстановительных реакций в природе и технике.
Нужно уметь: составлять электронные и электронно-ионные уравнения окислительновосстановительных процессов; составлять уравнения окислительно-восстановительных реакций; объяснять процессы усвоения нитратов растениями.
Окислительно-восстановительные реакции имеют очень широкое распространение и являются чрезвычайно важными для обмена веществ в живых организмах, для многих промышленных процессов, связанных с получением химических веществ.
Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления.
Окислительно-восстановительная реакция – это реакция, идущая с изменением степениокисления элементов засчетперехода(смещения) электроновотоднихатомовкдругим.
114
Степень окисления
Состояние атома в молекуле характеризуется с помощью понятия «степень окисления».
Степенью окисления называется условный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит только из ионов.
Вычисление степени окисления производится на основании того, что молекула любого вещества в целом электронейтральна, то есть алгебраическая сумма степеней окисления всех атомов в молекуле равна нулю (см. табл. 40).
Процессы окисления и восстановления
Понятие «восстановление» в химии имеет смысл «присоединение». Оно является специфическим для химической формы движения материи и связано с присоединением электронов.
Процесс окисления является противоположным ему процессом, следовательно, в этом понятии содержится противоположный понятию восстановления смысл.
Восстановление – это процесс присоединения электронов. Окисление – это процесс отдачи электронов.
Восстановителем является частица (атом, ион, молекула), отдающая электроны в процессе химической реакции. Эти электроны идут на восстановление других частиц.
Окислителем является частица, присоединяющая электроны. Эти электроны окислитель отнимает у других частиц. (Таким образом, окислитель играет роль захватчика электронов, разрушителя других частиц.)
Оба процесса, восстановление и окисление, протекают всегда одновременно. Они противоположны друг другу. Окислительно-восстановительные реакции являются отражением на уровне химической формы движения материи действующего в природе закона единства и борьбы противоположностей.
Важнейшие восстановители и окислители
Свойства восстановителей и окислителей определяются электронным строением их атомов, которое обеспечивает им возможность отдавать или принимать электроны.
К важнейшим восстановителям относятся следующие вещества: металлы (осо-
0 |
−2 |
, галогеноводороды и соли галогеново- |
бенно активные), водород Н2 , сероводород Н2 S |
||
дородных кислот (HI− и КI−; HBr− и KBr− и т.д.), соединения четырехвалентной серы
+2 +2
(SO2, H2SO3, Na2SO3), соли двухвалентного железа ( FeSO4 ), оксид углерода CО, соли
+2
двухвалентного олова (Sn Cl 2) и т.д.
Сильнейшим восстановителем является электрический ток (катод при электролизе).
|
|
|
|
|
|
0 |
0 |
|
|
Важнейшими окислителями являются следующие вещества: галогены ( F2 , |
Cl2 |
, |
|||||
0 |
0 |
0 |
|
|
+6 |
|
|
|
Br2 , |
I2 ), кислород |
O |
2 , концентрированная серная кислота Н2 S О4, азотная кислота |
|||||
любой концентрации |
+5 |
+7 |
|
+6 |
|
|
||
НNO3 , перманганат калия КMnО4 , дихромат калия |
К2 Cr O7 |
, |
||||||
|
+5 |
|
|
+ |
+ |
|
|
|
хлорат калия КClO3 , хлорноватистая кислота и ее соли (НCl O, КClO ) и др. |
|
|
|
|||||
|
|
|
|
115 |
|
|
|
|

Электронные уравнения
Изменение степени окисления частиц, имеющее место в окислительно-восста- новительных реакциях, можно отразить с помощью электронных уравнений (см.
табл. 41).
Изменение степени окисления элементов в процессе окислительно-восстановительных реакций
При окислительно-восстановительных процессах происходит изменение зарядов частиц за счет изменения их электронной структуры.
При восстановлении частицы степень окисления частицы понижается (за счет присоединения отрицательных электронов).
При окислении степень окисления ее повышается (за счет отдачи электронов).
Составление уравнений окислительно-восстановительных реакций (ОВР)
Большинство окислительно-восстановительных реакций являются сложными. Продукты реакций часто коренным образом отличаются от реагирующих веществ.
Схема реакции содержит исходные вещества и продукты их взаимодействия (без коэффициентов).
Чтобы написать формулы продуктов, нужно хорошо знать свойства исходных веществ и возможности их превращения. Если это неизвестно, то формулы продуктов устанавливаются опытным путем.
Чтобы перейти от схемы реакции к уравнению реакции, нужно найти коэффици-
енты.
Алгоритм составления уравнений ОВР методом электронного баланса
1.Составить схему реакции (написать формулы исходных веществ и формулы продуктов реакции, зная свойства реагирующих веществ).
2.Определить, какие элементы изменили степень окисления, и обозначить их в исходных веществах и в продуктах реакции.
3.Составить электронные уравнения, отражающие процессы окисления восстановителя и восстановления окислителя (учитывая, что увеличение степени окисления происходит при отдаче электронов, а уменьшение степени окисления происходит при присоединении электронов).
4.Найти коэффициенты для восстановителя, окислителя и продуктов их превращения на основании правила электронного баланса, по которому количество электронов, отданных восстановителем, должно быть равно количеству электронов, принятых окислителем.
5.Поставить найденные коэффициенты в левую и правую части уравнения реакции перед соответствующими веществами.
С помощью перечисленных выше операций будет уравновешен окислительновосстановительный процесс.
Теперь следует уравнять обменный процесс.
117

6.По металлу, не изменившему степень окисления.
7.По неметаллу кислотного остатка.
8.По водороду.
9.Проверить правильность уравнивания по кислороду. Если уравнение составлено правильно, то количество атомов кислорода в левой и правой частях уравнения одинаково.
Пример
1) Cu + HNO3 → Cu(NO3)2 + NO + H2O
0 |
+5 |
+5 |
+2 |
||
2) Сu |
+ H N O3 |
→ Cu(NO3 )2 + NO + Н2О |
|||
0 |
−2е− |
|
+2 |
|
|
|
|
|
|
|
|
3) Cu →C u |
|
|
|||
+5 |
+3е− |
+2 |
|
|
|
|
|
|
|
|
|
N → N |
|
|
|||
0 |
−2е− |
|
+2 |
|
3 |
|
|
||||
|
|
|
|
||
4) Cu →Cu |
|
||||
+5 |
+3е |
− |
+2 |
|
2 |
|
|
|
|||
N → N |
|
||||
или |
|
|
+2 |
|
|
0 |
−6е− |
|
|
|
|
|
|
|
|
|
|
3Cu →3C u |
|
|
|||
+5 +6е−→ +2
2N 2N
(правило электронного баланса выполнено)
5)3Cu + 2HNO3 → 3Cu(NO3)2 + 2NO + H2O
6)В данном примере не надо.
7)3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + H2O
8)3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
9)Количество атомов кислорода в левой и правой частях уравнения одинаково и равно 24.
Электронно-ионный метод составления уравнений окислительно-восстановительных реакций
При составлении уравнений методом электронного баланса допускаются неточности, связанные с использованием частиц, изменяющих степени окисления, которые реально в растворах не существуют. Например, в растворе азотной кислоты имеются
+5
ионы NO 3− , но нет N .
Поэтому более точно соответствует реально существующим в растворе частицам электронно-ионный метод составления уравнений окислительно-восстановительных реакций (метод полуреакций). При составлении электронно-ионных уравнений должен выполняться закон сохранения зарядов.
Сумма всех зарядов в левой части электронно-ионного уравнения должна быть равна сумме всех зарядов в правой части уравнения.
119

Электронно-ионный метод является более точным, но и более сложным. При составлении электронно-ионных уравнений (полуреакций) следует учитывать силу электролита, участие или образование ионов Н+, ОН−, молекул воды.
Электронно-ионные уравнения для рассмотренной выше реакции
0
Cu + HNO3 → Cu(NO3)2 + NO + H2O
будут такими:
0 |
+2 |
|
|
|
|
Cu – 2е– = Cu |
|
3 |
|||
|
|||||
|
0 |
|
|
|
|
NO 3− + 4H+ + 3е– = |
NO |
+ 2H2O |
|
2 |
|
|
|
|
|
|
|
Второе электронное уравнение получено так: 1. Известно, что произошло превращение:
0
NO 3− → NO
2. Следовательно, в процессе участвуют катионы Н+, которые отнимают кислород от NO 3− . Так как количество кислорода в продукте уменьшилось на два атома, в процессе участвуют 4Н+. Они образуют 2Н2О:
0 0
NO 3− + 4H+ → NO + 2Н2 O
3. Суммы зарядов в левой и правой частях уравнения должны быть одинаковы. В данном случае в левой части уравнения мы имеем: −1 + 4 = +3, а в правой 0. Следовательно, в левой части электронного уравнения идет присоединение 3е–.
Окончательно получаем:
0 0
NO 3− + 4H+ + 3е– = NO + 2Н2 O
сумма зарядов
−1 + 4 – 3 = 0
Умножаем коэффициенты для уравнивания числа отданных и принятых электронов на равенства полуреакций и суммируем их:
3Сu0 + 2NO 3− + 8H+ = 3Cu2+ + 2NO + 4H2O
Чтобы перейти от ионного уравнения к молекулярному, делаем следующее: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион в необходимом для образования молекулы (с учетом коэффициентов) количестве, а к каждому катиону – анион.
Записываем те же ионы и в таком же количестве в правую часть уравнения, после чего объединяем ионы в молекулы:
3Сu0 + 2NO 3− + 8H+ = 3Cu2+ + 2NO + 4Н2О 6NO 3− = 6NO 3−
3Сu + 8HNO 3− = 3Cu(NO3)2 + 2NO + 4H2O
120
