
гидролиз солей
.pdfна рН буферного раствора. Наблюдается ли изменение рН буферного раствора при разбавлении в n1 раз и в n2 раз?
Таблица 3.4 Экспериментальные данные исследования свойств буферного
раствора в связи с разбавлением
исходногобуферного раствора |
|
Объем, |
|
рН по универсальному |
|||||
|
|
мл |
|
||||||
|
|
|
|
индикатору |
|
||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
буфер- |
|
|
|
|
|
После разбавления в n |
|||
|
|
|
|
|
раз |
|
|||
ного |
|
воды |
|
воды |
|
|
|||
|
|
до раз- |
|
|
|
||||
первое |
|
второе |
|||||||
рас- |
|
(V1) |
|
(V2) |
|
||||
|
|
бавления |
разбавле- |
|
разбавле- |
||||
твора |
|
|
|
|
|
||||
рН |
|
|
|
|
|
|
ние |
|
ние |
|
|
|
|
|
|
в n1 раз |
|
в n2 раз |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Контрольные вопросы и задачи
1.Что называется буферным раствором? Для каких целей готовят буферные растворы в лаборатории?
2.Приведите примеры наличия и функционирования буферных систем в природе.
3.Объясните принцип действия ацетатного и аммиачного буферных рас-
творов.
4.В каком интервале рН наблюдается действие буферного раствора?
5.Как изменяется рН буферного раствора при разбавлении?
6.Объясните механизм поддержания постоянства рН при добавлении в приготовленный вами буферный раствор: а) кислоты; б) щелочи.
7.Что называется буферной емкостью? От каких факторов она зависит? При каком значении рН буферная емкость раствора максимальна?
8. |
Буферная система содержит 0,1 моль/л муравьиной кислоты и |
0,1 моль/л формиата калия. Определить рН. |
|
9. |
Как изменится рН буферного раствора, содержащего 0,1 М нитрата ам- |
мония и 0,01 М гидроксида аммония, если его разбавить в 4 раза?
41
10.Определить рН буферного раствора, содержащего 1,1 моль/л NН4ОН и
1,1 моль/л NН4Сl.
11.Определить рН и рОН раствора, если к 1 л воды прибавить 11,5 г муравьиной кислоты и 10,5 г формиата калия.
12.Смешали 20 мл 0,2 М раствора ацетата натрия с 20 мл 0,3 н. раствора уксусной кислоты. Определить рН раствора.
13.100 мл 23 н. раствора муравьиной кислоты смешали с 30 мл 15 н. раствора формиата натрия. Определить рН раствора.
14.Рассчитать рН раствора, содержащего в 0,5 л 30 г уксусной кислоты и 41 г ацетата натрия.
15.Вычислить концентрацию Н+, ОН– и рН раствора, полученного при смешивании 50 мл 0,2 М раствора уксусной кислоты и 3 мл 0,1 М раствора ацетата натрия.
16.Рассчитать концентрацию ионов водорода и рН раствора, который получился при сливании 10 мл 0,1 М раствора карбоната натрия Nа2СО3 и 8 мл 0,1
Мраствора гидрокарбоната натрия NаНСО3.
17. |
K 25 мл |
0,2 |
M раствора гидрофосфата натрия добавили 15 мл |
||
0,2 M раствора дигидрофосфата натрия. Полученную смесь разбавили до 50 мл. |
|||||
Вычислите рН полученного раствора. |
|
||||
18. |
К 100 мл |
0,1 |
M |
раствора |
фтороводородной кислоты прибавлено |
5 г фторида натрия. Вычислите рН полученного раствора. |
|||||
19. |
Смешали |
21 |
мл |
раствора |
0,1 М раствора бензоната натрия |
и 9 мл 0,1 М раствора бензойной кислоты. Вычислить рН, если константа ионизации равна 6,3·10–5.
20. Сколько миллилитров 0,5 М раствора хлорида аммония следует прибавить к 100 мл 0,5 н. раствора гидроксида аммония, чтобы получить буферную систему с рН = 9,25?
21. Каково соотношение концентраций СН3СООН и СН3СООNа
вацетатном буферном растворе, если его рН = 4,74?
22.Сколько граммов формиата калия следует взять, чтобы при растворении в 25 мл 0,03 М раствора муравьиной кислоты получить смесь с рН = 4,0.
23. |
Сколько граммов формиата натрия следует добавить |
к 100 мл |
0,2 М |
раствора муравьиной кислоты, чтобы получить |
буферный |
раствор с рН = 3,32? |
|
|
24. |
Сколько мл 0,5 M раствора нитрата аммония надо |
добавить |
к 10 мл 0,12 M раствора аммиака, чтобы получить раствор с рН = 9,2?
42

Лабораторная работа № 4. ГИДРОЛИЗ СОЛЕЙ
Цель работы. Установить взаимосвязь между составом соли и ее способностью подвергаться гидролизу. Научиться составлять молекулярные и ионные уравнения реакций гидролиза солей. С помощью индикаторов экспериментально определить характер среды в растворах солей. Сопоставить результаты эксперимента с теоретическими данными.
Гидролиз – разложение веществ водой. Гидролизом соли называется обменное взаимодействие ионов соли с молекулами воды, в результате, которого изменяется характер среды (соотношение между ионами водо-
рода и гидроксила в растворе).
Реакция гидролиза – это реакция обратная реакции нейтрализации.
гидролиз
СОЛЬ + H2O  кислота + основание
кислота + основание
нейтрализация
NH4Cl + H2O NH4OH + HCl
NH4+ + H2O NH4OH + H+.
Гидролиз соли происходит лишь в тех случаях, если ионы соли с ионами Н+ или ОН– молекул воды образуют новые слабые электролиты. Процесс гидролиза – это обратный процесс диссоциации слабого электролита. Возможность и характер протекания реакции гидролиза определяется природой кислоты и основания, которые образовали данную соль.
Гидролизу подвергаются соли, образованные:
–сильным основанием и слабой кислотой;
–слабым основанием и сильной кислотой;
–слабым основанием и слабой кислотой.
Гидролизу не подвергаются соли, образованные сильным основанием и сильной кислотой.
Гидролиз протекает обратимо, ступенчато, продукты гидролиза солей, как правило, определяются первой ступенью.
Рассмотрим возможные случаи гидролиза солей.
43
1. Гидролиз солей, образованных сильным основанием и слабой кислотой (КСN, NaClO, Na2CO3, K3PO4 и т. д.).
А) Гидролиз соли, образованной слабой одноосновной кислотой:
NaClO + H2O НClO + NaОН
Na+ + ClOˉ + H2O Na+ + ОНˉ + НClO или
ClOˉ + H2O НClO + ОНˉ (

 ).
).
В обеих частях уравнения имеются малодиссоциированные вещества (H2O, НClO), но вода является более слабым электролитом, чем хлорноватистая кислота, поэтому равновесие реакции смещено в сторону обратной реакции. Из уравнения видно, что в результате гидролиза в растворе увеличивается концентрация ионов ОНˉ, т. е. реакция среды щелочная (рН > 7).
Б) Гидролиз соли, образованной слабой многоосновной кислотой:
Na3РО4 + H2O Na2HРO4 + NaОН.
Гидролиз протекает за счет взаимодействия ионов РО43– с молекулами H2O. Запишем сокращенное ионное уравнение реакции гидролиза, помня, что гидролиз протекает обратимо (при этом равновесие смещено в сторону обратной реакции) и ступенчато (к исходному иону присоединяется только один ион водорода):
РО43– + H2O HРO42– + ОНˉ (рН > 7).
По полученному ионному уравнению дописываем молекулярное уравнение реакции гидролиза.
Таким образом, в результате гидролиза соли, образованной сильным основанием и слабой многоосновной кислотой, образуется кислая соль и основание. В растворе соли среда – щелочная, так в растворе появляется избыток ионов ОН–.
2. Гидролиз солей, образованных слабыми основаниями и силь-
ными кислотами (NH4Cl, ZnSO4, FeCl3, Al2(SO4)3 и др.).
Рассмотрим гидролиз сульфата цинка, соли образованной слабым афотерным основанием и сильной кислотой:
2ZnSO4 + 2H2O (ZnOH)2SO4 + H2SO4.
44
Гидролиз этой соли протекает по катиону, запишем сокрашенное ионное уравнение гидролиза, помня, что гидролиз протекает обратимо (равновесие смещено в сторону обратной реакции) и ступенчато (к исходному иону присоединяется только один гидроксильный ион):
Zn2+ + H2O ZnOH + + H+ (pH < 7).
Врастворе появляется избыток ионов водорода, следовательно, в растворе соли среда – кислая (рН < 7).
По полученному ионному уравнению записываем молекулярное уравнение и расставляем коэффициенты.
При гидролизе соли, образованной слабым многокислотным основанием и сильной кислотой, образуется основная соль и кислота.
Вхолодных и умеренно концентрированных растворах солей гидролиз протекает по первой ступени. При повышении температуры и разбавлении растворов гидролиз усиливается, равновесие смещается в сторону прямой реакции, и тогда могут протекать и вторые ступени гидролиза.
3. Гидролиз солей, образованных слабым основанием и слабой кислотой.
Соли, образованные катионом слабого основания и анионом слабой кислоты, гидролизуются одновременно и по катиону, и по аниону с образованием слабого основания и слабой кислоты. Характер среды в таких растворах будет зависеть от свойств образующихся слабых электролитов, т. е. среда может быть слабокислой, слабощелочной или даже нейтральной.
NH4CN + H2O NH4OH + HCN
NH4+ + CN– + H2O NH4OH + HCN.
Для того чтобы определить характер среды, необходимо сопоставить константы диссоциации слабой кислоты (Кд = 7,9·10-10) и слабого основания (Кд = 1,76· 10-5). Из сравнения констант диссоциации кислоты и основания [Кд(NH4ОН) > Кд(HCN)] следует, что раствор цианида аммония должен иметь слабощелочную среду.
(NH4)2CО3 + H2O NH4OH + NH4HCО3
NH4+ + CО32– + H2O NH4OH + HCО3ˉ.
45
Особый случай гидролиза солей, образованных слабым многокислотным основанием и слабой многоосновной кислотой (Al2S3, Cr2S3, Fe2(CO3)2, Al2(CO3)2 и др.), когда разложение солей под действием воды происходит полностью.
Al2S3 + 6 H2O → 2 Al(OH)3↓ + 3 H2S↑.
В присутствии воды гидролиз идет и по катиону, и по аниону.
Al3+ + H2O AlOH2+ + H+
 H2O S2– + H2O HS– + ОН–
H2O S2– + H2O HS– + ОН–
Из образовавшихся ионов H+ и ОН– образуется вода – слабый электролит, концентрация ионов уменьшается, и равновесие смещается в сторону прямой реакции, т. е. гидролиз усиливается, идут вторые ступени гидролиза:
AlOH2+ |
+ H2O Al(OH)2+ + H+ |
|
|
H2O |
|||
– |
– |
||
HS |
+ H2O H2S + ОН |
|
|
|
В итоге равновесие реакции полностью смещается в сторону прямой реакции, и гидролиз идет до конца. В итоге образуется слабое и малорастворимое основание, которое выпадает в осадок. Кроме того, образуется второй слабый электролит, который является летучей кислотой. Поэтому соли такого типа не могут существовать в водном растворе. В таблице растворимости таких солей стоит прочерк.
При сливании растворов сульфата алюминия и сульфида натрия тоже образуется осадок и выделяется газ с неприятным запахом:
Аl2(SO4)3 + 3 Na2S + 6 H2O → 2 Al(OH)3 ↓ + 3 H2S↑ + 3 Na2SO4 Al 3+ + H2O AlOH2+ + H+  H2O
H2O
S2– + H2O HS– + ОН–
При сливании водных растворов хлорида железа и карбоната натрия реакция гидролиза протекает до конца с образованием коричневого осадка Fe(OH)3 и с выделением газа CO2:
2 FeCl3 + 3 Na2CO3 + 3 H2O → 2 Fe(OH)3↓ + 3 CO2 ↑ + 6 NaCl
Fe 3+ + H2O FeOH2+ |
+ H+ |
|
|
H2O |
|||
CО32- + H2O HCO3- |
+ ОН– |
||
|
46
Эти соли взаимно усиливают гидролиз друг друга. Поскольку гидроксид алюминия амфотерное соединение, то для его получения чаще используют раствор соды, а не щелочь.
Степень гидролиза и константа гидролиза
Количественными характеристиками процесса гидролиза являются степень гидролиза и константа гидролиза.
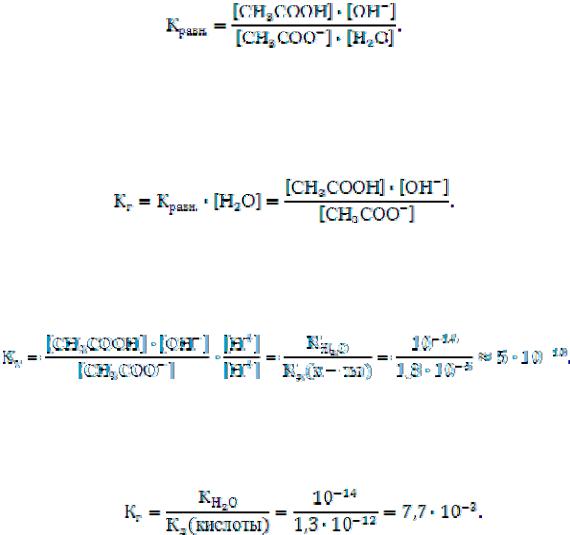
Любое химическое равновесие можно охарактеризовать величиной константы равновесия. Для реакции гидролиза ацетата натрия
CH3COONa + H2O CH3COOH + NaОН
CH3COO– + H2O CH3COOH + ОН–
константа равновесия имеет вид:
В этом выражении концентрация воды преобладает в системе и остается величиной постоянной [H2O] = const. Перемножив две постоянные, получают тоже постоянную величину (Кг):
Кравн.· [H2O] = const = Кг
Преобразуем выражение константы гидролиза в вид удобный для расчетов, умножив числитель и знаменатель на одну и ту же величину
[H+], или заменим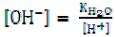 , получим:
, получим:
Подобным образом находим константу гидролиза для соли, образованной слабой многоосновной кислотой. Например, для соли К3РО4 константа гидролиза будет рассчитываться по формуле
Для соли, образованной слабым основанием и сильной кислотой, константа гидролиза будет равна:
47

Для соли, образованной слабым основанием и слабой кислотой, константа гидролиза будет равна:
Из выражений констант гидролиза следует, что чем слабее кислота или основание, образовавшее данную соль, тем больше константа гидролиза, тем в большей степени соль подвергается гидролизу.
Степень гидролиза (αг или β) – отношение числа молекул соли, подвергшихся гидролизу, к общему числу молекул.
Степень гидролиза соли можно вычислить, зная константу гидролиза соли:
Концентрацию ионов H+ или ОНˉ, образующихся при гидролизе соли, вычисляют используя константу гидролиза или степень гидролиза:
или 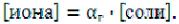
Пример 1. Вычислите рН и степень гидролиза соли в растворе карбоната натрия с молярной концентрацией 0,1 моль/л.
Решение. Запишем уравнение реакции гидролиза карбоната натрия. Na2СО3 + H2O NaHСO3 + NaОН
CО32– + H2O HCO3ˉ + ОНˉ.
При гидролизе образуется избыток ионов ОНˉ, следовательно, в растворе соли среда – щелочная. Вычислим концентрацию гидроксильных ионов, предварительно вычислив константу гидролиза:
Вычисление рН и степени гидролиза можно выполнить двумя способами.
48
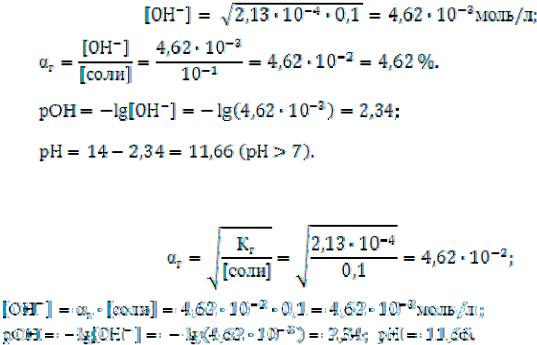
А) Вычислим сначала концентрацию гидроксильных ионов, а затем степень гидролиза и рН.
Б) Вычислим сначала степень гидролиза, а затем концентрацию гидроксильных ионов и рН.
Техника безопасности
1.Перед выполнением работы следует ознакомиться с методикой проведения эксперимента, понять цель исследования.
2.К работе приступать только после разрешения преподавателя.
3.Помните о токсичности многих солей (особенно солей «тяжелых» металлов – меди, цинка, кадмия, ртути, свинца, олова). Работайте аккуратно. При попадании на руки растворов солей и в конце работы тщательно вымойте руки.
4.Пролитые реактивы необходимо сразу же удалить влажной тряпкой, не допуская их контакта с незащищенной кожей рук.
5.Опыты, в которых выделяются ядовитые газы, проводите в вытяжном шкафу при включенной вентиляции.
6.Правильно проводите нагревание пробирок с растворами, направляя открытую часть пробирки внутрь вытяжного шкафа. Равномерно нагревайте содержимое пробирки.
7.Растворы солей и индикаторов используйте в количествах, указанных в описании эксперимента. Не используйте растворы, в названиях которых не уверены.
49
Экспериментальная часть
Реактивы. Соли (растворы или кристаллы): NaCl, NaNO3, Na2SO4, Na2CO3, Na2SiO3, Na2В4O7, NaHСO3, CH3COONa, Na2S, Na3PO4, KCl,
KNO3, K2SO4, NH4Cl, NH4NO3, NH4CH3COO, ZnSO4, Аl2(SO4)3, Cr2(SO4)3, AlCl3, FeCl3, ВаCl2, СаCl2, MgCl2.
Растворы индикаторов: фенолфталеин, метиловый оранжевый, лакмус, индикаторная бумага.
Оборудование. Посуда: штатив с пробирками, пробиркодержатель, спиртовка.
Получите у преподавателя вариант задания для проведения эксперимента (варианты заданий смотрите в таблице 4.1).
Таблица 4.1
Варианты индивидуальных заданий
№ |
Формула соли для опыта |
|
Номера опытов |
||||
вари- |
|
||||||
|
|
|
|
|
|
|
|
анта |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
|
|
|
|
|
|
1 |
CH3COONa |
Аl2(SO4)3 |
(NH4)2CО3 |
NaNO3 |
5а |
6е |
7б |
2 |
NaHСO3 |
FeCl3 |
NH4CH3COO |
КС1 |
5б |
6г |
7а |
3 |
Na2CO3, |
Cr2(SO4)3 |
(NH4)2CО3 |
КI |
5в |
6а |
7в |
4 |
Na2SiO3, |
ZnSO4 |
NH4CH3COO |
NaC1 |
5г |
6д |
7а |
5 |
Na2S |
NH4Cl |
(NH4)2CО3 |
Na2SO4 |
5а |
6б |
7б |
6 |
NaNO2 |
NH4NO3 |
NH4CH3COO |
K2SO4 |
5б |
6в |
7в |
7 |
Na2В4O7, |
Аl2(SO4)3 |
(NH4)2CО3 |
KNO3 |
5в |
6а |
7б |
8 |
Na3PO4 |
FeCl3 |
NH4CH3COO |
CaCl2 |
5г |
6б |
7в |
9 |
CH3COONa |
Cr2(SO4)3 |
(NH4)2CО3 |
BaCl2 |
5а |
6в |
7а |
10 |
Na2SiO3 |
NH4С1 |
NH4CH3COO |
Ca(NO3)2 |
5б |
6е |
7б |
11 |
Na2S |
ZnSO4 |
(NH4)2CО3 |
KNO3 |
5в |
6г |
7в |
12 |
Na2CO3 |
NH4NO3 |
NH4CH3COO |
Na2SO4 |
5г |
6д |
7а |
13 |
NаНCO3 |
CuSO4 |
NH4CH3COO |
NaNO3 |
5б |
6е |
7б |
14 |
Na2SiO3 |
FeCl3 |
(NH4)2CО3 |
K2SO4 |
5в |
6д |
7в |
50
