
- •Адсорбция
- •Экстракция
- •Виды связи влаги с материалом
- •Кинетика сушки
- •Основное и дополнительное сырье
- •В качестве пищевых добавок используют:
- •Технология мучных кондитерских изделий
- •Технология сахарных кондитерских изделий
- •Химические и физико-химические изменения сахаров в процессе приготовления и хранения сиропов
- •Технология шоколада
- •Технологическая схема производства шоколада состоит из стадий:
- •Получение шоколадной массы
- •3. Формование шоколадных масс.
- •4. Хранение. Хранят шоколад в сухих, чистых, хорошо вентилируемых помещениях при температуре 180с.
- •Технология сахара
- •Хранение сахарной свеклы
- •Измельчение свеклы в стружку
- •Получение диффузионного сока
- •Известково-углекислотная очистка диффузионного сока
- •Предварительная дефекация
- •2Ступень сатурации
- •Получение тростникового сахара-сырца
- •Получение биоэтанола на сахарном заводе
температуры он увеличивается, а с увеличением давления – уменьшается. Коэффициенты молекулярной диффузии измеряются опытным путем, и для большинства веществ эти данные приводятся в справочниках.
АБСОРБЦИЯ
Абсорбция - процесс поглощения газов или паров жидкостью.
Это – процесс обратимый, т.е. в определенных условиях, например при нагревании, можно выделить газ из жидкости. Такой процесс называют ДЕСОРБЦИЕЙ. Процесс насыщения минеральной воды и других напитков диоксидом углерода, в специальных технологиях называют сатурацией и карбонизацией, в действительности это – абсорбция.
ЗАКОН ГЕНРИ. РАВНОВЕСИЕ ПРИ АБСОРБЦИИ
Количество газов, которое может поглотить жидкость, зависит от свойств газа и жидкости, температуры и парциального давления поглощаемого газа в газовой смеси над поверхностью жидкости. Рассмотрим разделение бинарной смеси, состоящей из компонентов А и В. Пусть жидкость поглощает компонент А. Определим число степеней свободы для этой системы, используя правило фаз:
С= К- Ф + 2,
для нашего примера Ф=2, т.к. в процессе участвуют две фазы – газ и жидкость. Число компонентов К=3: газовые компоненты А и В и третий компонент – поглощающая жидкость. Тогда число степеней свободы
С= 3 +2 -2 = 3.
Здесь три степени свободы – это три переменных параметра: температура, давление и концентрация. Изменение любого из них нарушает установившееся равновесие. В состоянии равновесия при постоянных температуре и общем давлении, концентрации компонента А в газовой смеси соответствует определенная концентрация этого компонента в жидкости. Это - закон ГЕНРИ, записывается уравнением
рА = ExA,
где Е - коэффициент пропорциональности - константа Генри,
xА - концентрация компонента А в жидкости, молярные доли.
Величина константы Генри зависит от свойств газа и жидкости, от их температуры и не зависит от общего давления. Для идеальных растворов на диаграмме р-х зависимость равновесных концентраций от давления изображается прямой линией, проходящей через начало координат с угловым коэффициентом, равным Е. При неизменном общем давлении и концентрации компонента, но с повышением температуры константа Е увеличивается, что ведет к растворимости газа в жидкости. Закон Генри широко используется в быту. При подогреве воды вначале выделяются пузырьки газа на стенках посуды. Подобно этому явлению из свежей водопроводной воды, налитой в стакан, интенсивно выделяются газы. Это связано с резким уменьшением давления в воде.
Адсорбция
Адсорбция – процесс поглощения одного или нескольких компонентов из смеси газов, паров или жидких растворов поверхностью твердого вещества. Процесс избирателен, т.е. из смеси поглощаются только определенные компоненты. Поглощенное вещество может быть выделено из адсорбента, например, при нагревании. Это - процесс регенерации-обновления – ДЕСОРБЦИЯ.
В пищевой промышленности адсорбция применяется при очистке водно-спиртовых смесей в ликероводочном производстве, при очистке и стабилизации вин, соков и других напитков, в свеклосахарном производстве адсорбция используется для очистки диффузионного сока в процессе его сатурации и для обесцвечивания сахарных сиропов перед кристаллизацией.
Уравнение Фрейндлиха и Лангмюра. Равновесие при адсорбции
Количество вещества, поглощаемое твердым адсорбентом, зависит от концентрации поглощаемого вещества в парогазовой смеси или растворе, а также от температуры, при которой осуществляется процесс. Условия равновесия для адсорбции
х*=f(y,T),
где х*- относительная (по отношению к 1 кг адсорбента) концентрация поглощаемого вещества в адсорбенте, равновесная с относительной концентрацией этого вещества в газовой или жидкой фазе Y,кг/кг.
Для изотермических процессов это уравнение принимает вид уравнения Фрейндлиха:
х*= Сy1/n
где С и n – константы для данных веществ, зависящие от температуры.
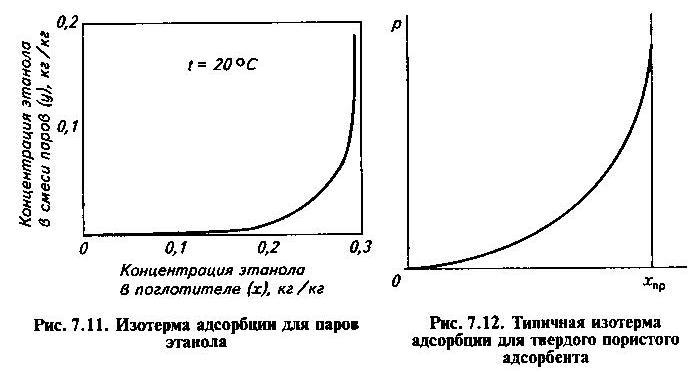
Линии равновесия, соответствующие уравнению, называются изотермами адсорбции, их строят по опытным данным.
Скорость процесса адсорбции зависит от свойств адсорбента, температуры, давления, свойств поглощаемых веществ и состава фазы, из которой они поглощаются.
Концентрацию поглощаемого из газа (или пара) вещества можно заменить его парциальным давлением
x*=C1p1/n,
где n,С 1- константы, зависящие от температуры.
По уравнению, используя опытные данные, строят кривые, характеризующие свойства адсорбента, так называемые изотермы адсорбции. Вначале при небольшом давлении наблюдается прямая пропорциональность между p и х*, а в конце кривая асимптотически приближается к предельному содержанию вещества в твердой фазе, что соответствует состоянию насыщения. Отметим, что уравнения Фрейндлиха дают большую погрешность при малых значениях х* и при х*, близких к насыщению. Для более точного описания процесса адсорбции пользуются уравнением Лангмюра
![]()
где b- коэффициент, зависящий от свойств адсорбента и поглощаемого вещества, имеет размерность давления.
Графики
Адсорбенты
Количество поглощаемого вещества зависит от площади поверхности поглотителя. Поэтому адсорбенты обладают чрезвычайно развитой поверхностью, что достигается за счет образования большого количества пор в твердом теле.
АКТИВНЫЙ УГОЛЬ. Его получают сухой перегонкой дерева с последующей активацией – прокаливанием при температуре около 900ºС. Поверхность 1г угля занимает 600-1700 м2. Его получают также из костей животных и других углеродсодержащих материалов. Размеры частиц угля лежат в пределах 1-5 мм.
Недостаток - небольшая механическая прочность и горючесть.
СИЛИКАГЕЛИ. Адсорбент получают обезвоживанием геля кремниевой кислоты, обрабатывая силикат натрия
(жидкое стекло) минеральными кислотами или кислыми растворами их солей. Размер гранул силикагеля 0,2-7мм. Поверхность 1 г силикагеля 400-700м2. Силикагели эффективно поглощают пары органических веществ, влагу из воздуха и газов. Используют при упаковке и хранении приборов и материалов, впитывающих влагу. Силикагель негорюч и обладает большой механической прочностью.
ЦЕОЛИТЫ. Это - пористые водные алюмосиликаты катионов элементов 1 и 2 группы периодической системы Д.И. Менделеева. Цеолиты чаще применяют синтетические с однородной структурой и размерами пор, которые можно сравнить с размерами крупных молекул. Гранулы промышленных цеолитов имеют размеры 2-5 мм. Цеолиты используют для глубокой очистки газов и воздуха с незначительным содержанием влаги.
ИОНИТЫ. Это - природные и искусственные адсорбенты, действие которых основано на ХИМИЧЕСКОМ взаимодействии с очищаемыми растворами. Это-процесс ХЕМОСОРБЦИИ - адсорбции, сопровождаемой химическими реакциями. Иониты, содержащие кислые активные группы и обменивающиеся подвижными катионами, называются АНИОНИТАМИ. Иониты, содержащие основные активные группы и обменивающиеся подвижными катионами, называются КАТИОНИТАМИ. Наибольшее распространение получили ионообменные смолы. Они применяются в сахарорафинадном производстве для обесцвечивания сиропов. Смолы применяют для очистки воды, спирта-ректификата из спирта-сырца. В пищевой промышленности в качестве естественных адсорбентов, например, для осветления вин, используют мелкодисперсные глины - бентонит и каолин. С этой целью применяют рыбий клей (желатин) и другие вещества.
