
Ф изика термодинамика бля лекции и вопросы / OF3_3_Teployomkost_Teplovye_mashiny_mini
.pdfТеплоёмкость при постоянном объёме
В учебнике – опечатка!
Рассмотрим процесс передачи некоторого количества теплоты одному молю идеального одноатомного газа в условиях, когда его объём постоянен (V = const, dV = 0):
δQ = dU + δW = dU + pdV = dU
Следовательно, всё передаваемое газу количество теплоты Q идёт на
приращение его внутренней энергии: |
|
δQ |
|
1 |
|
dU |
||
C = |
= |
|
||||||
|
|
|
|
|
||||
V |
|
|
ν dT |
|||||
|
|
νΔT V |
|
|||||
Так как внутренняя энергия одного моля идеального одноатомного газа равна его полной (термодинамической) энергии
. |
U = |
3 |
RT |
C = |
3 |
R = 12, 5 Дж×моль−1 × К−1 |
|
|
|||||
|
2 |
|
V |
2 |
|
|
|
|
|
|
|||
Теплоёмкость CV идеального одноатомного газа не зависит от температуры и является величиной постоянной.
© А.В. Бармасов, 2006-2013 |
11 |
12+ |
|
Закон Джоуля
Внутренняя энергия идеального газа зависит только от температуры и не зависит от его плотности (объёма):
|
∂U |
= 0 |
|
|
|
|
∂V |
|
|
T |
|
© А.В. Бармасов, 2006-2013 |
12 |
12+ |
|
Физический смысл универсальной газовой постоянной
Универсальная газовая постоянная R численно равна работе (расширения), которую совершает один моль идеального газа при его нагревании на 1 К при постоянном давлении.
Таким образом, для одного моля идеального одноатомного газа выполняется соотношение:
C |
|
= C + R = |
3 |
R + R = 2, 5R » 20, 78 Дж× К−1 ×моль−1 |
p |
|
|||
|
V |
2 |
|
|
|
|
|
|
© А.В. Бармасов, 2006-2013 |
13 |
12+ |
|
Физический смысл универсальной газовой постоянной
Молярная теплоёмкость идеального одноатомного газа, давление которого не изменяется в процессе расширения, является величиной постоянной.
Из полученного соотношения следует формула
(уравнение) Майера:
C p −CV = R
Для идеального газа молярная теплоёмкость при постоянном давлении превышает молярную теплоёмкость при постоянном объёме на величину R, т. е. на 8,31451 Дж·К–1 ·моль–1 . У жидких и твёрдых тел разница между молярными теплоёмкостями Cp и CV сравнительно мала.
© А.В. Бармасов, 2006-2013 |
14 |
12+ |
|
Difference in heat capacities (Разность теплоёмкостей)
Cp − CV |
= ∂U |
+ p ∂V |
||||
|
|
|
|
|
|
|
|
∂V |
|
T |
∂T |
|
p |
|
|
|
||||
© А.В. Бармасов, 2006-2013 |
15 |
12+ |
|
Энтальпия
(Enthalpy)
При описании процессов, протекающих при постоянном давлении, удобно пользоваться понятием энтальпия H термодинамической системы, определяемой соотношением:
H =U + pV
где V – объём системы.
При постоянном давлении р изменение энтальпии равно количеству теплоты, подведённой к системе, поэтому энтальпию часто называют тепловой функцией или теплосодержанием. В состоянии термодинамического равновесия энтальпия системы минимальна.
© А.В. Бармасов, 2006-2013 |
16 |
12+ |
|
3.3.2. Молекулярно-кинетический смыслсмысл теплоёмкости CV; теплоёмкости одноатомныхатомных ии многоатомных газов
Наряду с поступательным движением для многоатомных молекул возможно также вращение молекулы и колебания атомов, входящих в молекулу (т. е. не колебание молекулы как целого – это движение фактически является поступательным, а изменение размеров молекулы из-за колебания составляющих её атомов без колебаний самой молекулы).
Оба эти вида движения (вращательное и колебательное) связаны с некоторым запасом энергии, определить который позволяет устанавливаемое статистической физикой положение о равнораспределении энергии по
степеням свободы молекулы (закон равнораспределения энергии).
© А.В. Бармасов, 2006-2013 |
17 |
12+ |
|

Модель молекулы двухатомного газа
© А.В. Бармасов, 2006-2013 |
18 |
12+ |
|
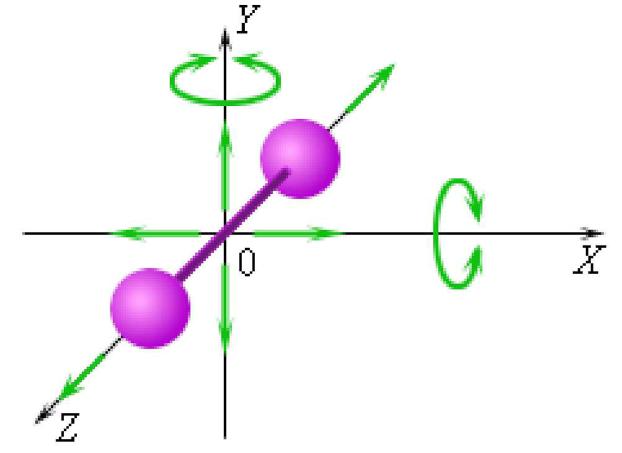
Число степеней свободы двухатомной молекулы
© А.В. Бармасов, 2006-2013 |
19 |
12+ |
|
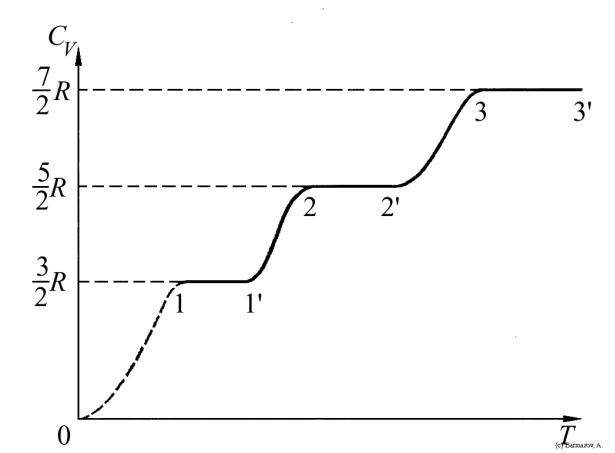
Кривая зависимости теплоёмкости киломоля CV от температуры, полученная опытным путём для молекулы водорода
© А.В. Бармасов, 2006-2013 |
20 |
12+ |
|
