
pract1
.pdfМинистерство образования Республики Беларусь
Учреждение образования «Гомельский государственный технический университет
имени П.О. Сухого»
Кафедра «Металлургия и литейное производство»
В.А. Жаранов
ТЕОРИЯ МЕТАЛЛУРГИЧЕСКИХ ПРОЦЕССОВ
Методические указания к практическим и контрольным работам по одноименному курсу для студентов дневного и заочного отделения специальности 1-42 01 01 «Металлургическое производство и материалообработка» (по направлениям)
Гомель 2010
УДК 669.02/.09(075.8)
ББК
Рекомендовано к изданию научно-методическим советом механикотехнологического факультета ГГТУ имени П.О.Сухого (протокол №9 от
28.12. 2010 г.)
Автор-составитель: В.А. Жаранов
Рецензент: к.т.н., доцент, зав. кафедрой «Материаловедение в машиностроении » ГГТУ им. П.О. Сухого И.Н. Степанкин
!
!
Теория металлургических процессов: методические указания к практическим и контрольным работам по одноименному курсу для студентов дневного и заочного отделения специальности 1-42 01 01 «Металлургическое производство и материалообработка» (по направлениям)/ авт.-сост. В.А.Жаранов. – Гомель: ГГТУ им. П.О.Сухого, 2010. – 43 с.
ISBN
В учебном пособии представлены задачи и образцы их решения применительно к термодинамике высокотемпературных процессов, протекающих в металлургических агрегатах: рассмотрены закономерности взаимодействия газовой, шлаковой и металлической фаз, процессы раскисления металлических расплавов. Пособие предназначено для студентов, обучающихся по специальности 1-42 01 01 01 «Металлургическое производство и материалообработка» (металлургия)
2
|
Содержание |
|
1 |
Расчет окислительно-восстановительных реакций........................................ |
4 |
2 |
Расчеты восстановительных процессов в металлургических процессах ... |
11 |
3 |
Термодинамика процессов в расплавах металлов........................................ |
14 |
4 |
Расчет межфазных взаимодействий в сталеплавильных агрегатах............ |
19 |
5 |
Расчет реакций в газовой фазе металлургических плавильных агрегатов. 22 |
|
6 |
Раскисление металлических расплавов. Расчеты процессов химической |
|
диссоциации в металлургических процессах................................................... |
27 |
|
7 |
Термодинамика и физико-химические процессы в шлаковых расплавах. |
|
Моделирование и расчет процессов в металлургических шлаках................. |
34 |
|
|
Варианты заданий для контрольных работ................................................... |
42 |
Литература.......................................................................................................... |
43 |
|
3
1 Расчет окислительно восстановительных реакций
Большую роль в металлургических процессах играет реакция взаимодействия твердого углерода с кислородсодержащей газовой фазой. Взаимодействие кислорода газовой фазы с твердым углеродом происходит по двум реакциям:
C O2 |
CO2 ; |
(1) |
2C O2 |
2CO . |
(2) |
При избытке твердого углерода в системе реакции (1) и (2) характеризуются очень низким остаточным содержанием кислорода в равновесной газовой смеси. Соотношение между CO и CO2 в равновесной
газовой смеси можно установить из анализа условий равновесия реакции газификации твердого углерода:
C CO2 2CO ; |
|
|
(3) |
|
P2 |
|
|
Kp3 |
CO |
. |
(4) |
|
|||
|
PCO2 |
|
|
Для расчета равновесного состава газовой фазы реакции (3) записываем константу равновесия (4) через состав смеси, выраженный в объемных процентах:
Kp3 |
|
(%CO)2 |
|
|
P |
, |
(5) |
|
(%CO2 ) |
100 |
|||||||
|
|
|
|
|
||||
где Р – общее давление в газовой смеси.
Если в газовой фазе нет других газов, кроме CO2 и CO, то их сумма равна 100%. Обозначим: (%CO) = х; (%CO2 ) = 100–х.
Подставляя эти обозначения в выражение для константы равновесия, получаем:
Kp3 |
|
x2 |
|
|
P |
. |
||
(100 |
x) |
100 |
||||||
|
|
|
|
|||||
Решение полученного квадратного уравнения позволяет определить равновесную концентрацию окиси углерода в газовой смеси:
4

|
Kp3 |
|
|
P |
|
|
|
(%CO) x 50 |
|
|
1 4 |
|
1 . |
(6) |
|
P |
Kp3 |
||||||
|
|
|
|
|
|||
|
|
|
|
|
|
|
Взаимодействие газовой смеси из кислорода и азота (обычный или обогащенный кислородом воздух) с твердым углеродом приводит при избытке твердого углерода в системе к образованию смеси из CO2 и CO с
определенным содержанием в ней азота. Для определения равновесного состава газовой фазы реакции (3) в этом случае вводим обозначения: (%CO
) = х; (%CO2 ) = y; (%N2 ) = z.
Составляем уравнения, связывающие переменные величины x, y и z:
Kp3 |
x2P |
; |
(7) |
|
100y |
||||
|
|
|
||
x + y + z = 100. |
(8) |
|||
Третье уравнение определяет содержание азота в смеси. На образование 1 моля CO2 расходуется 1 моль O2 , а на образование 1 моля CO – 0,5 моля
O2 . Для обогащенного кислородом воздуха вводим обозначение
nN2 / nO2 |
(%N2 ) /(%O2 ), |
|
||
т.е. каждый моль O2 вносит в смесь γ молей N2 . Поэтому третье уравнение |
||||
имеет вид: |
|
|
|
|
|
z |
x y . |
(9) |
|
|
|
|||
|
2 |
|
|
|
Решая систему уравнений (7)–(9), находим значение х, т.е. содержание CO в равновесной газовой смеси:
|
25( |
2) |
Kp3 |
|
|
16( 1) P |
|
|
||
x |
|
|
|
|
1 |
|
|
1 . |
(10) |
|
( 1) |
P |
( 2)2 Kp3 |
||||||||
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
Далее из уравнения (7) находим величину у, а из уравнения (8) –
величину z. |
|
|
|
и CO в составе смеси |
|
Для нахождения относительного содержания CO2 |
|||||
пользуемся соотношением |
|
|
|
|
|
(%CO)отн |
%CO |
100 |
; |
(11) |
|
%CO %CO2 |
|||||
|
|
|
|
||
5
(%CO2 )отн 100 (%CO)отн . |
(12) |
Значение равновесного давления кислорода в газовой смеси находим из условий равновесия реакции 2CO O2 2CO2 для заданной температуры и
давления.
Константа равновесия этой реакции
Kp |
(%CO2 )2 |
100 |
. |
|
(%CO)2 (%O2 ) P |
||||
|
|
|||
Равновесное давление кислорода в газовой смеси
PO2 (%O2 )P /100 (%CO2 / %CO)2 / KP .
Значение кислородного потенциала для равновесной газовой смеси CO в присутствии твердого углерода определяем по уравнению
0 19,155TlgPO2 .
(13)
(13)
CO2 –
(14)
Пример 1. Определить состав равновесной газовой смеси, полученной при взаимодействии обогащенного кислородом воздуха с твердым углеродом для заданных условий и рассчитать равновесное давление кислорода в газовой смеси.
Условия задачи:
состав обогащенного воздуха: N2 – 76%, O2 – 24%;
общее давление в системе Р’= 0,5·105 Па;
расчет произвести для шести температур в интервале 700…950 °С.
Решение. Исходные данные для расчета приводим в виде таблицы 1. Таблица 1
Состав обогащенного |
|
Температура, °С |
|
Давление |
|||||
|
воздуха, % |
|
|
||||||
|
|
|
|
|
|
|
Р’, Па |
||
N2 |
|
O2 |
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
||||||||
76 |
|
24 |
700 |
750 |
800 |
850 |
900 |
950 |
0,5·105 |
Для определения равновесного состава газовой смеси находим соотношение между азотом и кислородом в обогащенном воздухе:
7624 3,1667 .
6

Пользуясь уравнением lg Kp3 |
9001 |
9,28, находим значения |
Kp3 для |
||||||
|
|
|
|
T |
|
|
|
|
|
шести заданных температур (таблица 2). |
|
|
|
Таблица 2 |
|||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Т, К |
973 |
1023 |
|
1073 |
|
1123 |
1173 |
|
1223 |
Kp3 |
1,07 |
3,03 |
|
7,79 |
|
18,40 |
40,41 |
|
83,22 |
Подставляя величины Р=Р’·10 5 и в уравнение (10), получаем расчетное уравнение для определения значений х при заданных температурах:
|
25(3,1667 2) |
Kp3 |
|
|
16(3,1667 1) 0,5 |
|
|
|
|
|
1,2487 |
|
||
x |
|
1) |
|
|
1 |
(3,1667 2)2 Kp3 |
1 |
62K |
p3 |
|
1 |
|
1 . |
|
(3,1667 |
0,5 |
Kp3 |
||||||||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Подставляя в полученное уравнение найденные ранее значения Kp3 ,
находим значения х для шести заданных температур.
Подставляя значение Р=Р’·10 5 в уравнение (7), получаем расчетное уравнение для определения величин y при заданных температурах:
y |
x2 |
|
0,5 |
0,005 |
x2 |
. |
Kp3 |
100 |
|
||||
|
|
|
Kp3 |
|||
Находим значения y для найденных величин х. Подставляя полученные значения х и y в уравнение (8), находим z = 100 – (x + y).
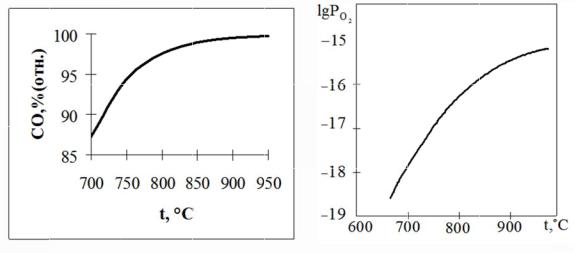
По уравнениям (11) и (12) определим относительное содержание CO и CO2 в составе смеси для заданных температур.
Определение равновесного давления кислорода в газовой смеси CO2 – CO
производим путем подстановки в уравнение (14) значений концентраций CO2 и CO для соответствующих температур:
PO2 (%CO2 / %CO)2 / KP (y / x)2 / KP .
Расчет значений Kp производим по уравнению lg Kp 29566T 9,16 .
Результаты расчета сводим в таблице 3 ( PO' 2 (Па) P 105 ) [5].
7
|
|
|
|
|
|
|
|
|
|
|
|
|
Табл ца 3 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Состав |
|
|
Относительно |
|
|
|
|
||
№ |
T, °C |
T, К |
равнове ной |
|
е содержание, |
PO' |
, П а |
lg PO' |
|
||||||
п/п |
|
|
|
газовой смеси, % |
|
|
|
|
2 |
|
2 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
CO2 |
N2 |
|
CO |
|
CO2 |
|
|
|
|
1 |
700 |
973 |
31, 32 |
|
4,58 |
64,10 |
|
87,2 |
|
12,8 |
1,28·10 18 |
–17 ,89 |
|||
2 |
750 |
1 023 |
35, 39 |
|
2,78 |
62,54 |
|
94,5 |
|
5,5 |
6,19·10 18 |
–17 ,21 |
|||
3 |
800 |
1 073 |
37, 27 |
|
0,89 |
61,84 |
|
97,7 |
|
2,3 |
2,31·10 18 |
–16 ,69 |
|||
4 |
850 |
1 123 |
38, 07 |
|
0,39 |
61,54 |
|
99,0 |
|
1,0 |
7,27·10 18 |
–16 ,14 |
|||
5 |
900 |
1 173 |
38, 42 |
|
0,18 |
61,40 |
|
99,5 |
|
0,5 |
2,02·10 18 |
–15 ,69 |
|||
6 |
950 |
1 223 |
38, 56 |
|
0,09 |
61,35 |
|
99,8 |
|
0,2 |
5,25·10 18 |
–15 ,28 |
|||
Используя |
расчетные данные, строим |
графики |
зависим сти |
состава |
|||||||||||
равновесной |
газовой |
смеси |
для |
реакции газификации |
углерода |
от |
|||||||||
температуры |
(рис. 1) и |
|
зависимости |
|
равновесного давления кислорода |
в |
|||||||||
газов ой смеси |
(CO2 CO ) |
для реакции газифи ации |
глерода |
от |
||||||
температуры (рис. 2). |
|
|
|
|
|
|
|
|
||
Рис. 1. Зависимость относительного |
Рис. 2. Зависимость |
|
|
|
||||||
сод ержани COв газовой смеси для |
равновесного давления |
|
|
|||||||
реакции газификац и углерод от |
кислорода в |
газовой смеси |
CO – |
|||||||
тем пературы |
|
|
|
CO для реак ции газ ификации |
||||||
За ание. |
|
|
|
|
углерода от температуры |
|
||||
Д ля заданного |
варианта |
условий |
задачи (табл це |
4) |
|
|||||
рассчитать |
значения |
равновесного |
давления |
кислорода |
и |
|
||||
кислородных |
потенциалов |
в равновесной |
газовой |
смеси, |
|
|||||
образующейс |
при |
взаимо действии |
обогащенного |
кислородом |
|
|||||
8
воздуха ( N2 – O2 ) с твердым углеродом для шести заданных
температур.
Результаты расчета привести в виде таблице. 4.
Таблица 4 Результаты расчета окислительных свойств газовой смеси
|
|
|
|
|
|
|
|
|
|
|
Состав |
|
|
|
Относительно |
|
PO2 , |
|
|
|
|
0 , |
|||||
№ |
|
t, °C |
|
T, K |
|
равновесной |
|
е содержание, |
|
|
lgPO2 |
|
|||||||||||||||
п/п |
|
|
|
газовой смеси, % |
|
% |
|
|
Па |
|
|
Дж |
|||||||||||||||
|
|
|
|
|
|
|
|
CO |
|
CO2 |
|
N2 |
|
CO |
|
CO2 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Варианты условий задачи приведены в таблице 5. |
|
Таблица 5 |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
№ |
|
|
Состав |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
обогащенног |
|
|
|
|
|
|
Температура, °C |
|
|
|
|
Давление |
||||||||||||||
вари- |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
о воздуха, % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, Па·10-5 |
||||||||||
анта |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N2 |
|
O2 |
|
|
1 |
2 |
|
3 |
|
4 |
|
5 |
|
6 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
1 |
|
2 |
|
3 |
|
|
4 |
5 |
|
6 |
|
7 |
|
8 |
|
9 |
|
|
|
10 |
|||||||
1 |
|
|
74 |
|
26 |
|
|
710 |
760 |
|
810 |
|
860 |
|
910 |
|
960 |
|
|
|
0,5 |
||||||
2 |
|
|
72 |
|
28 |
|
|
720 |
770 |
|
820 |
|
870 |
|
920 |
|
970 |
|
|
|
0,5 |
||||||
3 |
|
|
70 |
|
30 |
|
|
730 |
780 |
|
830 |
|
880 |
|
930 |
|
980 |
|
|
|
0,5 |
||||||
4 |
|
|
68 |
|
32 |
|
|
740 |
790 |
|
840 |
|
890 |
|
940 |
|
990 |
|
|
|
0,5 |
||||||
5 |
|
|
66 |
|
34 |
|
|
750 |
800 |
|
850 |
|
900 |
|
950 |
|
1000 |
|
|
0,5 |
|||||||
6 |
|
|
64 |
|
36 |
|
|
702 |
752 |
|
802 |
|
852 |
|
902 |
|
952 |
|
|
|
0,9 |
||||||
7 |
|
|
62 |
|
38 |
|
|
712 |
762 |
|
812 |
|
862 |
|
912 |
|
962 |
|
|
|
0,9 |
||||||
8 |
|
|
60 |
|
40 |
|
|
722 |
772 |
|
822 |
|
872 |
|
922 |
|
972 |
|
|
|
0,9 |
||||||
9 |
|
|
58 |
|
42 |
|
|
732 |
782 |
|
832 |
|
882 |
|
932 |
|
982 |
|
|
|
0,9 |
||||||
10 |
|
56 |
|
44 |
|
|
742 |
792 |
|
842 |
|
892 |
|
942 |
|
992 |
|
|
|
0,9 |
|||||||
11 |
|
54 |
|
46 |
|
|
752 |
802 |
|
852 |
|
902 |
|
952 |
|
1002 |
|
|
0,9 |
||||||||
12 |
|
52 |
|
48 |
|
|
704 |
754 |
|
804 |
|
854 |
|
904 |
|
954 |
|
|
|
1,3 |
|||||||
13 |
|
50 |
|
50 |
|
|
714 |
764 |
|
814 |
|
864 |
|
914 |
|
964 |
|
|
|
1,3 |
|||||||
14 |
|
48 |
|
52 |
|
|
724 |
774 |
|
824 |
|
874 |
|
924 |
|
974 |
|
|
|
1,3 |
|||||||
15 |
|
75 |
|
25 |
|
|
734 |
784 |
|
834 |
|
884 |
|
934 |
|
984 |
|
|
|
1,3 |
|||||||
16 |
|
73 |
|
27 |
|
|
744 |
794 |
|
844 |
|
894 |
|
944 |
|
994 |
|
|
|
1,3 |
|||||||
17 |
|
71 |
|
29 |
|
|
754 |
804 |
|
854 |
|
904 |
|
954 |
|
1004 |
|
|
1,3 |
||||||||
18 |
|
69 |
|
31 |
|
|
706 |
756 |
|
806 |
|
856 |
|
906 |
|
956 |
|
|
|
1,7 |
|||||||
19 |
|
67 |
|
33 |
|
|
716 |
766 |
|
816 |
|
866 |
|
916 |
|
966 |
|
|
|
1,7 |
|||||||
20 |
|
65 |
|
35 |
|
|
726 |
776 |
|
826 |
|
876 |
|
926 |
|
976 |
|
|
|
1,7 |
|||||||
21 |
|
63 |
|
37 |
|
|
736 |
786 |
|
836 |
|
886 |
|
936 |
|
986 |
|
|
|
1,7 |
|||||||
22 |
|
61 |
|
39 |
|
|
746 |
796 |
|
846 |
|
896 |
|
946 |
|
996 |
|
|
|
1,7 |
|||||||
9
Окончание таблицы 5 |
|
|
|
|
|
|
|
||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
23 |
59 |
42 |
756 |
806 |
856 |
906 |
956 |
1006 |
1,7 |
24 |
57 |
43 |
708 |
758 |
808 |
858 |
908 |
958 |
2,1 |
25 |
55 |
45 |
718 |
768 |
818 |
868 |
918 |
968 |
2,1 |
26 |
53 |
47 |
728 |
778 |
828 |
878 |
928 |
978 |
2,1 |
27 |
51 |
49 |
738 |
788 |
838 |
888 |
938 |
988 |
2,1 |
28 |
49 |
51 |
748 |
798 |
848 |
898 |
948 |
998 |
2,1 |
29 |
47 |
53 |
758 |
808 |
858 |
908 |
958 |
1008 |
2,1 |
Контрольные вопросы
1.Понятие кислородного потенциала сложной газовой фазы.
2.Общие характеристики окислительного потенциала газовой фазы.
3.Расчет равновесного давления кислорода и кислородных потенциалов в равновесной газовой смеси.
4.Факторы, влияющие на изменение равновесного состава газовой фазы при окислении твердого углерода.
10
