
pract1
.pdfТаблица 12
№ вари- |
Т1, К |
Т2 , К |
P, атм |
Содержание легирующих элементов, % |
|
|||||||
анта |
Si |
Mo |
|
|
Cr |
|
Mn |
C |
||||
|
|
|
|
|
|
|||||||
1 |
1873 |
1800 |
0,01 |
0,5 |
1,0 |
|
1,0 |
0,5 |
|
0,1 |
||
2 |
1823 |
1773 |
0,03 |
0,6 |
0,9 |
|
1,5 |
0,6 |
|
0,2 |
||
3 |
1773 |
1823 |
0,10 |
0,7 |
0,8 |
|
2,0 |
0,7 |
|
0,3 |
||
4 |
1723 |
1700 |
0,20 |
0,8 |
0,7 |
|
2,5 |
0,8 |
|
0,4 |
||
5 |
1673 |
1723 |
0,30 |
0,9 |
0,6 |
|
3,0 |
0,9 |
|
0,5 |
||
6 |
1723 |
1773 |
0,40 |
1,0 |
0,5 |
|
3,5 |
1,0 |
|
0,6 |
||
7 |
1773 |
1873 |
0,50 |
1,1 |
0,4 |
|
4,0 |
1,1 |
|
0,7 |
||
|
|
|
|
|
|
|
Окончание |
|
таблицы |
12 |
||
№ вари- |
Т1, К |
Т2 , К |
P, атм |
Содержание легирующих элементов, % |
|
|||||||
анта |
Si |
Mo |
|
|
Cr |
|
Mn |
|
C |
|||
|
|
|
|
|
|
|
||||||
8 |
1823 |
1673 |
0,40 |
1,2 |
0,3 |
|
|
4,5 |
|
1,2 |
|
0,8 |
9 |
1873 |
1723 |
0,30 |
1,3 |
0,2 |
|
|
5,0 |
|
1,3 |
|
0,9 |
10 |
1925 |
1800 |
0,20 |
1,4 |
0,1 |
|
|
5,5 |
|
1,4 |
|
1,0 |
11 |
1900 |
1823 |
0,10 |
1,5 |
0,2 |
|
|
6,0 |
|
1,5 |
|
1,1 |
12 |
1873 |
1800 |
0,01 |
1,6 |
0,3 |
|
|
6,5 |
|
1,6 |
|
1,2 |
13 |
1823 |
1673 |
0,05 |
1,7 |
0,4 |
|
|
7,0 |
|
1,7 |
|
1,2 |
14 |
1800 |
1700 |
0,15 |
1,8 |
0,5 |
|
|
7,5 |
|
1,8 |
|
1,1 |
15 |
1773 |
1923 |
0,25 |
1,9 |
0,6 |
|
|
8,0 |
|
1,9 |
|
1,0 |
16 |
1723 |
1673 |
0,35 |
2,0 |
0,7 |
|
|
8,5 |
|
2,0 |
|
0,9 |
17 |
1700 |
1900 |
0,45 |
1,9 |
0,8 |
|
|
9,0 |
|
1,9 |
|
0,8 |
18 |
1673 |
1873 |
0,55 |
1,8 |
0,9 |
|
|
9,5 |
|
1,8 |
|
0,7 |
19 |
1723 |
1923 |
0,50 |
1,7 |
1,0 |
|
|
10,0 |
|
1,7 |
|
0,6 |
20 |
1773 |
1900 |
0,03 |
1,6 |
1,1 |
|
|
9,0 |
|
1,6 |
|
0,5 |
21 |
1800 |
1673 |
0,13 |
1,5 |
1,2 |
|
|
8,0 |
|
1,5 |
|
0,4 |
22 |
1823 |
1900 |
0,27 |
1,4 |
1,3 |
|
|
7,0 |
|
1,4 |
|
0,3 |
23 |
1873 |
1700 |
0,33 |
1,3 |
1,4 |
|
|
6,0 |
|
1,3 |
|
0,2 |
24 |
1900 |
1673 |
0,01 |
1,2 |
1,5 |
|
|
5,0 |
|
1,2 |
|
0,1 |
25 |
1923 |
1823 |
0,47 |
1,1 |
1,6 |
|
|
4,0 |
|
1,1 |
|
1,0 |
Контрольные вопросы:
1.Понятие растворимости газов в металле.
2.Закон Сивертса.
3.Факторы, влияющие на растворимость газов в металле.
4.Расчет растворимости газов в чистом металле.
5.Расчет растворимости газов в легированном расплаве.
21
5 Расчет реакций в газовой фазе металлургических плавильных агрегатов
При взаимодействии азота с расплавами, легированными карбидообразующими элементами, возможно образование раствора Fe–R–N, равновесного с газовой фазой, причем с увеличением содержания R увеличивается растворимость азота. При определенных содержаниях компонента R из расплава может выделиться тугоплавкое соединение – нитрид RN. Наибольшим сродством к азоту обладают элементы IVa подгруппы Ti, Zr, Ра, которые и используются в основном для связывания азота в жидком металле.
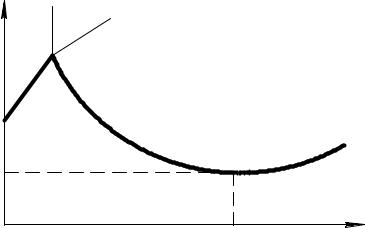
Особенности взаимодействия азота с металлическими расплавами отражает диаграмма состояний системы Me–R–N, фрагмент изотермического сечения которой в областях, богатых металлом, представлен на рисунке 3.
[N] |
F |
4 |
B |
|
Области стабильности фаз: |
|
1 |
B |
|
||||
|
|
|
|
1 |
ж+N2 , |
|
|
|
|
|
3 |
2 |
ж, |
|
|
|
|
3 |
ж+RN, |
|
|
2 |
|
|
|
||
|
|
|
|
4 ж+RN+N2 |
||
|
A |
|
|
C |
||
[N]* |
|
|
D |
|
||
|
|
|
|
|
||
|
|
|
|
|
|
|
0 |
|
|
|
[R]* |
[R] |
|
Рисунок 3 – Схема изометрического сечения диаграммы состояния системы |
||||||
|
|
|
|
Me–R–N |
|
|
Линии, ограничивающие области стабильности фаз, описываются соответствующими уравнениями равновесной термодинамики.
Как видно из диаграммы, при небольших содержаниях нитридообразующего элемента существует двухфазная область стабильности жидкой фазы с газообразным азотом. Координаты линии АВ, разделяющей эту область (I) и область стабильности жидкости (II) можно определить, проанализировав уравнение [2]:
22
1 N |
|
[N], |
k |
|
aN |
. |
(40) |
|
|
|
|||||
2 |
2 |
|
1 |
p1/N22 |
|
||
При PN2 1 атм активность |
|
азота |
равна |
константе |
равновесия |
||
реакции (40). Концентрация азота в точке А равна его растворимости в бинарной системе Me–N.
Для построения линии BCD необходимо рассмотреть реакцию образования нитрида элемента R (таблица 13):
[R] [N] RNтв, |
k2 |
1 |
. |
(41) |
|
||||
|
|
aR aN |
|
|
Значение константы равновесия реакции (41) можно определить, зная температурную зависимость изменения энергии Гиббса:
lg(k2 ) |
G0 |
|
2 |
. |
|
|
||
|
2,3RT |
|
Рассматривая совместно с (40) равновесия следующих процессов (таблица 14):
|
Rтв [R], |
G30 ; |
|
|
(42) |
||||||
R |
|
|
1 N |
|
RN |
|
, |
G0 |
, |
(43) |
|
|
тв |
|
2 |
2 |
|
|
тв |
|
4 |
|
|
выразим G02 :
G0 |
G0 |
G0 |
G0 |
f (t) . |
|
2 |
4 |
3 |
1 |
|
|
Отметим, что в данном случае для азота и для элемента R за |
|
||||
стандартное принято состояние 1%-ного разбавленного раствора. |
|
||||
Определяя активности с помощью параметров взаимодействия |
|
||||
Вагнера (таблица 15) и |
учитывая, |
что |
eNN 0 для константы |
|
|
равновесия реакции (41), получаем |
|
|
|
||
lg(k2 ) (lg[R] eRR[R] eNN[N] lg[N] eRN[R]. |
(44) |
||||
|
|
23 |
|
|
|

Таблица 13 Изменение энергии Гиббса при растворении азота и элемента R
Растворитель |
Реакция |
Элемент |
G0 A BT, Дж/моль |
||
A |
B |
||||
|
|
|
|||
|
40 |
N |
10 500 |
20,37 |
|
Fe |
42 |
Ti |
–68 500 |
–27,28 |
|
42 |
Zr |
–80 300 |
–37,90 |
||
|
|||||
|
42 |
Hf |
–115 000 |
–31,41 |
|
|
40 |
N |
69 270 |
18,68 |
|
Ni |
42 |
Ti |
–183 700 |
–9,85 |
|
42 |
Zr |
–202 100 |
–20,50 |
||
|
|||||
|
42 |
Hf |
–216 300 |
–17,45 |
|
Выражение (44) является уравнением, описывающим линию BCD. Очевидно, что это немонотонная функция, имеющая экстремумы. Продифференцировав уравнение (44) по содержанию компонента R, при
условии [N] [R] 0 можно определить его концентрацию [R]* ,
обеспечивающую минимальное содержание азота в расплаве [N]* :
|
|
|
|
|
|
|
* |
2,3 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
[R] |
|
|
|
. |
|
|
|
(45) |
||
|
|
|
|
|
|
|
eRR eRN |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 14 |
|
Изменение энергии Гиббса при образовании нитридов из чистых веществ (43) |
|||||||||||||||||
|
|
|
|
|
|
|
[1] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Элемент R |
|
|
|
Ti |
|
Zr |
|
|
|
Hf |
|||||||
G04 |
|
A |
|
B |
A |
|
|
B |
|
A |
|
B |
|
||||
|
–339 |
|
93,26 |
|
–364 |
|
92,59 |
|
–367 |
|
91,67 |
|
|||||
|
|
100 |
|
|
410 |
|
|
730 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
Значения параметров взаимодействия |
|
|
|
Таблица 15 |
|||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Растворитель |
|
|
|
Fe |
|
|
|
|
|
|
Ni |
|
|
|
|||
R |
|
|
|
eRR |
|
eRN |
|
|
|
eRR |
|
|
|
eRN |
|
||
Ti |
|
|
0,045 |
|
–0,45 |
|
|
0,086 |
|
|
|
–0,22 |
|
||||
Zr |
|
|
0,028 |
|
–0,63 |
|
|
0,059 |
|
|
|
–0,40 |
|
||||
Hf |
|
|
0,018 |
|
–0,70 |
|
|
0,040 |
|
|
|
–0,61 |
|
||||
|
|
|
|
|
|
|
24 |
|
|
|
|
|
|
|
|
|
|
Пересечение изотермы нитридообразования (BCD) и линии (АВ), соответствующей растворимости азота в расплаве Fe–R–N при pN2 1
атм, дает точку (В) трехфазного равновесия ж + Nг + RN.
Линии BF и BE, ограничивающие трехфазную область IV, соединяют точку В с фигуративными точками, соответствующими равновесным фазам. Линия BЕ заканчивается на стороне [N]–[R] концентрационного треугольника в точке, отвечающей соединению RN, а линия BF – в точке, соответствующей чистому азоту при pN2 1
атм.
Задание:
Используя необходимые данные (таблица 16) для системы Me–R– N, рассчитать:
1)линию, ограничивающую двухфазную область (ж+N2) при давлении азота 1 атм (температура Т1 и Т2);
2)изотерму нитридообразования при температурах Т1 и Т2 при изменении содержания элемента R до 2 % (для растворов Fe) и 5 % (для растворов Ni);
3)условие минимального содержания азота в расплаве при температуре Т1 и Т2.
|
|
|
|
Таблица 16 |
|
|
|
|
|
№ варианта |
|
Исходные данные |
|
|
R |
T1 |
|
T2 |
|
|
|
|||
1 |
Ti |
1973 |
|
1723 |
2 |
Zr |
1923 |
|
1700 |
3 |
Hf |
1900 |
|
1673 |
4 |
Ti |
1873 |
|
1700 |
5 |
Zr |
1823 |
|
1723 |
6 |
Hf |
1800 |
|
1973 |
7 |
Ti |
1773 |
|
1923 |
8 |
Zr |
1723 |
|
1900 |
9 |
Hf |
1700 |
|
1823 |
10 |
Ti |
1673 |
|
1823 |
11 |
Zr |
1700 |
|
1800 |
12 |
Hf |
1723 |
|
1873 |
25
Контрольные вопросы
1.Термодинамика растворения азота в металле.
2.Условия нитридообразования в чистом и легированном расплаве.
3.Влияние температуры на нитридообразование.
4.Расчет равновесной кривой нитридообразования.
26
6 Раскисление металлических расплавов. Расчеты процессов химической диссоциации в металлургических процессах
Под раскислением понимают комплекс операций по снижению содержания кислорода в жидкой стали.
Основными задачами раскисления являются:
–снижение содержания кислорода в жидком железе присадками элементов с большим сродством к кислороду, чем у железа, до уровня, обеспечивающего получение плотного металла;
–создание условий для более полного удаления из жидкой стали продуктов раскисления.
Если первая задача рассматривается с использованием законов химической термодинамики, то вторая решается при помощи аппарата химической кинетики.
Термодинамический подход позволяет выявить связь между содержанием кислорода в жидкой стали и содержанием элементараскислителя R, определить степень влияния температуры на характер этой связи, а также рассчитать минимальное содержание кислорода в металлическом расплаве при раскислении его элементом
R.
Рассмотрим случай, когда при раскислении металлического расплава каким-либо элементом R происходит образование твердой конденсированной фазы R mOn в соответствии с реакцией вида
m[R] n[O] RmOn . |
(46) |
При условии aRmOn =1 константа равновесия данной реакции примет вид
K |
|
|
|
1 |
, |
(47) |
|
R |
am |
an |
|||||
|
|
|
|
||||
|
|
|
[R] |
[O] |
|
|
где ai – активность i-го компонента в расплаве.
Для расчета активностей компонентов расплава за стандартное состояние целесообразно принять 1%-ный разбавленный раствор.
Значение константы равновесия KR можно определить по изменению свободной энергии реакции (46):
27
ln(K ) G10 . R RT
(48)
Значение G10 , в свою очередь, определяется из анализа реакции образования оксида R mOn из чистого компонента R и кислорода при PO2 1 атм, а также реакций растворения в металле кислорода и элемента R:
mR n |
R |
O2 RmOn , |
G02 ; |
|
1 |
|
|
|
|
2 |
O2 [O], |
G30 ; |
||
|
|
|
|
|
R [R], |
|
G04 ; |
|
m[R] n[O] RmOn ; |
|||
G0 |
G0 |
G0 |
G0 . |
1 |
2 |
3 |
4 |
(49)
С учетом уравнения (49) в выражении (48) константу равновесия можно записать как функцию температуры:
ln(KR ) |
G0 |
|
А |
В, |
1 |
Т |
|||
|
RT |
|
|
где А и В – постоянные для данной химической реакции.
Чтобы рассчитать равновесные концентрации кислорода и элемента R, в уравнении (46) активности компонентов выражают через их концентрации и коэффициенты активности:
KR |
1 |
. |
(50) |
|
([R]m fRm[O]n fOn |
||||
|
|
|
Коэффициенты активности fR и fO можно оценить при помощи параметров взаимодействия первого порядка с учетом принятого стандартного состояния:
lg(fO ) eRR [R] eOR [O] eRj [j]; |
(51) |
lg(fO ) eOO[O] eOR [R] eOj [ j]; |
(52) |
Прологарифмировав уравнение (50) и выразив концентрацию кислорода через остальные члены суммы, определим раскислительную способность элемента R по равновесной концентрации кислорода:
28
lg[O] |
1 |
|
m |
|
|
m |
lg(fO ) . |
(53) |
|
n lg(KR ) |
n lg[R] |
n lg(fR ) |
|||||||
|
|
|
|
|
|||||
Чтобы рассчитать минимальную концентрацию кислорода в металлическом расплаве, раскисляемом элементом R, необходимо продифференцировать уравнение (53) по концентрации этого элемента и приравнять к нулю:
dln[O] |
m |
dln[R] |
m |
dln(fR ) |
dln(fO ) . |
d[R] |
n |
d[R] |
n |
d[R] |
d[R] |
Приравнивая правую часть уравнения (54) к нулю и решая его относительно R, находим концентрацию раскислителя R, соответствующую минимальному содержанию кислорода в металле; при этом значение коэффициентов активности компонентов находим по соотношениям (51) и (52):
mn [R]1 mn 2,3eRR 2,3eOR 0 ;
[R]1 2,3eRR mn 2,3eOR .
Подставляя значение [R] из соотношения (56) в уравнение (53), определяем минимальную концентрацию кислорода в металлическом расплаве, раскисляемом элементом R:
[O] (KRfRmfOn ) 1n m n |
2,3(m eRR n eOR . |
|
m |
Пример. Рассчитать равновесную концентрацию кислорода в жидком железе при раскислении его марганцем ([Mn,%]=0,3...1,2) при температуре 1600 0C. Определить минимальное содержание кислорода в железе при раскислении его марганцем.
При взаимодействий марганца с растворенным в железе кислородом происходит образование твердого оксида в соответствии с реакцией вида
[Mn] [O] MnO ;
при этом aMnO 1 и константа равновесия выражается уравнением
KMn 1a[Mn]a[O] .
(59)
29
(54)
(55)
(56)
(57)
(58)

Константа равновесия данной реакции связана с изменением свободной энергии образования оксида известным соотношением
lg(KMn ) G0 . 2,3RT
Значение G0 можно определить из анализа реакции образования оксида MnOтв из чистого Mn и кислорода при PO2 1 атм, при этом
будем учитывать реакцию растворения в железе кислорода и марганца:
Mn 12 O2 MnO, G0T 95400 19,70T(кал/ моль) ;
Mn [Mn], |
GT0 |
1320 9,350T(кал/ моль) ; |
||||
1 |
2 |
O |
2 |
[O], |
G0 |
28000 0,69T(кал/ моль) . |
|
|
|
T |
|
||
Комбинируя реакции |
(61) |
– (63) (вычитая из первой две |
||||
оставшиеся), получаем исходную реакцию (58). Соответственно для нее изменение свободной энергии будет иметь значение
G0T = –95 400 + 19,70Т – 1320 + 9,35Т + 28 000+ 0,69Т = –68720 +
29,74Т.
В соответствии с уравнением (60) константа равновесия будет иметь вид
lg(Kmn ) 68720 29,87Т 15036 6,51. 2,3 1,987Т Т
Активности компонентов a[Mn] ] и a[O] выразим через их концентрации (в %) и коэффициенты активности:
a[Mn] [Mn]fMn ; a[O] [O]fO .
Коэффициенты активности рассчитаем с помощью параметров, взаимодействия:
lg(fMn ) eMnMn [Mn] eOMn [O] lg(fO ) eOO[O] eOMn[Mn].
В растворах Fe–Mn–O концентрация кислорода мала, поэтому в соотношениях (67) произведениями eOMn[O] и eOO[O] можно
пренебречь. Кроме того, параметр взаимодействия eMnMn 0. Следовательно, fMn 1, а lg(fO ) eOMn[Mn].
С учетом этого, константа равновесия реакции раскисления марганца будет иметь вид
KMn |
1 |
. |
|
[Mn] [O] fO |
|||
|
|
(60)
(61)
(62)
(63)
(64)
(65)
(66)
(67)
(68)
30
