
Ответы по химии)
.pdf
Ответы на вопросы по химии. Экзамен 2015 год. Всем удачки) Не пуха, ни пера)
1. Основные законы химических превращений: закон сохранения массы вещества, закон постоянства состава.
Закон сохранения массы вещества (Лермонтов, 1748): Масса веществ, вступающих в реакцию равна массе веществ, образовавшихся в результате реакции.
2 4 + = 2 4 + 2 2 +
Закон постоянства состава (Пруст, 1808): Соотношение между массами элементов, входящих в состав данного элемента постоянны и не зависят от способа получения и его местонахождения.
Дальтониды-вещества постоянного состава Бертолиды-вещества переменного состава (зависит от способа получения)
2. Основные законы химических превращений: закон Авогадро и следствия из закона, закон эквивалентов.
Закон эквивалентов:
Эквивалент – количество элемента, который присоединяет или замещает 1 моль атома Н или другого элемента. Эквивалентная масса - масса 1 экв.элемента.(гр/моль)
Экв.соединения - такое его количество, которое в данной реакции взаимодействует с 1 экв.Н или другого вещества.
М
Эквокс = В(валентность)
Эквк−ты = |
|
|
М |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||||
|
осн − ть(кол − во Н) |
|
|
|||||||||
|
|
|
|
|
|
|||||||
Эквосн−я = |
|
|
|
М |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
кисл − ть(кол − во ОН) |
|
|
||||||||||
|
|
|
|
|||||||||
Эквсоли = |
|
|
|
|
М |
|
|
|
|
; |
||
|
|
|
|
|
|
|
|
|
||||
В(валентность)металла |
||||||||||||
|
|
|
||||||||||
Экв 2( 4)3 |
Экв = |
332 |
= 55,3 |
гр |
|
|
||||||
2 3 |
моль |
|||||||||||
|
|
|
|
|
|
|||||||
Вещества взаимодействуют между собой в кол-ве пропорциональных их экв-ов. Закон Авогадро(Авогадро, 1811)
Равные V газов при одинаковых усл-х содержат одинак.число молекул.
1 следствие: 1 моль любого газа при н.у занимает один и тот же V(22.4 л)
2 следствие: Мгаза м.б. вычислена из соотношения плотности определяемого и известного газов, М масса которых
= 1
установлена. 2
3. Строение атома
6 в до н.э Демокрид «Все тела, состоящие из неделимых частиц непрерывно движутся в пустоте атомов» 1741Ломоносов «Элементы мат.химии»-основа атомно-молекулярного учения (а.-м.у)
1811 г Авогадро ввел понятие о молекуле 1810 г Перен док-л опытным путем реальность существования атомов и молекул.
Основные положения а-м.у.:
1.Все вещества состоят из молекул, атомов или ионов. Молекула – мельчашая частица, сохраняющая свойства химических элементов. Атоммельчайшая частица, обуславливающая свойства элементов.
2.Молекулы находятся в постоянном движении
3.Молекула различных веществ отличаются друг от друга массой, размерами, строением и химическими свойствами.
4.Молекулы могут состоять как из атомов одного элемента (простые в-ва), так и из атомов разных элементов (сложные в-ва)
Атомная (молек.)масса – масса атома или молекулы, выражающаяся в атомных молек.ед. (1/12 m атома изотова С12
Относительная атомная (молек.) масса 1 атома
⁄12 атома С
Молярная масса - масса 1 моль вещества.
1911 г Резерфорд(Р) предложил ядерную (планетарную) модель строения атома. 1919 г Р.виделил положительную частицу-протон
1929 г Чедвиг, ученик Р открыл нейтральную частицу-нейтрон (Li: e=3,p=3,n=4)
Изотопы - разновидность атомов, имеющих одинаковый заряд, но разные массовые числа (Н: Протий, Детерий, Тритий).
Гейзенберг «Соотношение (принцип) неопределенности»: Невозможно оперировать точными координатами электрона в данный момент»
4.П.З. Д.И.Менделеева
При жизни Д.И.Менделеева было известно 63 хим.элемента. Его предшественники пытались классифицировать х/э. В основу классификации клали возможность и х.св-ва. Но их попытки не увенчались успехом, т.к. многие х/э имеют переменную валентность. Менделеев в основу классификации положил атомную массу, как постоянное свойство атома, расположив элементы в порядке возрастания атомных масс. На основе таблицы Менделеев сформулировал закон: «Свойства простых тел, а так же формы и свойства их соединений находятся в периодич.зависимости от величины ост.масс».
Менделеев строение атома не знал.
Современная формулировка закона: « Свойства химических элементов и их соединений находятся в периодической зависимости от величины заряда ядра атома».
Эти формулировки закона совпадают, т.к.масса атома сосредоточена в ядре атома. Масса е=9,1*10−28гр
Значение П.З.:
1.П.З. положил начало современной химии, сделал ее единой и целостной наукой. Все х/э находятся во взаимной связи.
2.Появилась возможность предсказывать и описывать новых х/э и их соединения.
3.П.З. помог исправить массы некоторых элементов (B, U, Si…)
4.Развивалось учение о строении атома.
5.П.З. помог получить новые вещества с заданными свойствами.
«П.закону не грозит разрушение, а лишь развитие и надстройка обещаются».
5. Структура таблицы Менделеева.
По периоду слева на права металлические свойства сменяются неметаллическими, т.к. возрастает число элементов на внешнем уровне.
В периодах окислительные свойства возрастают, восстановительные снижаются, в гл.подргуппах восстановительные свойства увеличиваются, окислительные уменьшаются
6. S,P,D,F элементы.
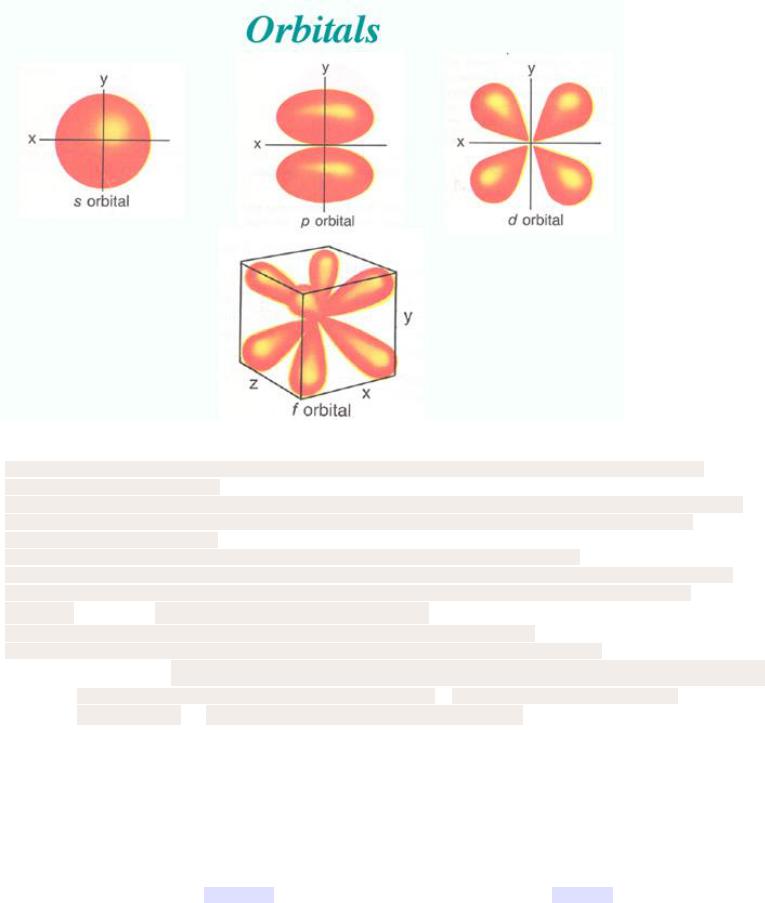
S-элементы I-II групп
P-элементы III-VIII
групп
D –элементы всех побочных групп
F- лактаноиды и актиноиды
№ периода показывает число энергетического уровнч в атомах элементов данного
периода.
7. Ковалентная химическая связь: неполярная, полярная, донорно-акцепторная
Химическая связь — это взаимодействие частиц (атомов, ионов), осуществляемое путем обмена электронами. Различают несколько видов связи Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар),
которое происходит в ходе перекрывания электронных облаков. В образовании ковалентной связи участвуют электронные облака двух атомов.
Различают две основные разновидности ковалентной связи: а) неполярную и б) полярную.
а) Ковалентная неполярная связь образуется между атомами неметалла одного и того лее химического элемента. Такую связь имеют простые вещества, например О2; N2; C12. Можно привести схему образования молекулы
водорода: 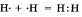 (на схеме электроны обозначены точками).
(на схеме электроны обозначены точками).
б) Ковалентная полярная связь образуется между атомами различных неметаллов. Схематично образование ковалентной полярной связи в молекуле НС1 можно изобразить так:
 Общая электронная плотность оказывается смещенной в сторону хлора, в результате чего на атоме хлора возникает частичный отрицательный заряд
Общая электронная плотность оказывается смещенной в сторону хлора, в результате чего на атоме хлора возникает частичный отрицательный заряд 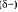 , а на атоме водорода — частичный
, а на атоме водорода — частичный
положительный  . Таким образом, молекула становится полярной:
. Таким образом, молекула становится полярной: 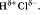 Донорно-акцепторная связь: Такая общая электронная пара может образоваться как в результате спаривания
Донорно-акцепторная связь: Такая общая электронная пара может образоваться как в результате спаривания
двух неспаренных электронов, принадлежащих разным атомам (обычный механизм образования связи), так и эа счет пары электронов одного атома — донора — и вакантной орбитали второго атома — акцептора (донорноакцепторный механизм образования связи)
8. Насыщаемость и направленность ковалентной связи.
Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т.е. их способностью к образованию строго определенного числа связей, которое обычно лежит в пределах от 1 до 6. Общее число валентных орбиталей в атоме, т.е. тех, которые могут быть использованы для образования химических связей, определяет
максимально возможную валентность элемента. Число уже использованных для этого орбиталей определяет валентность
элемента в данном соединении.
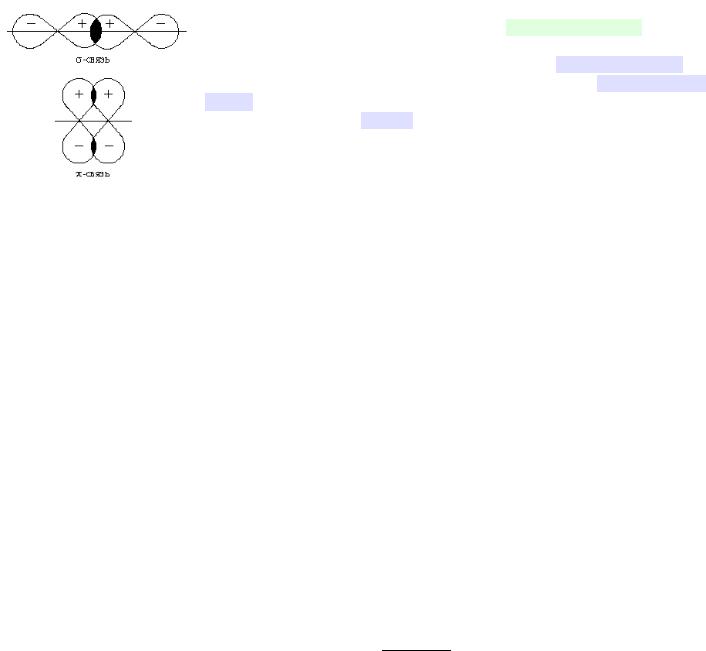
Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами. Это достигается при такой пространственной направленности перекрывания электронных облаков, которая совпадает с ихсобственной. Исключение составляют s-электронные облака, поскольку их сферическая форма делает все направления равноценными. Для p- и d-электронных облаков перекрывание осуществляется вдоль оси, по которой они вытянуты, а образующаяся при этом связь называется σ-связью. σ-Связь имеет осевую симметрию, и оба атома могут вращаться вдоль линии связи, т.е. той воображаемой линии, которая проходит через ядра химически связанных атомов.
9. Ионная, водородная и металлическая химические связи.
Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностью) электроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью
Металлическая связь — химическая связь между атомами в металлическом кристалле, возникающая за счёт обобществления их валентных электронов
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, Oили F. Водородные связи могут быть межмолекулярными или внутримолекулярными
10. Химическое равновесие. Принцип Ле Щателье.
Х.Р.-состояние системы реагирующих веществ, при котором скорость прямых и обратных реакций равны.
Все х/р делятся на обратимые (идут до конца, так как ни одно из реагирующих веществ не расодуется полностью) и необратимые (заканчиваются при полном израсходовании одного из реагирующих веществ (осадок, газ, слабый электролит)) реакции.
Для реакии аА+bB  cC+dD константа х/р имеет вид
cC+dD константа х/р имеет вид
[ ] [ ] [ ] [ ]
При х/р произношение концентраций получащихся веществ, деленное напроизведение концентраций исходных веществ, представляющих собой постоянную величину, названную для данной реакции.
Принцип Ле Шателье : Если на систему, находящуюся в равновесии оказывать какое-либо воздействие, то равновесие будет стремиться его уменьшить (кипение, кристаллизация, растворение)
11. Понятие о катализе
Катализ-х/р, протекающая с катализатором.
Катализы изменяют скорость х/р, но сами в процессе остаются в неизменном количестве; не влияют на хим.равновесие, т.к. они в равной степени влияют на химическое равновесие.
12. Способы выражения концентрации раствора.
Концентрация раствора – содержание растворенного вещества в определенной масса или V раствора или растворителя.

1.Процентная концентрация – масса вещества в 100 гр раствора С% = вещ−ва 100%
р−ра
2. |
Молярная концентрация – кол-во в 1 л р-ра С |
|
= ; = |
; |
= 1000 (моль/л); |
|||||||
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
3. |
Моляльная концентрация – кол-во в 1 кг р-ля |
|
= ; |
= 1000 (моль/кг) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
4. |
Нормальная концентрация (Молярная концентрация Экв.) – кол-во моль Э в 1 л р-ра. |
|||||||||||
|
= э ; э = ; = |
1000 (гр/мл) |
|
|
|
|
|
|
|
|||
|
|
Э |
э |
|
|
|
|
|
|
|
||
5. |
Титр Т = ; = Э ; T= |
Э |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||||
|
|
1000 |
1000 |
|
|
|
|
|
|
|
||
13. Теория электролитической диссоциации. (Орениус, 1887)
Эл.Д- распад электролита на ионы под действием растворителя.
Основные положения:
1.Электролиты (+ и - заряженные)
2.Под действием электрического тока +ч-катод (катионы), -ч-анод (анионы)
3.Общий заряд катионов в растворе = общему заряду анионов в растворе (Р-р электронейтрален)
4.Диссоциация обратимый процесс
5.Ионы и атомы одних и тех же элементов отличается по свойствам.
Примеры:
KCl= + + −
2 4 = + + 4−
4− = + + 4−
14. Степень диссоциации. Слабые и сильные электролиты. Константа диссоциации.
В растворах некоторых электролитов диссоциирует лишь часть молекул. Способность вещества к электролитической диссоциации называется степенью диссоциации. Она показывает отношение числа молекул, продиссоциированных на ионы, к общему числу молекул растворенного электролита:
1.Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3, H2SO4 ).
2.Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относятводу, ряд кислот (слабые кислоты, такие как HF), основания p-, d-, и f- элементов
Константа диссоциации — вид константы равновесия, которая характеризует склонность
объекта диссоциировать (разделяться) обратимым образом на частицы, как например когда комплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы. Константа диссоциации обычно обозначается Kd и обратна константе ассоциации.
15. Ионное произведение воды. Водородный показатель.
Ионное произведение воды — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолизаводы
Водородный показатель, pH (лат. pondus Hydrogenii — «вес водорода», произносится «пэ аш») — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, количественно выражающая его кислотность. Равен по модулю и противоположен по знаку десятичномулогарифму активности водородных ионов, выраженной в молях на один литр
16. Гидролиз солей (определение, типы)
Гидролиз - взаимодействие ионов соли с водой, приводящее к образованию слабого электролита.
Типы гидролиза:
1.Слабая к-та+сильное осн-е=соль (г-з по аниону, реакция щелочная)
2 + 2 = 2 + 2
2+ + 2− + 2 |
= 2+ + 2− + + 2− |
|
2 |
2− + 2 = 2 + 2
2.слабое основание+сильная кислота = соль (г-з по катиону, р-я кислая)
4 + = 4 +
4+ + − + + − = 4 + + + −4− + + − = 4 + +
3.слабое основание+слабая к-та=соль (г-з по катиону и аниону, р-я: большеOH - щелочная, больше Н – кислая
(3)2 + = ( )2 + 32+ + 3 − + + − = 2+( )−2 + 3 − +
4.сильное основание + сильная к-та=соль (гидролиз не идет)
17. Механизм ОВР.
ОВР – реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ.
Основные положения т.ОВР:
1.Окислением называется процесс отдачи е атомом, молекулой или ионом, С.О повышается.
2.Восстановлением называется процесс присоединения е атомом, молекулой или ионом, С.О понижается.
3.Атом, молекула или ионы, отдающие е являются восстановителями. Во время реакции они окисляются.
4.Атом, молекула или ионы, принимающие е являются окислителями. Во время реакции они восстанавливаются.
5.Окисление сопровождается восстановлением и наоборот. Число отданных е= числу принятых е В периодах окислительные свойства возрастают, восстановительные снижаются, в гл.подргуппах восстановительные свойства увеличиваются, окислительные уменьшаются.
18.Методы составления уравнений ОВР.
Существуют два метода составления окислительно - восстановительных реакций - метод электронного баланса и метод полуреакций.
Электронный баланспример:
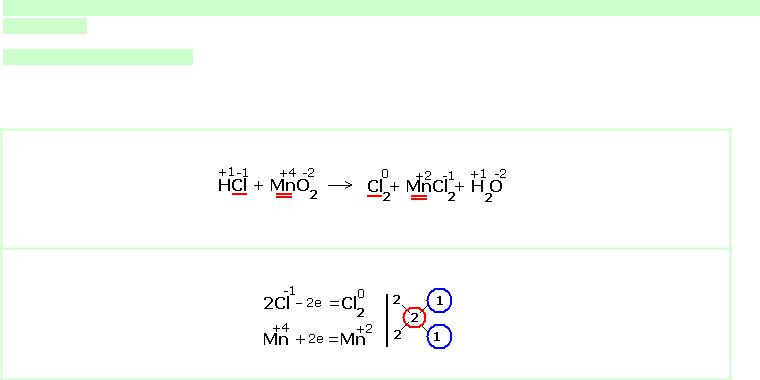
Расставить коэффициенты в реакции, схема которой:
HCl + MnO2  Cl2 + MnCl2 + H2O
Cl2 + MnCl2 + H2O
1.Указываем степени окисления химических элементов.
Подчёркнуты химические элементы, в которых изменились степени окисления.
2.Составляем электронные уравнения, в которых указываем число отданных и принятых электронов.

За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное ( взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок). Значит перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2 тоже -1.
Перед HCl коэффициент 2 не ставим, а считаем число атомов хлора в продуктах реакции. Оно равно - 4.Следовательно и перед HCl ставим - 4,уравниваем число атомов водорода и кислорода справа, поставив перед H2O коэффициент - 2. В результате получится химическое уравнение:
 метод полуреакций взорвет вам мозг, к тому же он навряд ли поместится даже на 2-3 шпорах , поэтому подучите получше его)
метод полуреакций взорвет вам мозг, к тому же он навряд ли поместится даже на 2-3 шпорах , поэтому подучите получше его)
19.Влияние реакции среды на характер протекания ОВР.
1.Природа реагирующих веществ
2.Реакция среды
3.Концентрация
4.Т
5.Катализаторы
20.Основные положения координационой теории
1.Центральное местозанимает комплексообразователь (КО)- обычно + заряженный ион (чаще метал
(Ме): 2+; 2+.
2.Вокрут КО располагаются лианды (Л) – отр.заряженные или нейтральные молекулы: −, 4
3.КО и Л образуют внутреннюю сферу комплексного соединения (КС), которое при написании заключается в скобки [ ] и называется комплексным ионом.
4.Ионы, не вошедшие во внутр.сферу, составляет внешнюю сферу, например, : 2−,2−
5.Числом Л, удерживаемых КО, называется координационным числом (КЧ), например, : 2+ = 4, 2+ = 4
КЧ в 2 раза больше КО.
Важнейшие КО: : +, 2+, 2+, 2+, 3+, 3+, 2+, 2+, 2+, 4+, 2+, 3+ и др.
Важнейшие Л: ионы : − и ионы кислотных остатков, полярные молекулы : 2, 3, , и др.
21.Номенклатура комплексных соединений
Влюбом соединении в начале называется анион в И.п., затем катион в Р.п.
1.Если в соединение входит К.анион, то сначала называют Л греч.числителем: 1 – моно, 2 – ди, 3 – три, 4 –
тетра, 5 – пента, 6 – гекса, 7 – гепта, 8 – окта
2. Затем |
Л |
с |
окончание |
|
«…о»: |
: |
−хлоро, −бромо, −йодо, −фторо, −нитрито, 2−сульфито, |
2−оксалато, −аммино, |
|||||
|
|
2 |
3 |
2 |
4 |
3 |
−нитрато, −циано, −родано, −гидроксо, 2−сульфато, 2−карбонато, акво. |
||||||
3 |
|
|
4 |
|
3 |
2 |
3.Затем следует латинское название КО с окончанием «…ат» и указанием ст.ок.
4.В конце называется катион внешней среды : 2[4] − тетрахлорплатинат (2) калия
5.Если в соединение входит К.анион, то сначала называют анион внешней сферы, а затем указывают число Л, название Л, затем русское название КО с указанием ст.ок: 2+(3)4 2 – хлорид тетраамминомеди
(2)
22.Оксиды: определение, классификация, свойства
Оксид — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менееэлектроотрицательным элементом.
Классификация В зависимости от химических свойств различают:
Солеобразующие оксиды: основные оксиды (например, оксид натрия Na2O, оксид меди(II) CuO): оксиды металлов, степень окисления которых I—II; кислотные оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2): оксиды металлов со степенью окисления V—VII и оксиды неметаллов;
амфотерные оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3): оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO); Несолеобразующие оксиды: оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO.
Свойства : При взаимодействии кислотного оксида с основным образуется соль. Оксиды взаимодействуют с водой, если образуется растворимая кислота или растворимое основание. Основные взаимодействуют с кислотами, а кислотные с основаниями
23. Кислоты: определение, классификация, свойства
Кисло́ты — химические соединения, способные отдавать катион водорода (кислоты Брёнстеда) либо соединения, способные принимать электронную пару с образованием ковалентной связи. принято классифицировать по различным формальным признакам:
1) По содержанию атомов кислорода :бескислородные (HCl, H2S);кислородсодержащие |
(HNO3, H2SO4). |
2)По количеству кислых атомов водорода[10]:одноосновные (HNO3)двухосновные (H2SeO4);трёхосновные (H3PO4, H3BO3);многоосновные.
3)По силе Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10−3 (HNO3);Слабые — константа диссоциации меньше 1·10−3 (уксусная кислота Kд= 1,7·10−5).
4)По устойчивостиУстойчивые (H2SO4);Неустойчивые (H2CO3).
5 ) По принадлежности к классам химических соединений :Неорганические (HBr);Органические (HCOOH,CH3COOH);
6)По летучестиЛетучие (HNO3,H2S, HCl);Нелетучие (H2SO4) ;
7)По растворимости в водеРастворимые (H2SO4);Нерастворимые (H2SiO3);
Кислоты бывают газообразные, жидкие и твердые. Некоторые имеют запах и цвет. Кислоты отличаются различной растворимостью в воде.
24. Основания: определение, классификация, свойства
Основание — это химическое соединение, способное образовывать ковалентную связь с протоном либо с вакантной орбиталью другого химического соединения В узком смысле под основаниями понимают осно́вные гидроксиды — сложные вещества, при диссоциации которых в водных растворах отщепляется только один вид анионов — гидроксид-ионы OH-[2].
Классификация :
По растворимости в воде основания делят на щелочи (растворимые в воде основания) и нерастворимые в воде основания. Щелочи образуют щелочные и щелочноземельные металлы, а также некоторые другие элементы-металлы. По кислотности (числу ионов ОН–, образующихся при полной диссоциации, или количеству ступеней диссоциации) основания подразделяют на однокислотные (при полной диссоциации получается один ион ОН–; одна ступень диссоциации) и многокислотные (при полной диссоциации получается больше одного иона ОН–; более одной ступени диссоциации). Среди многокислотных оснований различают двухкислотные (например, Sn(OH)2), трехкислотные (Fe(OH)3) и четырехкислотные (Th(OH)4). Однокислотным является, например, основание КОН.
Выделяют группу гидроксидов, которые проявляют химическую двойственность. Они взаимодействую как с основаниями, так и с кислотами. Это амфотерные гидроксиды
25. Соли: определение, классификация, свойства
Соли — это сложные вещества, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков. Есть ещё одно определение: солями называют вещества, которые могут быть получены при взаимодействии кислот и оснований с выделением воды
Таблица - Классификация солей по составу
СОЛИ
|
Средние |
|
Кислые(гидросоли)- |
|
Основные(гидроксосоли) - |
|
Двойные -содержат |
|
Смешанные - |
|
Комплексные |
|
(нормальные) - |
|
продукт неполного |
|
продукт неполного |
|
два разных металла и |
|
содержат один металл |
|
[Cu(NH3)4]SO4 |
|
продукт полного |
|
замещения атомов |
|
замещения ОН-групп |
|
один кислотный |
|
и несколько |
|
|
|
замещения атомов |
|
водорода в кислоте на |
|
основания на кислотный |
|
остаток |
|
кислотных остатков |
|
|
|
водорода в кислоте на |
|
металл |
|
остаток |
|
КNaSO4 |
|
CaClBr |
|
|
|
металл |
|
КHSO4 |
|
FeOHCl |
|
|
|
|
|
|
|
AlCl3 |
|
|
|
|
|
|
|
|
|
|
1. Окислительно-восстановительные реакции солей.Поскольку соли состоят из ионов металла и кислотного остатка, их окислительно-восстановительные реакции условно можно разбить на две группы: реакции за счет иона металла и реакции за счет кислотного остатка, если в этом кислотном остатке какой-либо атом способен менять степень окисления.
а) Реакции за счет иона металла. Поскольку в солях содержится ион металла в положительной степени окисления, они могут участвовать в окислительно-восстановительных реакциях, где ион металла играет роль окислителя. Восстановителем чаще всего служит какой-нибудь другой (более активный) металл. Приведем пример:

Hg2+SO4 |
+ |
Sn0 |
= Hg0 + |
Sn2+SO4 |
соль менее |
|
более активный |
|
|
активного |
|
металл |
|
|
металла |
|
(восстановитель) |
|
|
(окислитель) |
|
|
|
|
Принято говорить, что более активные металлы способны вытеснять другие металлы из их солей. Металлы, находящиеся в ряду активностилевее , являются более активными. Нетрудно заметить, что это те же реакции металлов с солями (см. пункт 10 предыдущего раздела).
б) Реакции за счет кислотного остатка. В кислотных остатках часто имеются атомы, способные изменять степень окисления. Отсюда – многочисленные окислительно-восстановительные реакции солей с такими кислотными остатками. Например:
Na2S–2 |
+ |
Br20 |
= |
S0 |
+ |
2 NaBr–1 |
|
|
|
соль |
|
|
|
сера |
|
|
|
|
|
сероводородной |
|
|
|
|
|
|
|
|
|
кислоты |
|
|
|
|
|
|
|
|
|
2 KI–1 |
+ |
H2O2–1 |
|
+ H2SO4 |
= I20 |
+ K2SO4 |
+ 2 H2O–2 |
||
соль |
|
|
|
|
|
иод |
|
|
|
иодоводородной |
|
|
|
|
|
|
|
|
|
кислоты |
|
|
|
|
|
|
|
|
|
2 KMn+7O4 + |
16 HCl–1 |
= |
5 Cl20 |
+ |
2 KCl |
+ |
2 Mn+2Cl2 |
+ 8 H2O |
|
соль |
|
|
|
|
|
|
|
хлорид |
|
марганцовой |
|
|
|
|
|
|
|
марганца |
|
кислоты |
|
|
|
|
|
|
|
|
|
2 Pb(N+5O3–2)2 |
|
= |
|
2 PbO |
+ |
4 N+4O2 |
+ |
O20 |
|
соль азотной |
|
при |
|
|
|
|
|
|
|
кислоты |
|
нагревании |
|
|
|
|
|
|
|
2. Обменные реакции солей.Такие реакции могут происходить в растворах, когда соли реагируют: а) с кислотами, б) с щелочами, в) с другими солями. Например:
а) CuSO4 + H2S = CuS↓ (осадок) + H2SO4
AgNO3 + HCl = AgCl↓ (осадок) + HNO3
б) FeCl3 + 3 NaOH = Fe(OH)3↓ (осадок) + 3 NaCl
CuSO4 + 2 KOH = Cu(OH)2↓ (осадок) + K2SO4
в) BaCl2 + K2SO4 = BaSO4↓ (осадок) + 2 KCl
CaCl2 + Na2CO3 = CaCO3↓ (осадок) + 2 NaCl
Некоторые из этих реакций уже встречались в опытах из первой части параграфа.Во всех случаях один из продуктов обменной реакции обязательно должен покидать реакционную смесь в виде осадка или газообразного вещества. Либо должно получаться прочное соединение, не распадающееся в растворе на ионы (например, вода в реакции нейтрализации). Если эти условия не выполняется, то при смешивании реагентов в лучшем случае образуется смесь не реагирующих между собой ионов - реакция не идет.
2. Предмет, задачи и методы аналитической химии.

Аналити́ческая хи́мия — раздел химии, изучающий химический состав и отчасти структуру веществ; имеет целью определение химических элементов или групп элементов, входящих в состав веществ.[1]
Предмет : совершенствование существующих и разработка новых методов анализа, поиск возможностей их практического применения, исследование теоретических основ аналитических методов.
Методы : качественный (обнаружить или открыть элементы или ионы, из которых состоит вещество) и количественный (определить количество элементов или ионов в иследуемом веществе).
3. Понятие качественного анализа: аналитическая реакция, реагент, аналитическая группа, групповой реагент, обнаруживаемый минимум, минимальная концентрация, специфическая (частная) аналитическая реакция, селективные (избирательные) реакции, характерные и групповые реакции, дробный и систематический ход анализа.
Аналитическая реакция – это реакция, которая сопровождается внешним эффектом (выпадение осадка, выделение газа, изменение цвета и т.д.).
Реагент - вещество, вызывающее аналитическую реакцию
Групповой реагент – реакции или реактивы, при помощи которых можно выделить группу ионов.
Обнаруживаемый минимум (ɣ)- это наименьшее количество иона, которое удаетсяобнаружить с помощью данной реакции (при соблюдении необходимых условий). Выражают в микрограммах . (lγ = 1 мкг = 10 -6 г).
Например, при обнаружении иона К+ в виде гексахлороплатината (IV) калия K2[PtCl6] обнаруживаемый минимум составляет 0,1 мкг. Минимальная концентрация показывает, при каком разбавлении раствора реакция еще дает положительный результат.
Селективными, или избирательными, называют реакции, позволяющие в смеси ионов обнаруживать ограниченное число катионов или анионов. Так, при действии NH.SCN на смесь катионов только два катиона образуют растворимые окрашенные комплексные соединения: [Fe(SCN)6]3_ и (Co(SCN),]2-.
Специфическими называют аналитические реакции, аналитический эффект которых характерен только для одного иона в присутствии других ионов. Таких реакций крайне мало. Ионы аммония, к примеру, можно обнаружить в смеси ионов, действуя на анализируемые образцы избытком раствора щелочи:
Систематический ход анализа основан на последовательном выделении из растворов отдельных групп ионов, на подразделении этих групп на подгруппы и на выделении отдельных ионов из подгрупп. Выделенные из растворовионы определяют при помощи соответствующих реакций. Дробный метод основан на применении реакций, с помощью которых в любой последовательности можно обнаружить искомые ионы в отдельных небольших порциях исследуемого раствора. Пользуясь дробным методом, отпадает необходимость выделения исследуемых ионов из растворов.
4. Химические методы качественного анализа и условия проведения реакций.
Методы качественного анализа делятся на химические, физикохимические и физичекие.
Физические метода основаны на изучении физических свойств анализируемого вещества. К этив методам относятся спектральны1, рентгеноструктурный и т.д.
Ф физико-химических методах течение реакции фиксируется измерением определенного физического свойства исследуемого раствора. К этим методам относятся полярность, хроматография и т.д.
К химическим методам относятся методы, основанные на использовании химических свойств исследуемых веществ. Выполнение каждой аналитической реакции требует соблюдение определенных условий ее проведения, важными из которых является:
Концентрация
Среда раствора
Температура
5. Классификация катионов и анионов.
|
Группа |
|
Катионы |
|
Групп.реагент |
|
||
|
1 |
|
|
K+,Na+,NH4+ |
|
- |
|
|
|
2 |
|
|
Ag+,Pb+2,Hg2+2 |
HCL разбавленный |
|
||
|
3 |
|
|
Ba+2,Ca+2,Sr+2 |
|
H2SO4 разб |
|
|
|
4 |
|
|
Zn+2,Al+3,Cr+3 |
|
NaOH или KOH в |
|
|
|
|
|
|
|
|
|
избытке |
|
|
5 |
|
|
Fe+2,Fe+3,Mn+2,Mg+2 |
|
NaOH или KOH в |
|
|
|
|
|
|
|
|
|
избытке |
|
|
6 |
|
|
Cu+2,Co+2,Hg+2 |
|
NH4OH в избытке |
|
|
|
|
|
|
|
|
|
||
Группа |
|
|
Анионы |
|
|
Групп реаг |
||
1 |
|
|
SO4-2,CO3-2,PO4-3,SiO3-2,SO3-2 |
|
BaCL2 в нейтр. Или слабо.щелоч. |
|||
2 |
|
|
|
CL-, S+2,Br-,J- |
|
|
AgNO3 в присутс. HNO3 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
NO3-,NO2-,CH3COO |
|
|
|
|
30. Количественный анализ (определение, осадительная и весовая формы, титрирование, титрант, титр, аликвота, точка эквивалентности, конечная точка титрирования, индикатор)
Количественный анализ – определение количества элементов или соединений в анализируемом растворе. Титрирование (Т) – процесс постепенного переливания титранта к анализируемому р-ру.
Титрант – р-р реагента с известным титром, с помощью которого проводят титрирование.
