
- •Глава 1. Политропные процессы.
- •Уравнение процесса
- •Теплоемкость политропных процессов
- •Энергетические характеристики политропных процессов Изменение энтропии
- •Работа расширения /сжатия в политропном процессе.
- •I закон термодинамики
- •Пример №1:
- •Пример №2:
- •Глава 2. Теплообменные аппараты.
- •Конструкции теплообменников
- •Глава 3. Законы термодинамики.
- •Разделы термодинамики
- •Физический смысл термодинамики Необходимость термодинамики
- •Законы — начала термодинамики
- •Основные формулы термодинамики Условные обозначения
- •Формулы термодинамики идеального газа
- •Термодинамика сплошных сред
- •Список литературы.
Основные формулы термодинамики Условные обозначения
|
Обозначение |
Название величины |
Размерность / Значение |
Формула |
|
|
Абсолютная температура |
K |
|
|
|
Давление |
Па |
|
|
|
Объём |
м³ |
|
|
|
Средняя энергия молекулы |
Дж |
|
|
|
Средняя кинетическая энергия молекулы |
Дж |
|
|
|
Масса |
кг |
|
|
|
Молярная масса |
кг/моль |
|
|
|
Постоянная Авогадро |
6.0221415(10)·1023 моль-1 |
|
|
|
Постоянная Больцмана |
1.3806505(24)·10−23 Дж/К |
|
|
|
Газовая постоянная |
8.314472(15) Дж/(К·моль) |
|
|
|
Число степеней свободы молекулы |
- |
|
|
|
Количество
вещества в |
моль |
|
|
|
вектор
с координатами |
моль |
|
|
|
Химический
потенциал |
Дж/моль |
|
|
|
Внутренняя энергия |
Дж |
|
|
|
Энтропия |
Дж/К |
|
|
|
Энтальпия |
Дж |
|
|
|
Изохорно-изотермический потенциал (свободная энергия Гельмгольца) |
Дж |
|
|
|
Изобарно-изотермический потенциал (свободная энергия Гиббса, свободная энтальпия) |
Дж |
|
|
|
Работа, совершённая газом |
Дж |
|
|
|
Тепло, переданное газу |
Дж |
|
|
|
Молярная теплоёмкость газа при постоянном давлении |
Дж/(К·моль) |
|
|
|
Молярная теплоёмкость газа при постоянном объёме |
Дж/(К·моль) |
|
|
|
Удельная теплоёмкость |
Дж/(К·кг) |
|
|
|
Показатель адиабаты |
- |
|
Формулы термодинамики идеального газа
|
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) |
|
|
Изменение внутренней энергии газа |
|
|
Работа газа |
|
|
Средняя энергия молекулы газа |
|
|
Средняя кинетическая энергия молекулы газа: |
|
|
Внутренняя энергия газа |
|
|
Теплоёмкость газа при постоянном объёме |
|
|
Теплоёмкость газа при постоянном давлении |
|
Выражение основных величин через термодинамические потенциалы
Все
термодинамические потенциалы имеют
свои канонические наборы переменных и
используются для анализа процессов при
соответствующих условиях. Так, для
изотермических изохорических процессов
(![]() )
удобно использовать
)
удобно использовать ![]() ,
для изотермических изобарических
(
,
для изотермических изобарических
(![]() ) —
) — ![]() ,
а для изолированных систем (
,
а для изолированных систем (![]() ) —
) — ![]() .
.
Термодинамический
потенциал ![]() (энтропия)
(энтропия)![]() —
независимые переменные;
—
независимые переменные;
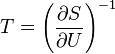 ;
; ;
;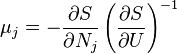 ;
; ;
; ;
;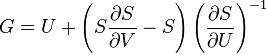 .
.
Термодинамический
потенциал ![]() (свободная
энергия Гельмгольца)
(свободная
энергия Гельмгольца)
![]() —
независимые переменные;
—
независимые переменные;
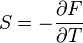 ;
;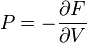 ;
; ;
;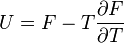 ;
;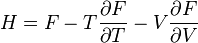 ;
;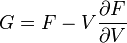 .
.
Термодинамический
потенциал ![]() (энергия
Гиббса)
(энергия
Гиббса)
![]() —
независимые переменные;
—
независимые переменные;
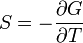 ;
;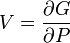 ;
;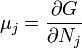 ;
;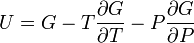 ;
;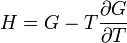 ;
;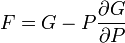 .
.
Термодинамический
потенциал ![]() (внутренняя
энергия)
(внутренняя
энергия)![]() —
независимые переменные;
—
независимые переменные;
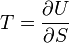 ;
;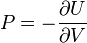 ;
;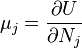 ;
;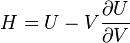 ;
;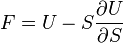 ;
;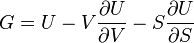 .
.
Фундаментальное уравнение Гиббса, экстенсивность и уравнение Гиббса — Дюгема
Выражение для полного дифференциала внутренней энергии называется фундаментальным уравнением Гиббса или просто уравнением Гиббса:
![]()
Значимость этого уравнения (и его более общих вариантов) состоит в том, что оно представляет собой тот фундамент, на котором базируется весь математический аппарат современной феноменологической термодинамики, как равновесной, так и неравновесной. По большому счёту, рассмотренные выше законы (начала) термодинамики нужны были именно для обоснования этого соотношения. Всю аксиоматику равновесной термодинамики можно свести к постулированию самого этого уравнения и свойств входящих в него термодинамических переменных.
С использованием других термодинамических потенциалов уравнение Гиббса можно переписать в следующих эквивалентных формах:
![]()
![]()
Среди
термодинамических величин
выделяют экстенсивные (внутренняя
энергия, энтропия, объём и др.)
и интенсивные (давление,
температура и др.) величины. Величина
называется экстенсивной, если ее значение
для системы, сложенной из нескольких
частей, равно сумме значений этой
величины для каждой части. Предположением
об экстенсивности термодинамических
величин, однако, можно пользоваться,
если рассматриваемые системы достаточно
большие и можно пренебречь различными
краевыми эффектами при соединении
нескольких систем, например,
энергией поверхностного
натяжения.
Пусть U (экстенсивная величина) является
однородной функцией первого порядка
от своих экстенсивных аргументов
(математическое выражение аксиомы
экстенсивности):
для любого ![]()
![]()
Для
любой дифференцируемой однородной
функции первого порядка ![]() выполняется
теорема Эйлера:
выполняется
теорема Эйлера:
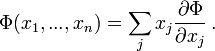
Для
энергии ![]() теорема
Эйлера имеет вид:
теорема
Эйлера имеет вид:
![]()
Отсюда легко следует уравнение Гиббса — Дюгема:
![]()
Это
уравнение показывает, что между
интенсивными переменными существует
одна связь, являющаяся следствием
предположения об аддитивности свойств
системы. В частности, непосредственным
следствием соотношений Гиббса-Дюгема является
выражение для термодинамического
потенциала Гиббса через химические
потенциалы ![]() компонент
смеси:
компонент
смеси:
![]()
