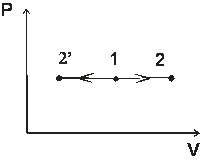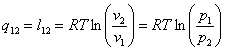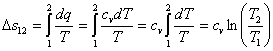- •Глава 1. Политропные процессы.
- •Уравнение процесса
- •Теплоемкость политропных процессов
- •Энергетические характеристики политропных процессов Изменение энтропии
- •Работа расширения /сжатия в политропном процессе.
- •I закон термодинамики
- •Пример №1:
- •Пример №2:
- •Глава 2. Теплообменные аппараты.
- •Конструкции теплообменников
- •Глава 3. Законы термодинамики.
- •Разделы термодинамики
- •Физический смысл термодинамики Необходимость термодинамики
- •Законы — начала термодинамики
- •Основные формулы термодинамики Условные обозначения
- •Формулы термодинамики идеального газа
- •Термодинамика сплошных сред
- •Список литературы.
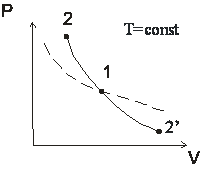
Работа расширения /сжатия в политропном процессе.
Работа расширения /сжатия в политропном процессе.
![]() ;
; ![]()
Используя связь параметров, можно найти значение интеграла работы.
![]()
![]()
![]()
Параметры состояния в граничных точках известны, известен показатель политропы n
Подставляем
полученную функцию ![]() в
уравнение для работы и интегрируем
в
уравнение для работы и интегрируем
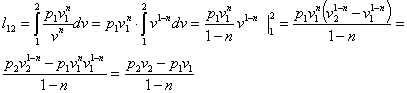
Можно получить и другие формулы для расчета работы.
Применяя
уравнение состояния идеального газа ![]() ,
получаем
,
получаем
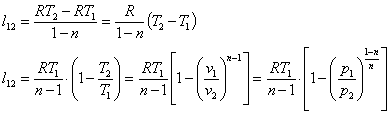
Располагаемая работа
Располагаемая
работа:![]()
![]()
![]()
Количество теплоты
Теплота является формой обмена энергией между системой и ОС. При этом обмен энергией происходит на микроуровне.
Q = ![]()
![]() T
T
![]()
![]() =
= ![]() =
= ![]()
![]() T,
T, ![]() –
удельное количество теплоты.
–
удельное количество теплоты.
![]()
![]()
Изменение внутренней энергии
Внутренняя энергия ТДС зависит от температуры рабочего тела. В ТДС абсолютное значение внутренней энергии не определяют. Имеет смысл только ее изменение в термодинамическом процессе. Для идеального газа:
∆u12 = ![]() ;
; ![]()
![]()
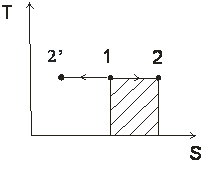
Изменение энтальпии
Одной из энергетических характеристик ТДС является тепловая функция или энтальпия.
Если
термомеханическую систему рассматривать
как состоящую из макротела (газа) и
поршня с грузом P = ![]() ,
уравновешивающего давление газа
,
уравновешивающего давление газа ![]() внутри
сосуда, то такая система называется
расширенной. Энтальпия или энергия
такой системы E равна
внутренней энергии газа U плюс
потенциальная энергия поршня с грузом
внутри
сосуда, то такая система называется
расширенной. Энтальпия или энергия
такой системы E равна
внутренней энергии газа U плюс
потенциальная энергия поршня с грузом ![]()
I = E = U + ![]()
Энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объемом V ввести в окружающую среду, имеющую давление p и находящуюся c телом в равновесном состоянии. Энтальпия системы I аналогично внутренней энергии имеет вполне определенное значение для каждого состояния, т.е. является функцией состояния. В процессе изменения состояния
![]()
I закон термодинамики
Для политропного процесса уравнение I закона термодинамики можно записать в виде:
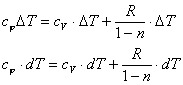
![]() =
=![]() +
+![]() уравнение
Майера.
уравнение
Майера.
При
p=const ![]() n=0
n=0 ![]()
Частные случаи политропных процессов
изобарный Р=const
|
n=0 |
|
|
|
Уравнение процесса |
| |
|
Теплоемкость |
| |
|
Изменение энтропии |
| |
|
Работа расширения |
| |
|
Количество теплоты |
| |
|
Изменение внутренней энергии |
| |
|
Изменение энтальпии |
| |
|
I закон термодинамики |
| |
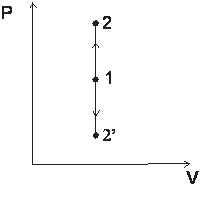
изотермический T=const
|
n=1 |
|
|
|
Уравнение процесса |
| |
|
Теплоемкость |
| |
|
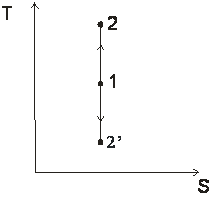
Изменение энтропии |
ds=
| |
|
Работа расширения |
| |
|
Количество теплоты |
| |
|
Изменение внутренней энергии |
| |
|
Изменение энтальпии |
| |
|
I закон термодинамики |
Вся подведенная теплота идет на совершение работы. | |
адиабатный dq=0
|
n=k
|
|
|
|
Уравнение процесса |
| |
|
Теплоемкость |
| |
|
Изменение энтропии |
ds= | |
|
Работа расширения |
| |
|
Количество теплоты |
| |
|
Изменение внутренней энергии |
| |
|
Изменение энтальпии |
| |
|
I закон термодинамики |
Работа совершается за счет внутренней энергии | |
изохронный V=const
|
n=±∞ |
|
|
|
Уравнение процесса |
| |
|
Теплоемкость |
| |
|
Изменение энтропии |
| |
|
Работа расширения |
| |
|
Количество теплоты |
| |
|
Изменение внутренней энергии |
| |
|
Изменение энтальпии |
| |
|
I закон термодинамики |
Вся подведенная теплота идет на изменение внутренней энергии | |
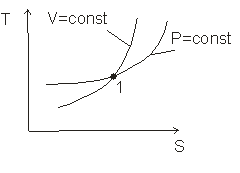
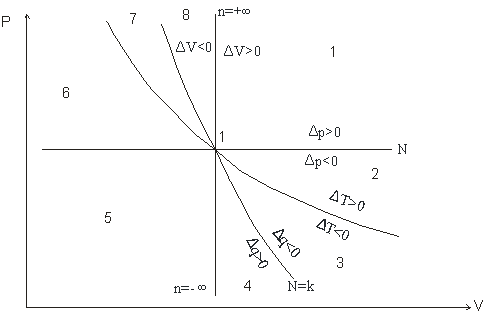
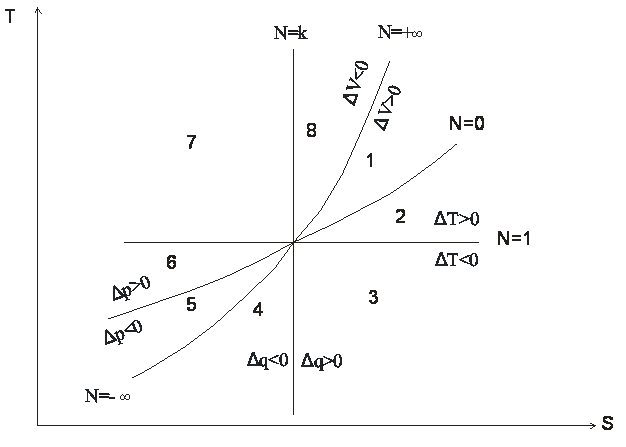
Обобщенная диаграмма политропных процессов.
Для анализа политропных процессов удобно пользоваться обобщенной диаграммой. На ней изображаются все изопроцессы и выделяются области, в пределах которых знаки слагаемых I закона одинаковы.
|
|
|
|
|
|
Рабочая диаграмма |
|
|
|
|
|
|
|
|
|
|
|
Тепловая диаграмма |
|
Диаграмма позволяет проанализировать любой политропный процесс и определить условия, при которых этот процесс может быть реализован, то есть, как распределяется теплота между внутренней энергией и работой, что будет с температурой системы и т.д.
Любой процесс, лежащий выше изобары проведённой через точку 1 сопровождается ростом давления.
Любой процесс, лежащий выше изотермы сопровождается ростом температуры, внутренней энергии и энтальпии.
Любой процесс, лежащий правее адиабаты сопровождается ростом энтрапии и подводом теплоты.
Любой процесс, лежащий правее изохоры идёт с ростом объёма и работа в процессе положительна.